骨髓间充质干细胞条件培养液对H2O2损伤HepG2细胞保护作用的研究
2019-07-11王东明邢晓伟叶晓梅李宝红苟占平吴都督广东医科大学药学院广东东莞523808
王东明,邢晓伟,叶晓梅,陈 稚,李宝红,苟占平,吴都督 (广东医科大学药学院,广东东莞 523808)
随着社会人口的老龄化,阿尔兹海默症(Alzheimer disease,AD)、帕金森症(Parkinson disease, PD)等神经退行性疾病的发病率逐年增加,给社会和家庭都带来了沉重的负担。然而,目前该类疾病的病因存在很多的可能性和不确定性[1]。近年的研究表明,线粒体功能障碍、内质网应激、氧自由基损伤等能造成氧化性损伤参与了其致病过程,氧化应激在神经退行性疾病的发生发展过程中起着重要的作用[2-5]。因此,抗氧化治疗为该类疾病的治疗提供了依据。近年的大量研究表明,间充质干细胞具有潜在的多向分化能力,它能在机体的损伤部位分泌许多不同的神经营养因子,这些因子能促进该损伤部位血管增生、组织再生等,因此其可修复中枢神经系统疾病的损伤及促进组织功能的改善[6-9]。进一步研究发现,骨髓间充质干细胞发挥治疗作用在一定程度上也与其分泌的细胞因子有关[10-11]。由于HepG2细胞常被用于构建氧化应激损伤的细胞模型[12-17],因此本研究以HepG2细胞为模型,探究了BMCs-CM对其增殖的影响,并用H2O2诱导成氧化损伤模型,检测了其细胞内外各指标的变化情况,并探讨了其可能的作用机制。
1 材料和方法
1.1 材料
雄性SD大鼠,体质量(90.6±10.1) g,由广东医科大学动物实验中心提供;肝癌细胞株HepG2由广东医科大学中药与新药研究所提供;CCK8试剂盒(日本同仁);0.25 %胰蛋白酶(含EDTA,吉诺生物公司);L-DMEM、H-DMEM培养基(美国GIBCO公司);胎牛血清(FBS,美国GIBCO公司);H2O2溶液(分析纯,Sigma);二甲基亚砜(DMSO,Solarbio公司);磷酸盐缓冲溶液(PBS,Solarbio公司);细胞裂解液(RIPA,碧云天);PMSF蛋白酶抑制剂(碧云天);BCA法蛋白定量试剂盒(碧云天);丙二醛(MDA)试剂盒、乳酸脱氢酶(LDH)试剂盒、超氧化物歧化酶(SOD)活性测定试剂盒(均来自南京建成生物工程研究所);一抗(兔抗鼠IgG,SantaCruz公司);二抗(荧光标记的山羊抗兔IgG,Santa Cruz公司);聚偏二氟乙烯膜(PVDF,美国Milipore公司);6×SDS-PAGE蛋白上样定量试剂盒(Thermo scientific公司);脱脂奶粉(MBCHEM公司)。
恒温水浴锅(金坛市杰尔瑞电器有限公司);细胞恒温培养箱(美国Thermo公司);-80 ℃超低温冰箱(美国Thermo公司);漩涡混匀器(北京六一仪器厂);imark 酶标仪(美国Bio-Rad公司);常温及低速离心机(德国Eppendorf公司);高速冷冻离心机(德国Eppendorf公司);AUW120D电子天平(日本Shimadzu公司);DYCP-24DN电泳仪(北京六一仪器厂);转膜仪、转膜槽(美国Bio-Rad公司);WB红外显影仪(美国Gene Company Linited 公司)。
1.2 方法
1.2.1 BMCs细胞的分离、培养 采用颈椎脱臼的方法处死SD大鼠,再用体积分数为75 %的乙醇浸泡约15 min。在无菌条件下对其胫骨和股骨进行处理,用 10 mL灭菌注射器吸取L-DMEM 培养液反复吹打骨髓腔,直至骨髓细胞充分流出,将其制成单细胞悬液,加入含有10%FBS的L-DMEM培养基,置于37 ℃、5%CO2细胞恒温培养箱中培养。原代培养2 d后首次换液以去除不贴壁细胞,之后每2天换液1次,待贴壁细胞融合度达80%~90%再用含EDTA胰酶消化,按1∶3比例进行传代培养。
1.2.2 MSCs 培养上清液的收集 选择第5~7代细胞,待细胞融合度达70%~80%后用PBS清洗,随之用H-DMEM培养基培养,在37 ℃、5%CO2条件下孵育12 h 后收集上清,3 000 r/min离心3 min,弃细胞碎片后标记所得培养液为MSCs-CM,-80 ℃保存。
1.2.3 HepG2细胞培养 将HepG2细胞按5×105个/mL接种于含10%FBS的H-DMEM培养基中,置于37 ℃、5% CO2条件下培养。每2天更换1次培养基,3 d后传代,常规胰蛋白酶消化传代,选取对数生长期的细胞做实验。
1.2.4 BMCs-CM对HepG2细胞增殖的影响 采用CCK8法检测BMCs-CM对HepG2细胞生存率的影响。将处于对数生长期的HepG2细胞按5 000个/孔加入96孔板,每孔体积为100 μL,培养24 h后弃上清。对照组加入含5%FBS的H-DMEM培养基100 μL,另外3个实验组在含5%FBS的H-DMEM培养基中加入不同体积分数的MSCs-CM(低、中、高体积分数分别为10%、20%、40%)。每组设1个空白孔和5个复孔,继续培养24、48、72 h后向各孔加入CCK8试剂10 μL,37 ℃、5%CO2烘箱孵育1 h后,采用酶标仪在450 nm处测OD值。取5个孔的均数,细胞存活率=[(As-Ab)/(Ac-Ab)]×100%,其中,As:实验孔,Ac:对照孔,Ab:空白孔。
1.2.5 CCK8检测BMCs-CM对HepG2细胞的保护将处于对数生长期的HepG2细胞按6 000个/孔加入96孔板,每孔体积为100 μL,37 ℃、5% CO2烘箱培养24 h。实验分为5组:对照组、H2O2损伤模型组(200 μmol/L H2O2)、MSCs-CM低含量处理组(10% MSCs-CM+200 μmol/L H2O2)、MSCs-CM中 含 量 处 理 组(20% MSCs-CM+200 μmol/L H2O2)、MSCs-CM高含量处理组(40% MSCs-CM+200 μmol/L H2O2),每组1个空白孔和5个复孔,继续培养24 h后向各孔加入CCK8试剂10 μL,37 ℃、5%CO2烘箱孵育1 h后,采用酶标仪在450 nm处测OD值。取5个孔的均数,细胞存活率=[(As-Ab)/(Ac-Ab)]×100%,其中,As:实验孔,Ac:对照孔,Ab:空白孔。
1.2.6 检测HepG2细胞上清液中LDH、MDA含量和SOD活力 收集1.2.5中分组处理后各组细胞上清液,分别参照3个测试盒说明书进行操作,随后用酶标仪在对应波长即在450、530、450 nm处测定OD值并根据相应公式计算LDH、MDA含量及SOD活力。
1.2.7 检测HepG2细胞内MDA含量及SOD活力 将HepG2细胞培养于6孔板,按照1.2.5进行分组:对照组、H2O2损伤模型组、BMCs-CM低、中和高含量处理组。处理后用细胞刮将细胞刮下,随后将细胞转移离心,超声破碎后制成悬液,漩涡混匀器混匀,4 000 r/min离心10 min后取上清液,参照MDA、SOD测试盒说明书进行操作,450 nm波长下测定OD值并根据相应公式计算MDA含量及SOD活力。
1.2.8 BMCs-CM对HepG2细胞Nrf-2蛋白表达的影响 用对照组、H2O2损伤模型组、BMCs-CM+H2O2组和BMGs-CM组分别处理HepG2细胞24 h后,去掉培养基并用冷PBS洗2次,置于冰上。按RIPA∶PMSF= 100∶1比例每孔加150 μL RIPA细胞裂解液及1.5 μL PMSF蛋白酶抑制剂,在冰上裂解20 min。用细胞刮刮细胞碎片和裂解液,每孔刮5 min,随后转移至1.5 mL EP管中,在1×104r/min、4 ℃离心30 min。取2.5 μL上清液用于BCA法测定蛋白体积分数,其余转移至1.5 mL EP管中并在-80 ℃保存。取各组50 μg蛋白样品于10% SDS-聚丙烯凝胶电泳进行分离(5%浓缩胶65 V,30 min;分离胶90 V,2 h)。将分离后的蛋白电转移(4 ℃,300 mA电流,120 min)至PVDF膜,脱脂奶粉封闭2 h,加入一抗4 ℃孵育过夜。PBST洗膜,加入荧光二抗室温孵育120 min,随之红外荧光显影仪显影,用Image J图像分析蛋白条带的灰度值。Nrf-2蛋白的表达量以β-actin作为内参。
1.3 统计学处理
应用SPSS18.0软件进行统计学处理,计量资料以±s表示,采用单因素方差分析和Newman-Keuls检验。以P<0.05为差异有统计学意义。
2 结果
2.1 BMCs-CM对HepG2细胞增殖的影响
CCK8检测结果显示:与对照组相比,HepG2细胞存活率随BMCs-CM作用时间的延长而明显增大,随BMCs-CM含量的增高而增大,差异有统计学意义(P<0.01)。其中在同一含量比较下,BMCs-CM各含量组72 h的细胞存活率均比48 h的低,差异有统计学意义(P<0.01),详见表1。
2.2 CCK8检测BMCs-CM对HepG2细胞的保护作用
表1 BMCs-CM对HepG2细胞存活率的影响 ±s,%)

表1 BMCs-CM对HepG2细胞存活率的影响 ±s,%)
同一时段,与对照组比较:a P<0.01;同一含量组,与24 h比较:b P<0.01,cP<0.01
images/BZ_15_205_1671_2272_1738.png对照组BMCs-CM低含量组BMCs-CM中含量组BMCs-CM高含量组6 6 6 6 100.00±0.02100.00±0.03100.00±0.02 105.60±2.80a 131.16±1.20ab 119.46±3.74ac 129.10±2.71a 150.62±3.14ab 134.78±3.25 ac 150.18±3.07 ac 145.07±2.40a 175.32±2.35ab
CCK8结果显示:H2O2损伤模型组中可知200 μmol/L H2O2对HepG2细胞杀伤性较大,其细胞存活率明显降低,差异有统计学意义(P<0.01)。BMCs-CM低、中、高含量组的细胞存活率明显比H2O2损伤模型组高,且呈现出含量依赖性,差异有统计学意义(P< 0.01),详见表2。
表2 BMCs-CM对H2O2诱导损伤后的HepG2细胞存活率的影响 ±s,%)

表2 BMCs-CM对H2O2诱导损伤后的HepG2细胞存活率的影响 ±s,%)
与对照组比较:aP<0.01;与H2O2损伤模型组比较:bP<0.01
images/BZ_15_225_2658_1154_2729.png对照组 100.00±0.02 H2O2损伤模型组52.26±3.02 BMCs-CM低含量组a 67.70±2.41 BMCs-CM中含量组ab 76.84±1.92 BMCs-CM高含量组6 6 6 6 6 ab 83.64±2.09ab
2.3 HepG2细胞上清液中LDH活性、MDA含量及SOD活力的测定
各检测试剂盒结果显示:与对照组比较,H2O2损伤模型组细胞上清液中LDH活性、MDA含量增加,SOD的活力降低,差异有统计学意义(P<0.01)。与H2O2损伤模型组比较,BMCs-CM低、中、高含量组可降低损伤后的HepG2细胞培养液中LDH活性和MDA含量的增高,差异有统计学意义(P<0.01);同时能有效地改善HepG2细胞培养液中SOD的活力水平(P<0.01);此外,LDH活性、MDA含量随BMCs-CM含量的升高而显著降低,SOD活力则显著升高,差异有统计学意义(P<0.01),详见表3。
2.4 HepG2细胞内MDA含量及SOD活力的测定
各检测试剂盒结果显示:与对照组相比,H2O2损伤模型组的HepG2细胞内MDA含量增大,而SOD活力降低,差异有统计学意义(P<0.01)。与H2O2损伤模型组相比,BMCs-CM各含量组均可使HepG2细胞内MDA含量降低,使SOD活性增高。而随着BMCs-CM含量的增大,MDA含量显著降低,SOD活性显著升高,差异有统计学意义(P<0.01),详见表4。
表3 BMCs-CM对H2O2诱导HepG2氧化损伤后细胞上清液中LDH、MDA及SOD的影响 ±s)

表3 BMCs-CM对H2O2诱导HepG2氧化损伤后细胞上清液中LDH、MDA及SOD的影响 ±s)
与对照组比较:a P<0.01;与H2O2损伤模型组比较: bP<0.01
images/BZ_16_208_443_2275_509.png对照组H2O2损伤模型组BMCs-CM低含量组BMCs-CM中含量组BMCs-CM高含量组6 6 6 6 6 208.64±40.760.19±0.0446.53±0.18 1257.36±71.65a 0.78±0.03a 25.08±0.33a 1046.70±52.61ab 0.67±0.01ab 28.73±0.64ab 772.51±42.75ab 0.42±0.04ab 41.85±0.34ab 659.29±46.53ab 0.35±0.03ab 45.52±0.22ab
表4 BMCs-CM对H2O2诱导HepG2细胞内MDA含量及SOD活力的影响 ±s)
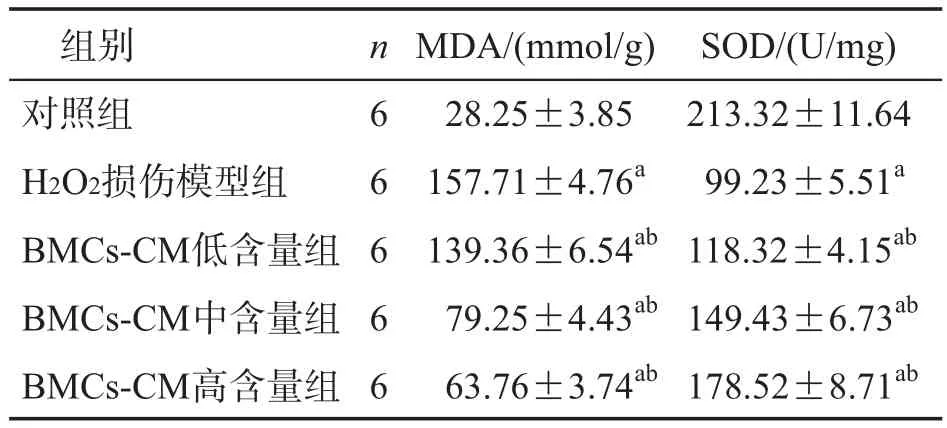
表4 BMCs-CM对H2O2诱导HepG2细胞内MDA含量及SOD活力的影响 ±s)
与对照组比较:aP<0.01;与H2O2损伤模型组比较:bP<0.01
images/BZ_16_220_1161_1149_1232.png对照组H2O2损伤模型组BMCs-CM低含量组BMCs-CM中含量组BMCs-CM高含量组6 6 6 6 6 28.25±3.85213.32±11.64 157.71±4.76a 99.23±5.51a 139.36±6.54ab 118.32±4.15ab 79.25±4.43ab 149.43±6.73ab 63.76±3.74ab 178.52±8.71ab
2.5 BMCs-CM对HepG2细胞Nrf-2核蛋白表达水平的影响
Western blot结果显示:与对照组相比,BMCs-CM组Nrf-2核蛋白表达明显增加(P<0.01),H2O2损伤模型组中Nrf-2核蛋白表达明显下降,差异有统计学意义(P<0.01);与H2O2损伤模型组相比,BMCs-CM+H2O2组对HepG2细胞核中Nrf-2蛋白的表达具有明显的上调作用,差异有统计学意义(P<0.01);BMCs-CM组Nrf-2核蛋白也明显比BMCs-CM+H2O2组的表达高,差异有统计学意义(P<0.01),详见图1、表5。

图1 BMCs-CM对HepG2细胞的Nrf-2核转运的影响
3 讨论
表5 BMCs-CM对HepG2细胞的Nrf-2核转运的灰度值的影响 ±s)

表5 BMCs-CM对HepG2细胞的Nrf-2核转运的灰度值的影响 ±s)
与对照组比较:aP<0.01;与H2O2损伤模型组比较:b P<0.01;与BMCs-CM+H2O2组比较:cP<0.01
images/BZ_16_1321_1071_2250_1137.png对照组H2O2损伤模型组BMCs-CM+H2O2组BMCs-CM组6 6 6 6 1.058±0.045 0.463±0.032a 1.275±0.054ab 2.234±0.106abc
氧化应激反应与神经退行性疾病有着错综复杂的关系。神经元对氧化应激反应有高度的敏感性,越来越多的研究证据表明氧化应激与神经退行性疾病的病因与发病机制关系密切,氧化应激可以导致神经细胞损伤或死亡[18]。显然,通过抗氧化治疗以保护神经细胞显得尤为重要[19]。H2O2是一种重要的活性氧,虽然本身不具备自由基的性质,但其极易透过细胞膜进入细胞,与细胞内铁离子发生Fenton反应形成高活性的自由基,导致脂质过氧化等一系列反应,因其易于获得且性质相对稳定的特点,所以它是研究各类细胞氧化损伤的常用物质之一。HepG2细胞来源于人类肝癌细胞,并且保留了人类正常肝细胞的许多特殊功能[20],如保留了抗氧化酶的活性。有文献报道,BMCs发挥修复损伤作用的主要机制可能是它的旁分泌作用[21],这说明BMCs-CM是一种很有研究价值的条件培养液。但BMCs-CM对HepG2细胞氧化损伤的保护作用鲜有报道,所以在HepG2细胞中,BMCs-CM是否能够对H2O2诱导的氧化损伤具有保护作用还需实验验证。 本实验通过H2O2为氧化剂诱导HepG2细胞建立的氧化损伤模型进行研究,CCK8检测结果表明, BMCs-CM单一作用对HepG2细胞无毒性;当不同含量BMCs-CM+H2O2作用于HepG2细胞时,BMCs-CM能够提高该细胞氧化损伤后的存活率,提示BMCs-CM对H2O2诱导HepG2细胞氧化损伤具有保护作用。
H2O2氧化损伤HpG2细胞时,细胞膜通透性增强,而LDH是一种存在于机体所有组织细胞胞质内的糖降解酶,在氧化损伤状态下,LDH会从胞内释放到胞外,该酶活力明显上升,因此胞外LDH的活性能反映细胞的损伤程度。SOD是一种能使超氧化物阴离子自身发生氧化还原反应的内源性金属酶,能清除超氧阴离子自由基保护细胞免受损伤,因此SOD活力的高低间接反应了机体清除氧自由基的能力。MDA 是脂质过氧化反应后的氧化终产物之一,MDA使得细胞膜结构和功能受到损伤,影响一系列生理生化反应的正常进行,具有细胞毒性,因此MDA的含量常常可反映机体内脂质过氧化的程度,也间接反映了细胞损伤的程度[22]。即当机体发生氧化损伤时,细胞膜通透性改变,胞内LDH 向外释放;引发自由基链反应消耗大量SOD;引发脂质过氧化反应产生许多MDA,致使细胞损伤、死亡[23]。因此,在H2O2诱导HepG2细胞发生氧化损伤的状态下,细胞存活率、LDH释放量、MDA生成量、SOD活力发生会明显的变化。本实验结果表明,BMCs-CM可降低该氧化损伤细胞上清液中LDH 的释放量、降低MDA的水平,增强SOD的活力。由此可见,BMCs-CM对H2O2诱导HepG2细胞氧化损伤的保护作用与提高细胞抗氧化酶活性、降低自由基水平有关,同时猜测其可能与其分泌的细胞因子有关。
研究发现,核转录因子Nrf-2是氧化应激和外源性有毒物质的感受器,以Keap1-Nrf 2-ARE信号通路介导抗氧化基因和II相解毒酶的转录,降低ROS引起的细胞损伤程度,抵抗机体体内氧化-抗氧化的失衡,而且Nrf-2在神经退行性疾病中也发挥着重要的作用[24-26]。正常生理状态下,胞浆中Nrf-2与Keapl结合形成复合体失去活性,而在氧化应激状态下,Keapl构型发生改变可导致Nrf-2与Keapl解离,Nrf-2释放出来后转位进入核内,从而启动下游基因的转录及其蛋白的表达以减轻氧化应激引起的损伤。本文通过Western blot实验探讨HepG2氧化损伤细胞模型中Nrf-2蛋白的表达,结果显示,BMCs-CM组明显增加Nrf-2蛋白的表达水平。说明经BMCs-CM组处理可能导致HepG2细胞胞质中的Nrf-2从复合体中解离释放出来,并转位进入细胞核内,从而发挥抗氧化作用。也揭示了BMCs-CM可能是基于对Keap1-Nrf 2-ARE信号通路的调节来发挥对H2O2诱导HepG2细胞氧化损伤的保护作用机制。
综上所述,BMCs-CM对HepG2氧化损伤细胞具有保护作用,其机制可能与BMCs-CM降低LDH、MDA含量,增强SOD活力并调控Keap1-Nrf 2-ARE信号通路中的关键蛋白Nrf-2的表达水平有关。这证实了BMCs-CM作为抗氧化剂实现对HepG2细胞氧化损伤保护作用的可行性,也为神经系统退行性疾病在抗氧化治疗方面提供了实验基础。
