导盲犬和淘汰犬肠道菌群的差异性研究*
2019-07-11董建一胡雨奇张利龙龙尚琴李鹏飞王靖宇
董建一 许 尧 胡雨奇 张利龙龙尚琴 李鹏飞 王靖宇 李 明
(1.大连医科大学实验动物中心,大连 116044)(2. 大连医科大学第二临床学院,大连 116044)(3.大连医科大学基础医学院微生态学教研室,大连 116044)
导盲犬是辅助视障人士出行的工作犬。我国导盲犬事业与欧美国家相比起步较晚[1],导盲犬培训成功率低、成本高、周期长是各国导盲犬培训机构都面临的问题[2]。导盲犬培训共分为寄养期、培训期、服役期三个阶段,其中寄养期和培训期是导盲犬的早期筛选阶段[3],筛选的主要方式是通过动物行为学测试对犬的行为反应和认知功能进行评判[4]。但是,此评估方法具有一定的主观性、局限性和未知性[1,3],所以采用客观评估数据辅助犬的早期筛选具有重要意义。肠道菌群是许多哺乳动物重要的“微生态器官”,可通过多种途径影响哺乳动物的行为、情绪和认知功能[5-6]。本研究通过PCR-DGGE技术分析导盲犬和淘汰犬之间的差异性肠道菌群,进而在动物行为学测试基础上为导盲犬的早期筛选提供一种新的辅助手段。
1 材料与方法
1.1 材料
1.1.1实验动物:选择身体健康、无消化道疾病及其他疾病的导盲犬16只和淘汰犬10只,动物均由中国导盲犬大连培训基地提供,所有导盲犬经中国导盲犬大连培训基地行为学测试并通过,符合《导盲犬》国家标准(GB/T 36186—2018),所有淘汰犬经测试后均不通过,不符合《导盲犬》国家标准。
1.1.2主要试剂:DNA提取:E.Z.N.A.©Stool DNA kit购于美国Omega公司;PCR体系:2×Easytaq PCR SuperMix(+dye)、引物338F和518R等购于宝生物工程(大连)有限公司;DGGE体系:尿素、丙烯酰胺、N,N′-亚甲基双丙烯酰胺、过硫酸铵、四甲基乙二胺、去离子甲酰胺等均为国产分析纯。
1.1.3实验分组:随机抽取部分导盲犬(GD,9只)和淘汰犬(ED,4只)分为两组,并且将全部导盲犬和淘汰犬按照犬的品种和性别进一步分为拉布拉多雄性导盲犬(GD-ML,7只)和拉布拉多雄性淘汰犬(ED-ML,6只),拉布拉多雌性导盲犬(GD-FL,6只)和拉布拉多雌性淘汰犬(ED-FL,2只),金毛雄性导盲犬(GD-MG,3只)和金毛雄性淘汰犬(ED-MG,2只)。导盲犬和淘汰犬之间进行对比分析,相同品种和性别的导盲犬和淘汰犬之间进行对比分析,共分为4组相互平行的配对。
1.2 方法
1.2.1样本收集和DNA提取:收集粪便样本前一个月内,导盲犬和淘汰犬均统一饲食,犬饲食由中国导盲犬大连培训基地提供。分别收集各组犬新鲜粪便5~10 g,取样后加入粪便DNA保护剂,-80 ℃保存。对各组犬粪便样本进行DNA提取,DNA提取方法按照E.Z.N.A.©Stool DNA kit试剂盒说明书进行。
1.2.2PCR扩增:PCR扩增肠道菌群多样性变化采用16S rDNA基因V3区特异性序列作为靶标进行PCR-DGGE分析。引物序列为:上游引物(338F)和下游引物(518R)。反应体系总体积为50 μL:内含25 μL 2×Easytaq PCR SuperMix(+dye),1 μL 518R (10 pmol/μL),1 μL 338F (10 pmol/μL),3 μL DNA模板,20 μL dddH2O。反应条件为:93 ℃预热,93 ℃变性5 min,93 ℃ 30 s、54.5 ℃ 30 s、72 ℃ 30 s进行30次循环,72 ℃延伸5 min,4℃ 10 min。反应完成后通过1%琼脂糖凝胶电泳检测PCR产物并保存于-20 ℃备用。
1.2.3变性梯度凝胶电泳(DGGE):(1)配胶:使用8%聚丙烯酰胺凝胶,25%~55%平行变性梯度。25%变性梯度凝胶由0.4 mL 50×TAE buffer,2 mL去离子甲酰胺,4 mL 40%丙烯酰胺,2.1 g尿素,11.5 mL ddH2O制成;55%变性梯度凝胶由0.4 mL 50×TAE buffer,4.4 mL去离子甲酰胺,4 mL 40%丙烯酰胺,4.62 g尿素,6.55 mL ddH2O制成。(2)灌胶:灌胶前分别向25%低梯度胶和55%高梯度胶中加入80 μL过硫酸铵,混合均匀,再分别加入18 μL四甲基乙二胺,迅速混合,将高、低梯度胶平行匀速推入预先装好的玻璃架中,室温凝固。(3)点样:微量进液器点样。(4)电泳:于60 ℃恒温条件下,200 V电压下,电泳10 min。150 V电压下,电泳约4 h。(5)染色:溴化乙锭染色8 min,去离子水漂洗。(6)凝胶成像分析:凝胶成像仪成像,image lab软件进行数字化处理,并进行分析,切胶后进行回收纯化,再送至大连赛拓生物科技有限公司测序,利用NCBI数据库对测序结果进行对比分析。
1.3 统计方法

2 结果
2.1 导盲犬(GD)和淘汰犬(ED)肠道菌群差异
GD和ED粪便菌群PCR-DGGE图谱如图1-1所示,同一泳道不同条带代表不同的肠道菌群,条带灰度体现了肠道菌群的相对含量。相似性聚类分析结果如图1-2所示,1~4泳道相似度较高,归为一类,5~13泳道相似度较高,归为一类,表明GD和ED肠道菌群存在差异。肠道菌群多样性、丰富度和均匀度分析结果如表1所示,GD与ED的多样性指数、丰富度指数和均匀度指数分别为2.786±0.189和2.641±0.445、17.800±2.859和16.500±6.021、0.9720±0.0114和0.9738±0.0044,且与ED相比,GD多样性指数(t=0.7579,P=0.4644)、丰富度指数(t=0.4770,P=0.6427)和均匀度指数(t=0.2868,P=0.7796)差异均无统计学意义。如图1所示,GD中差异性条带1所代表的菌株相对含量高于ED,条带测序结果(表2)显示该菌株为MegamonasfuniformisYIT 11815,则表明与ED相比,GDMegamonasfuniformisYIT 11815菌株增多。

图1 GD和ED肠道菌群DGGE图谱分析和相似性聚类分析注:同一泳道不同条带代表不同的肠道菌群,条带灰度体现了肠道菌群的相对含量,红色箭头为差异性测序条带Fig.1 DGGE analysis and similarity cluster analysis of gut microbiota between GD and EDNote: Different bands in the same lane represent different gut microbiota, the gray scale of the bands reflects the relativecontent of the gut microbiota, and the red arrow represents the differential sequencing band
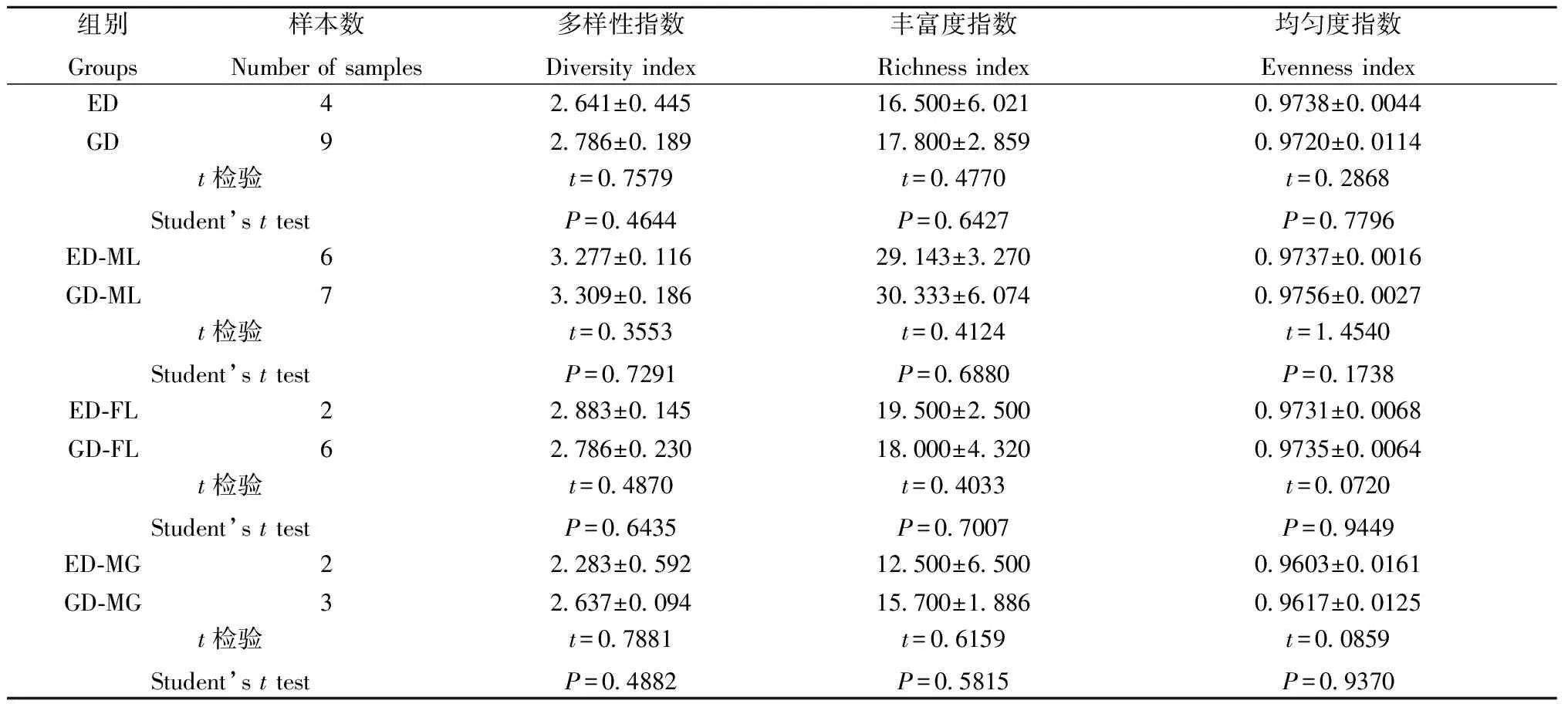
组别Groups样本数Number of samples多样性指数Diversity index丰富度指数Richness index均匀度指数Evenness indexED 42.641±0.44516.500±6.0210.9738±0.0044GD 92.786±0.18917.800±2.8590.9720±0.0114t检验Student’s t testt=0.7579P=0.4644t=0.4770P=0.6427t=0.2868P=0.7796ED-ML 63.277±0.11629.143±3.2700.9737±0.0016GD-ML 73.309±0.18630.333±6.0740.9756±0.0027t检验Student’s t testt=0.3553P=0.7291t=0.4124P=0.6880t=1.4540P=0.1738ED-FL 22.883±0.14519.500±2.5000.9731±0.0068GD-FL 62.786±0.23018.000±4.3200.9735±0.0064t检验Student’s t testt=0.4870P=0.6435t=0.4033P=0.7007t=0.0720P=0.9449ED-MG 22.283±0.59212.500±6.5000.9603±0.0161GD-MG 32.637±0.09415.700±1.8860.9617±0.0125t检验Student’s t testt=0.7881P=0.4882t=0.6159P=0.5815t=0.0859P=0.9370
2.2 相同品种及性别的导盲犬和淘汰犬肠道菌群差异
2.2.1拉布拉多雄性导盲犬(GD-ML)和淘汰犬(ED-ML)肠道菌群差异分析:GD-ML和ED-ML粪便菌群PCR-DGGE图谱如图2-1所示。相似性聚类分析结果如图2-2所示,1和10泳道相似度较高,11和12泳道相似度较高,均单独归为一类;2-6泳道相似度较高,归为一类;7~9、13泳道相似度较高,归为一类,表明GD-ML和ED-ML肠道菌群存在差异。肠道菌群多样性、丰富度和均匀度分析结果如表1所示,GD-ML与ED-ML的多样性指数、丰富度指数和均匀度指数分别为3.309±0.186和3.277±0.116、30.333±6.074和29.143±3.270、0.9756±0.0027和0.9737±0.0016,且与ED-ML相比,GD-ML多样性指数(t=0.3553,P=0.7291)、丰富度指数(t=0.4124,P=0.6880)和均匀度指数(t=1.4540,P=0.1738)差异均无统计学意义。如图2-1所示,GD-ML中差异性条带1、2、3和6所代表的肠道菌株相对含量高于ED-ML,差异性条带4和5所代表的肠道菌株相对含量低于ED-ML,条带测序结果(表2)显示条带1~6分别为SuccinatimonashippeiYIT 12066、LactobacillusacidophilusNCFM、LactobacillusvaginalisDSM 5837、PrevotellacopriDSM 18205、CollinsellaaerofaciensATCC 25986、FaecalibacteriumprausnitziiA2-165菌株,则表明相比于ED-ML,GD-MLSuccinatimonashippeiYIT 12066、LactobacillusvaginalisDSM 5837、LactobacillusacidophilusNCFM和FaecalibacteriumprausnitziiA2-165菌株增多,CollinsellaaerofaciensATCC 25986和PrevotellacopriDSM 18205菌株减少。

图2 GD-ML和ED-ML肠道菌群DGGE图谱分析和相似性聚类分析Fig.2 DGGE analysis and similarity cluster analysis of gut microbiota between GD-ML and ED-ML

组别Groups条带编号Strip number同源菌株名称Name of homologous strains同源性Identity门类PhylumGD and ED1Megamonas funiformis YIT 1181593%FirmicutesGD-ML and ED-ML1Succinatimonas hippei YIT 1206694%Proteobacteria2Lactobacillus acidophilus NCFM99%Firmicutes3Lactobacillus vaginalis DSM 5837100%Firmicutes4Prevotella copri DSM 1820598%Bacteroidetes5Collinsella aerofaciens ATCC 25986100%Actinobacteria6Faecalibacterium prausnitzii A2-16599%FirmicutesGD-FL and ED-FLaRuminococcus gnavus AGR215492%FirmicutesbFusobacterium russii ATCC 2553390%FusobacteriaGD-MG and ED-MGATropheryma whipplei str. Twist94%Actinobacteria
2.2.2拉布拉多雌性导盲犬(GD-FL)和淘汰犬(ED-FL)、金毛雄性导盲犬(GD-MG)和淘汰犬(ED-MG)肠道菌群差异分析:GD-FL和ED-FL、GD-MG和ED-MG粪便菌群PCR-DGGE图谱如图3-1所示。相似性聚类分析结果如图3-2所示,12、13泳道各单独归为一类;1~6泳道相似度较高,归为一类,7~8泳道归为一类;9~11泳道归为一类,结果表明GD-FL和ED-FL、GD-MG和ED-MG肠道菌群存在差异。肠道菌群多样性、丰富度和均匀度分析结果如表1所示,GD-FL和ED-FL的多样性指数、丰富度指数和均匀度指数分别为2.786±0.230和2.883±0.145、 18.000±4.320和19.500±2.500、0.9735±0.0064和0.9731±0.0068,且与ED-FL相比,GD-FL多样性指数(t=0.4870,P=0.6435)、丰富度指数(t=0.4033,P=0.7007)和均匀度指数(t=0.0720,P=0.9449)差异均无统计学意义。GD-MG和ED-MG的多样性指数、丰富度指数和均匀度指数分别为2.637±0.094和2.283±0.592、15.700±1.886和12.500±6.500、0.9617±0.0125和0.9603±0.0161,且与ED-MG相比,GD-MG多样性指数(t=0.7881,P=0.4882)、丰富度指数(t=0.6159,P=0.5815)和均匀度指数(t=0.0859,P=0.9370)差异均无统计学意义。如图3-1所示,GD-FL中差异性条带a和b所代表的肠道菌株相对含量低于ED-FL,GD-MG中差异性条带A所代表的肠道菌株相对含量高于ED-MG,条带测序结果(表2)显示条带a、b和A分别为RuminococcusgnavusAGR2154、FusobacteriumrussiiATCC 25533和Tropherymawhippleistr. Twist菌株,则表明与ED-FL相比,GD-FLRuminococcusgnavusAGR2154、FusobacteriumrussiiATCC 25533菌株减少;与ED-MG相比,GD-MGTropherymawhippleistr. Twist菌株增加。

图3 GD-FL和ED-FL、GD-MG和ED-MG肠道菌群DGGE图谱分析和相似性聚类分析Fig.3 DGGE analysis and similarity cluster analysis of gut microbiota between GD-FL and ED-FL, GD-MG and ED-MG
3 讨论
3.1 结果分析
已有研究发现肠道菌群与哺乳动物的行为、情绪和认知功能密切相关,可直接调控其中枢神经系统功能,例如,大肠杆菌(Escherichiacoli)可损害小鼠的学习能力并导致记忆障碍,而约氏乳杆菌(Lactobacillusjohnsonii)可减轻2,4,6-三硝基苯磺酸处理小鼠的结肠炎和记忆障碍症状[7];Crumeyrolle-Arias等研究发现无菌大鼠相比于SPF(Specific pathogen Free)大鼠具有更多焦虑样行为[8]。因此,导盲犬的肠道菌群可能与犬的行为和情绪等气质特征密切相关,有利于辅助导盲犬的早期筛选。
本研究应用PCR-DGGE技术分别分析GD和ED以及相同品种和性别导盲犬和淘汰犬肠道菌群差异。相似性聚类分析结果显示,GD和ED各分为一类(图1-2);GD-ML和ED-ML各分为一类(图2-2),1和10泳道相似度较高,单独归为一类,但是两者为不同组别,可能是由于个体差异造成的影响;GD-FL、ED-FL和GD-MG各归为一类(图3-2),12、13泳道各单独归为一类,可能存在个体差异,7~8和9~11泳道归为同一大类,但两组为不同犬种,可能是由于犬品种及性别的不同所造成的影响。肠道菌群多样性、丰富度和均匀度分析结果显示,每两个配对组之间多样性指数、丰富度指数和均匀度指数差异均无统计学意义。差异性条带测序分析结果显示,与ED相比,GD中Firmicutes门的MegamonasfuniformisYIT 11815菌株增多;与ED-ML相比,GD-ML中Proteobacteria门的SuccinatimonashippeiYIT 12066、Firmicutes门的LactobacillusacidophilusNCFM、LactobacillusvaginalisDSM 5837和FaecalibacteriumprausnitziiA2-165菌株增多,Actinobacteria门的CollinsellaaerofaciensATCC 25986、Bacteroidetes门的PrevotellacopriDSM 18205菌株减少;与ED-FL相比,GD-FL中Firmicutes门的RuminococcusgnavusAGR2154、Fusobacteria门的FusobacteriumrussiiATCC 25533菌株减少;与ED-MG相比,GD-MG中Actinobacteria门的Tropherymawhippleistr. Twist菌株增多。
3.2 展望与意义
3.2.1肠道菌群调节犬行为、情绪和认知功能的可能途径:肠道菌群可通过多种途径影响哺乳动物的行为、情绪和认知功能,脑-肠轴是其中重要的作用途径之一。脑-肠轴是大脑和胃肠道之间紧密连接的双向通路,在调节机体行为反应、认知功能等方面起到了重要作用[6]。研究发现肠道菌群可调节5-羟色胺(5-HT)[9]、多巴胺(DA)[10-11]、γ-氨基丁酸(GABA)[12]等多种神经递质的合成和代谢活动,从而参与调控和影响宿主的行为和功能;免疫途径[13]、短链脂肪酸(SCFAs)代谢途径[14]等也可能是肠道菌群参与调节的作用途径。
已有研究从神经递质途径、免疫途径、SCFAs代谢途径等脑-肠轴的角度阐述了本导盲犬和淘汰犬之间部分差异菌株的功能和作用。自闭症谱系障碍(Autism spectrum disorder,ASD)是一种以社交和认知功能缺陷为特征的神经疾病,目前认为肠道菌群与脑-肠轴的相互作用是ASD发生发展的一个重要因素[15],已有研究发现相比于正常儿童,ASD儿童粪便中Prevotellacopri和Feacalibacteriumprausnitzii菌属相对丰度减少,且ASD儿童粪便中GABA浓度较低[16]。有趣的是,本实验结果表明相比于ED-ML,GD-ML中Prevotellacopri菌属丰度减少而Feacalibacteriumprausnitzii菌属丰度增多,因此这两种菌属是否可能通过脑-肠轴神经递质途径影响犬的行为、情绪和认知功能有待于进一步研究。LactobacillusacidophilusNCFM菌株是一种益生菌,研究表明该菌可刺激肠上皮细胞系中细胞因子和趋化因子的产生[17];FaecalibacteriumprausnitziiA2-165菌株对人类和小鼠树突状细胞产生IL-10具有较强的诱导能力,并能够调节T细胞反应[18];另有研究发现Ruminococcusgnavus菌属同样具有对多种免疫因子的调节作用[19-20],本研究结果表明相比于ED-ML,GD-ML中LactobacillusacidophilusNCFM、FaecalibacteriumprausnitziiA2-165菌株丰度增多,与ED-FL相比,GD-FL中RuminococcusgnavusAGR2154菌株减少,因此这些差异菌株可能通过脑-肠轴免疫途径产生调节作用。广泛性焦虑症(generalized anxiety disorder,GAD)与GABA、5-HT和去甲肾上腺素(NE)等多种神经递质失调有关[21],研究发现GAD患者肠道菌群丰富度和多样性显著降低,而Ruminococcusgnavus等产SCFAs细菌过度增多,经抗抑郁药物治疗后GAD患者症状有所改善,但肠道菌群失调并未好转或恢复[22],本研究结果表明与ED-FL相比,GD-FL中RuminococcusgnavusAGR2154菌株丰度减少,则该菌也可能通过SCFAs代谢途径影响犬的情绪和认知功能。除此之外,与ED相比,GD中MegamonasfuniformisYIT 11815菌株增多,与ED-ML相比,GD-ML中SuccinatimonashippeiYIT 12066和LactobacillusvaginalisDSM 5837菌株增多,CollinsellaaerofaciensATCC 25986菌株减少;与ED-FL相比,GD-FL中FusobacteriumrussiiATCC 25533菌株减少;与ED-MG相比,GD-MG中Actinobacteria门的Tropherymawhippleistr. Twist菌株增多,目前还没有相应的研究阐明上述差异菌群在脑-肠轴方面的功能和作用。肠道菌群与脑-肠轴存在广泛而深刻的联系,因此,研究导盲犬的特征性优势菌群与神经递质和其他代谢产物之间的联系有助于探索肠道菌群的可能作用机制。
3.2.2肠道菌群调节幼犬的气质类型:广泛的实验研究和临床实践证明益生菌和益生元治疗在改善哺乳动物焦虑、抑郁等异常行为和情绪方面具有明显的积极作用[23-24],例如,Gareau等发现服用乳酸菌能够明显改善由母子分离刺激导致的大鼠应激反应[25]。因此,益生菌和益生元用于幼犬的早期发育阶段可能改善其肠道菌群结构和组成,促使幼犬的气质类型朝向有利于导盲犬筛选的预期方向发展。
3.3 不足之处
本研究首次就导盲犬和淘汰犬肠道菌群的差异进行分析和研究,但仍存在以下几点不足之处:①目前尚未阐明两者差异菌群的具体功能以及作用机制和途径,仍有待于后续实验的进一步研究;②由于部分组别犬数量有限,实验结果无疑会受到个体差异的影响;③本实验中应用的PCR-DGGE技术只能作定性分析,存在一定的主观性和局限性,而肠道菌群的高通量测序技术是目前用于肠道微生物研究最前沿、最常见的检测技术[26],利用高通量测序技术有助于发现丰度较低的微生物或未知微生物,可全面、准确地获取肠道菌群的定量化信息[27];④肠源细菌物质可能是调节脑-肠轴的关键,以代谢组学结合高通量测序技术探索可能机制是更好的选择。
综上所述,本研究发现导盲犬和淘汰犬肠道菌群存在差异,有文献表明两者特征性的差异菌群可通过脑-肠轴影响宿主的行为、情绪和认知功能。但限于当前研究水平,本研究尚未对两者差异菌群的功能及作用途径展开深入研究。值得肯定的是,对肠道菌群的深入分析可能会成为导盲犬早期筛选的有效补充手段,有助于缩短培训周期,节约培训成本。
