右美托咪定通过抑制NLRP3炎性体激活减轻高氧诱导的急性肺损伤
2019-07-11喻红彪任思宏
李 刚 喻红彪 任思宏
(南充市中心医院麻醉科,南充 637000)
高浓度的氧对严重的呼吸衰竭有良好的治疗作用,一般在重症监护室应用较多[1]。但是长时间地吸入高浓度的氧气却会造成肺损伤[2]。高氧造成的肺损伤的原因主要是线粒体产生的活性氧,活性氧可活化炎症细胞,以及释放炎性介质,引起肺组织结构的重建与上皮细胞死亡,是急性肺损伤的原因[3]。右美托咪定是一种高选择性的肾上腺素受体激动剂[1-2],近年来在临床上的使用已经越来越广泛。右美托咪定对血流动力学影响轻微[3],已被广泛应用于外科手术。右美托咪定可以通过抑制凋亡和抗炎作用从而保护机体的大脑,肝脏,肠胃,心脏以及肺部组织[4]。炎症小体是调节先天性免疫的多蛋白复合物[4],中枢神经系统中存在大量与脑损伤有关的炎症小体[5]。目前国内外在众多的炎症小体的研究中,NLRP3是研究的热点[6]。炎症小体和肺损伤机制关联研究则相对较少。本研究探究右美托咪定对炎症小体NLPR3抑制作用以及肺损伤的恢复机制,为右美托咪定预防及治疗肺损伤方面提供数据支持。
1 材料与方法
1.1 实验动物
选取成年雄性SD大鼠30只,体质量为(285.67±8.3)g,购自中科院上海实验动物中心(实验动物合格证:SCXK沪2002-0010);盐酸右美托咪定购自江苏恩华药业(批号:20131768);兔源抗β-actin单克隆抗体来自碧云天公司;兔抗鼠Cav-1和NLRP3抗体均来自美国CST公司;基因的相关引物设计来自天津赛默飞公司。
1.2 方法
1.2.1实验动物分组及造模:将大鼠编号,随机分为空白对照、模型组及右美托咪定组,各组10只。各组大鼠新环境适应期3 d,空白对照组呼吸正常室内空气,模型高氧组大鼠放置于密闭氧气环境内,舱内连接有输氧管和测氧仪,实验组高氧浓度为100%,高氧呼吸时间为1周,期间不断检测氧气浓度。右美托咪定组大鼠在高氧舱内期间,尾静脉单次注射右美托咪定溶液,剂量为0.6 μg/kg体质量,注射时间30 s。各组大鼠摄食饮水正常,饲养温度23~25 ℃。
1.2.2生化指标检测
1.2.2.1 大鼠呼吸频率检测:应用成都仪器厂生产的DHX-150动物呼吸机来监测大鼠呼吸频率,将各组SD大鼠麻醉以后,套上呼吸机,潮气量:4 mL/100 g,呼吸比:1∶1参数下检测大鼠呼吸次数,记录对比。
1.2.2.2 大鼠血清中IL-6、iNOS等含量检测:完成呼吸频率监测后1 h取大鼠尾静脉外周血5 mL。应用酶联免疫ELISA法监测血清中的可溶性IL-6、iNOS等含量,将抗凝剂加入到提前准备好的洁净试管中以后,于1 000 r/min离心,20 min,4℃条件下收取血清,在超低温下冷冻保存。解冻以后使用试剂盒测定其浓度。绘制标准曲线,测定值代入标准曲线,计算各组的血清中IL-6、iNOS浓度。
1.2.2.3 大鼠肺组织干湿重比例测定:SD大鼠在高氧仓饲养1周后,麻醉处死大鼠,取其肺部组织,精准称量右肺组织湿重,称量之后立即放入到100 ℃的烘箱中,鼓风干燥48 h后称量质量,所称得为组织干重。肺组织含水量=(湿重-干重)/湿重×100%。
1.2.2.4 大鼠基因引物设计:IL-2,TNFα以及β-actin引物设计见表1。
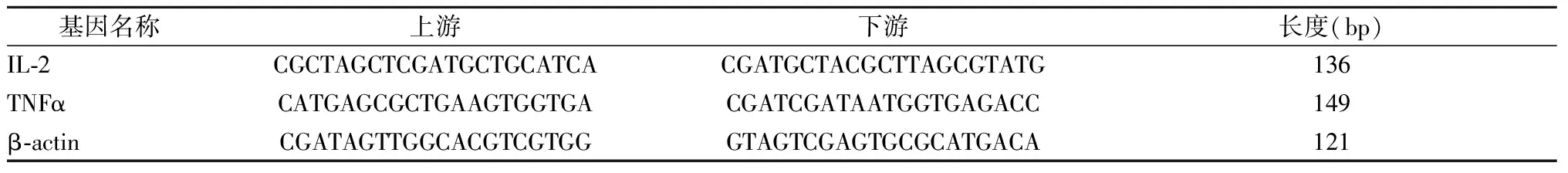
表1 RT-PCR过程中引物序列(n=16)Table 1 Primer sequences in RT-PCR (n=16)
1.2.2.5 RT-PCR法测定SD大鼠血清中VEGF和bFGF表达量:使用软件设计小鼠β-actin,TNF-α和IL-2上下游引物序列,选取长度小于150 bp的片段。RNA的提取:将各组60 mg的肺部组织置入离心管以后,加入Trizol试剂,研磨后离心取上清,后加入氯仿继续离心取上清,加入异丙醇,吸取上清取沉淀,后用DEPC水溶解,于PCR扩增仪中扩增。上样:将50×的TAE 稀释为1× TAE 溶液作为溶剂,称取0.52 g 琼脂糖,加入到1×TAE溶液当中,之后微波炉加热煮沸,后加入 4 μL的核酸染料,摇晃混匀。最后将琼脂糖凝胶水平放入电泳槽,依次加入 6 μL的 DNA Marker 以及目的基因 PCR 扩增产物。
1.2.2.6 Western Blot法测定大鼠IL-2、TNFα、NLPR3和Cav-1蛋白含量:取各组大鼠左肺组织60 mg,剪碎后置到离心管中,加RIPA裂解液和PMSF研磨1 min,后离心15 min取上清。用考马斯法检测各管吸光值,将各组蛋白调至同样浓度后进行蛋白上样。把NC膜放入到平皿后在容器中添加脱脂奶粉并在摇床上暗处封闭0.5~1.5 h。弃去奶粉后取出NC膜置于TBST中冲洗3次以后加入兔抗鼠Cav-1,β-actin和NLRP3抗体,4 ℃下孵育过夜。第2天取出NC膜,于TBST溶液中洗涤4次后加入2抗孵育,发光液a液和b液按1∶1 的比例现用现配,由左至右缓慢滴加到膜上,转移到暗室进行胶片冲洗。
1.3 统计方法

2 结果
2.1 大鼠肺组织干湿重比和呼吸频率
造模前,各组大鼠呼吸频率比较,差异无统计学意义(P>0.05);造模后,与对照组比较,模型组和右美托咪定组大鼠呼吸频率显著降低;与模型组比较,右美托咪定组大鼠呼吸频率显著降低,差异均有统计学意义(P<0.05)。与对照组比较,模型组肺组织干湿重比例显著升高;与模型组比较,右美托咪定组肺组织干湿重比例显著降低,差异均有统计学意义(P<0.05),见表2。
2.2 血清VEGF和bFGF含量结果比较
在造模1周后,与对照组比较,模型组和右美托咪定组血清中VEGF和bFGF水平显著降低,差异有统计学意义(P<0.05);与模型组比较,右美托咪定组血清中VEGF和bFGF水平显著升高,差异有统计学意义(P<0.05),见表3。
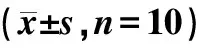
表2 各组大鼠肺组织干湿重和呼吸频率结果Table 2 Results of dry and wet weight and respiratory rate of lung tissue in each
注:与对照组相比较,*P<0.05;与模型组相比较,#P<0.05
Note: compared with the control group,*P<0.05; compared with the model group,#P<0.05
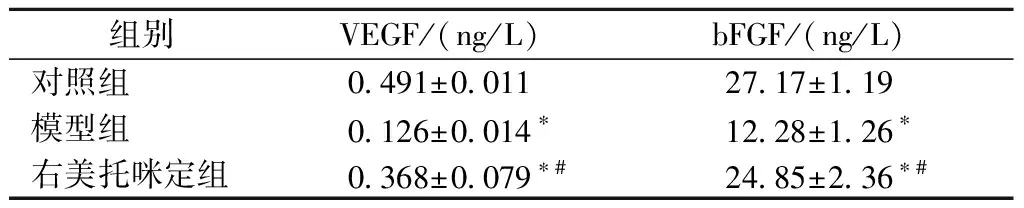
表3 各组大鼠血清中VEGF和bFGF含量比较(n=16)Table 3 Comparison of serum VEGF and bFGF levelsin each group of rats (n=16)
注:与对照组相比较,*P<0.05;与模型组相比较,#P<0.05
Note: compared with the control group,*P<0.05;compared with the model group,#P<0.05
2.3 血清IL-6和iNOS蛋白含量比较
在造模1周以后,与对照组比较,模型组和右美托咪定组IL-6和iNOS水平均显著升高,差异有统计学意义(P<0.05);与模型组比较,右美托咪定组IL-6和iNOS水平均显著降低,差异有统计学意义(P<0.05),见表4。

表4 各组大鼠血清中IL-6和iNOS含量比较(n=16)Table 4 Comparison of serum IL-6 and iNOS (n=16)
注:与对照组相比较,*P<0.05;与模型组相比较,#P<0.05
Note: compared with the control group,*P<0.05; compared with the model group,#P<0.05
2.4 IL-2和TNFα表达情况
RT-PCR结果显示,与对照组比较,模型组IL-2和TNFα的表达量显著升高(P<0.05)。右美托咪定组的IL-2和TNFα表达量与模型组相比降低,与对照组相比略有升高,但差异无统计学意义(P>0.05),见表5,图1。
表5 各组大鼠IL-2和TNFα表达量比较(n=16)Table 5 Comparison of IL-2 and TNFα expression(n=16)
注:与对照组相比较,*P<0.05;与模型组相比较,#P<0.05
Note: compared with the control group,*P<0.05;compared with the model group,#P<0.05

图1 RT-PCR 检测IL-2和TNFα表达情况Fig.1 RT-PCR detection of IL-2 and TNFα expression
2.5 NLPR3和Cav-1蛋白表达情况
蛋白质免疫印记检测结果显示,与对照组比较,模型组和右美托咪定组的NLPR3和Cav-1蛋白表达量显著升高,差异均有统计学意义(P<0.05)。与模型组比较,右美托咪定组NLPR3和Cav-1蛋白表达量显著降低,差异均有统计学意义(P<0.05),见表6,图2。
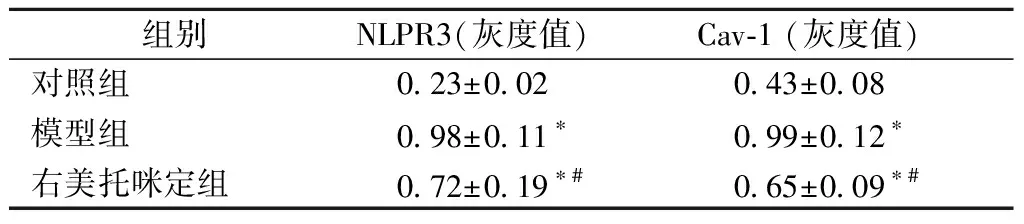
表6 各组大鼠NLPR3和Cav-1蛋白表达量比较(n=16)Table 6 Comparison of NLPR3 and Cav-1protein expression (n=16)
注:与对照组相比较,*P<0.05;与模型组相比较,#P<0.05
Note: compared with the control group,*P<0.05;compared with the model group,#P<0.05

图2 Western Blot 检测NLPR3和Cav-1蛋白表达情况Fig.2 Western Blot detection of NLPR3 andCav-1 protein expression
3 讨论
急性肺损伤指的是直接或者间接因素引起的肺泡及毛细血管细胞的损伤[7-8],导致肺部间质水肿以及急性呼吸功能不全,呼吸窘迫。由高氧引起的急性肺损伤案例目前已有很多报道[9],一方面氧气量的保障对不能自主呼吸的病人十分重要,另一方面长时间的吸入高纯度的氧又会造成肺损伤,所以寻求合适的方式治疗或预防由高氧引起的急性肺损伤十分重要。
VEGF和bFGF 在血管生成作用中占有重要的位置,可改善组织的缺氧状态,研究表明血清中VEGF和bFGF的含量与肺损伤严重程度相关[10-11]。本研究显示,大鼠在高氧仓饲养1周造模以后,模型组和右美托咪定组血清中VEGF和bFGF含量整体变低。右美托咪定组SD大鼠VEGF和bFGF含量与正常相比略有变化,与模型组相比恢复明显。此外,SD大鼠在实验期间肺组织的干湿重比例结果显示,模型组的肺组织干湿重比明显高于空白对照组和右美托咪定组,呼吸也变缓慢甚至衰竭,当给药以后各项指标均大幅恢复接近空白对照组,此结果初步探讨了右美托咪定对肺损伤的恢复作用。综合以往研究结果显示[3,6],右美托咪定对大鼠呼吸频率及其它指标恢复更显著,但其作用机制尚不明确。
白介素的表达量会直接引起炎症反应[12-13]。本实验结果显示,在构建高氧模型以后,血清中的IL-6和IL-2表达量升高,高于空白对照组,经过右美托咪定干预后,IL-2和IL-6表达量降低,接近正常水平,结果显示,右美托咪定可以降低肺损伤,减少白介素的过度表达。TNF-a是肿瘤坏死因子,肿瘤坏死因子是炎症反应过程中直接相关的炎症因子[14]。报道显示,TNF-α的表达量升高直接反应机体炎症程度。本实验结果显示,在构建高氧模型以后,模型组的TNF-α的表达量明显高于空白对照组,但是经过右美托咪定干预后,TNF-α表达量降低,肺损伤程度也对应降低,提示右美托咪定对急性肺损伤的治疗可能与炎症因子调控相关。
NLRP3是细胞凋亡的重要蛋白[15-16],本研究发现,建模以后,NLRP3的蛋白表达量明显升高,注射右美托咪定之后,NLRP3蛋白表达量降低,此结果验证右美托咪定阻遏高氧引起的急性肺部损伤有NLRP3的参与。Cav-1是重要的结构与调节蛋白,会参与到各组通路信号的转导当中,调节细胞的跨膜和转运,研究表明,Cav-1所在通路的激活会调控炎症因子的表达,使肺损伤加重[17]。本实验结果显示,模型组Cav-1的蛋白表达量与空白对照组相比呈升高趋势,进一步提示右美托咪定可以通过降低Cav-1蛋白表达量来缓解急性肺损伤。本研究显示,右美托咪定可降低由高氧引起的肺损伤导致的呼吸频率降低,肺组织干湿重比例变大。此外,右美托咪定还可以降低血清中的白介素IL-6,iNOS,VEGF和bFGF的表达,同时下调IL-2和TNF-α等促炎因子的表达水平。蛋白表达检测结果显示,右美托咪定可降低NLRP3和Cav-1蛋白的表达量,因此我们认为右美托咪定治疗急性肺损伤可以通过下调NLRP3炎症小体,激活Cav-1所在通路,进而实现肺高氧损伤保护。既往相关机制研究主要集中于TLR通路调控,本研究为右美托咪定肺部保护机制提供了新的方向。
综上,右美托咪定可通过抑制NLRP3的异常表达,减少下游关键蛋白Cav-1等的表达,抑制重要的炎症相关因子IL-2,IL-6,TNF-a等炎症因子的表达,缓解急性肺损伤。
