超高效液相色谱法(UPLC)测定猪肉中9种生物胺含量
2019-07-10尹青春谭高好谭淑君朱琰婷王运选
邓 浩,尹青春,谭高好,徐 彬,谭淑君,朱琰婷,王运选
(1.海南省农业科学院农产品加工设计研究所,海南海口 570100; 2.海南省热带果蔬冷链研究重点实验室,海南海口 570100; 3.海南省食品检验检测中心,海南海口 570100; 4.襄阳市食品药品检验检测中心,湖北襄阳 441100)
生物胺是一类含氨基的具有生物活性的低分子量碱性有机化合物的总称,主要包括色胺、β-苯乙胺、腐胺、尸胺、组胺、章鱼胺、酪胺、亚精胺、精胺等[1]。食品中大部分的生物胺是在加工和贮藏过程中,食品表面的微生物释放出氨基酸脱羧酶并催化氨基酸脱羧形成[2]。生物胺广泛存在于各类食品中,尤其富含蛋白质和氨基酸的食品,含有生物胺较多的食品有:鱼、肉及其制品、干酪及乳制品、酒及各类发酵产品、水果、蔬菜等。因此,生物胺的含量多少可作为判别食品细菌性腐败程度的指标之一[3-5]。极少量生物胺是生物体内的正常活性成分,在生物细胞代谢中发挥着重要的生理作用。但当人体内蓄积到一定程度的生物胺,会引起诸如头痛、恶心、心悸、呼吸紊乱等过敏反应,严重者还会危及生命。欧盟及我国对食品中生物胺做了限量:欧盟规定鲭鱼科样品中组胺≤100 mg/kg,其他食品中的组胺≤100 mg/kg,酪胺不得超过100~800 mg/kg[6];我国规定高组胺鱼类样品中组胺≤40 mg/100 g;其他鱼类样品中组胺≤20 mg/100 g[7-8]。
目前,生物胺的检测方法有液相色谱法[4-5]、超高效液相色谱法[6]、气相色谱法、薄层色谱法、传感器法和毛细管电泳法[9]、超高效液相色谱-串联质谱法[10]、气相色谱-串联质谱法[11]等生物胺检测方法。采用液相色谱法测定时,重复性好、检测灵敏度高、定量分析准确,是国内外定量检测食品中生物胺最常用的方法,也常用于检测禽畜肉中生物胺的含量。但液相法往往需要柱前衍生,且普通液相法分离几种物质所需时间较长,不适用于批量检测;超高效液相色谱-串联质谱法、气相色谱-串联质谱法等分离时间短,不需要柱前衍生,但仪器设备昂贵,所需耗材成本高;离子色谱分离时间长,部分生物胺成分不能检测[4];气相法具有分离效率高、分析速度快、选择性好等优点,但样品前处理复杂耗时,且对生物胺组分进行定性分析时,一般需要与质谱联用才能获得准确的结果,增加了设备的成本等。综合以上方法的优缺点,本研究建立了超高效液相色谱法(Ultra performance liquid chromatography,UPLC)测定猪肉中9种生物胺的检测方法。
1 材料与方法
1.1 材料与仪器
丹磺酰氯GR 赛默飞世尔科技(中国)有限公司;甲醇、乙腈 色谱级,德国Merck公司;乙酸铵 色谱级,Fisher Chemical;三氯乙酸(简称TCA) AR,国药集团化学试剂有限公司;氢氧化钠、NaHCO3、丙酮 AR,广州化学试剂厂;氨水 AR,西陇化工股份有限公司;9种生物胺标准品及内标 详见表1;市售猪肉 郑华菜场2份,东门菜场2份,金鹿花园菜市场2份,城东菜市场2份,于2018年5月20~25日购买,放于-20 ℃冰箱储藏。
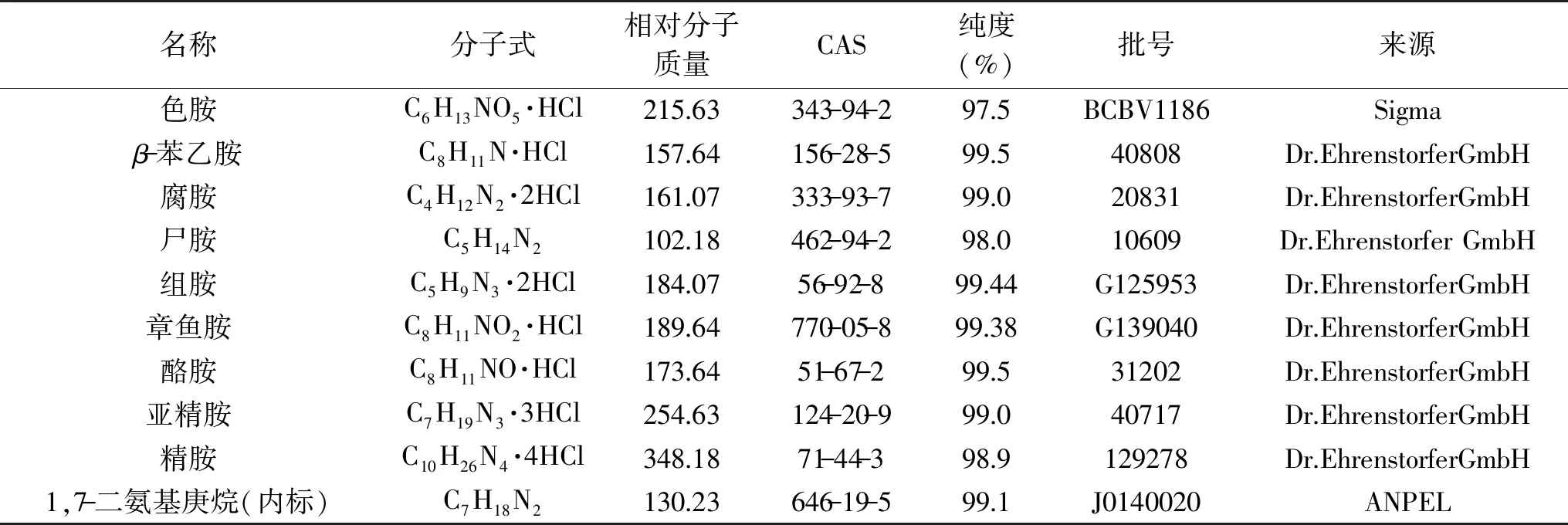
表1 9种生物胺标准品及内标信息 Table 1 Standard and internal standard information of 9 biogenic amines
Waters 2695液相色谱(DAD和FLD(荧光检测器))、Waters ACQUITY H UPLC® CLASS超高压高效液相色谱仪(DAD(二极管阵列,下同)检测器) 美国Waters公司;LC-20A液相色谱(DAD检测器) 日本岛津公司;Centrifuge 5804 R高速冷冻离心机 德国Eppendorf公司;Mettler XS204十万分之一分析天平 美国Mettler Toledo公司。
1.2 实验方法
1.2.1 标准工作溶液的配制 准确称取各生物胺标准物质10.0 mg(精确到 0.1 mg),甲醇溶解并定容至10.0 mL,配得浓度为1.0 mg/mL的单标溶液;准确吸取上述各单标溶液适当体积于100.0 mL容量瓶中,甲醇定容配得浓度为100.0 μg/mL的9种物质混标溶液;于4 ℃下避光保存。
1.2.2 仪器及色谱柱的选择 UPLC法:本实验采用Waters ACQUITY H UPLC® CLASS超高效液相色谱仪(DAD检测器),ACQUITY BEH C18(2.1 mm×100 mm,1.7 μm)色谱柱,流动相:10 mmol/L乙酸铵(A)-乙腈(B);梯度洗脱程序:0~7.0 min,40% A;7.1~11 min,15% A;11.1~13 min,40% A;流速:0.3 mL/min;进样量3.0 μL;检测波长为245 nm;柱温35 ℃。以保留时间定性,峰面积百分比定量,内标法计算。
本实验着重比较了Waters ACQUITY H UPLC® CLASS超高效液相色谱仪(DAD检测器)、LC-20A岛津(DAD检测器)高效液相色谱仪、Waters e2695(DAD和FLD检测器)高效液相色谱仪以及ACQUITY BEH C18(2.1 mm×100 mm,1.7 μm)色谱柱、Agilent ZORBAX-AB C18(5 μm,4.6 mm×250 mm)色谱柱、Waters XBrige C18(5 μm,4.6×250 mm)色谱柱对生物胺分离效果。
Waters ACQUITY H UPLC® CLASS超高效液相色谱仪(DAD检测器)采用ACQUITY BEH C18(2.1 mm×100 mm,1.7 μm)色谱柱,仪器条件按1.2.2叙述的UPLC法,进样的9种生物胺的浓度均为50.0 μg/mL;
以下均采用文献报道的洗脱方法[12-14],洗脱程序均按表2,柱温35 ℃,进样量10 μL,DAD检测器检测波长245 nm,荧光检测器检测波长为激发波长入ex:350 nm、吸收波长入em:520 nm,进样的9种生物胺的浓度均为50.0 μg/mL。LC-20A岛津液相(DAD检测器)采用Agilent ZORBAX-AB C18(5 μm,4.6 mm×250 mm)色谱柱;Waters e2695液相(DAD检测器)采用Waters XBrige C18(5 μm,4.6×250 mm)色谱柱;Waters e2695液相(FLD检测器)采用Waters XBrige C18(5 μm,4.6 mm×250 mm)色谱柱。
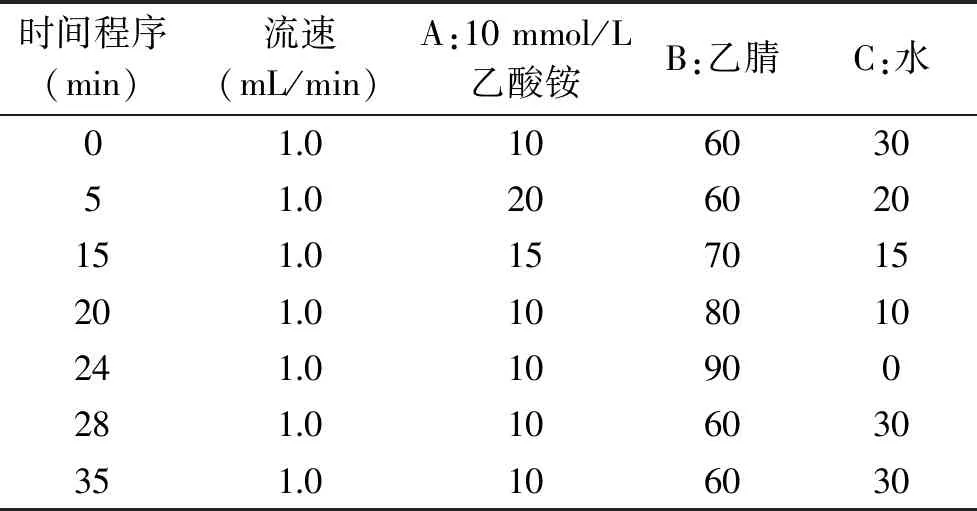
表2 梯度洗脱程序Table 2 Gradient elution program
1.2.3 样品提取及衍生化
1.2.3.1 样品提取条件及衍生化条件 提取:准确称取经磨碎的试样2.00 g(精确到0.01 g)于50 mL离心管中,加入2 mL 100 μg/mL内标使用液,加入10 mL 5% TCA,漩涡振荡5 min,于4 ℃冷冻离心机离心10 min,转速10000 r/min,离心后取上清液。残渣再加入5 mL 5% TCA重复提取一次,合并上清液,最后用5% TCA定容至20 mL,作为待测液。
衍生化:吸取生物胺样品待测液及标准溶液1.0 mL置于10 mL离心管中,加入0.1 mL 100 μg/mL内标使用液,0.2 mL 2 mol/L NaOH溶液,0.3 mL饱和NaHCO3缓冲溶液,调节pH约为11,然后加入2 mL 10 mg/mL丹磺酰氯(溶于丙酮),于60 ℃反应15 min,立即加入0.2 mL氨水(25%)混匀,终止衍生反应,于暗处静置20 min,用乙腈定容至10 mL,于4 ℃条件下10000 r/min离心3 min,取上清液过0.22 μm滤膜上机。
1.2.3.2 提取条件优化 按照1.2.3.1样品提取步骤,根据文献报道及国标的检测方法进行优化,考察2%、5%、10% TCA提取液的提取效果[12-14]。
1.2.3.3 生物胺标准溶液及样品的衍生化条件优化 按照1.2.3.1衍生化步骤,采用2 mol/L氢氧化钠和饱和NaHCO3缓冲溶液调节提取液的酸碱体系的pH为pH5、7和11左右[14],确定衍生化的最优pH,比较不同温度30、45、60 ℃进行水浴的衍生效果[15-17]。
1.3 流动相的优化
按照1.2.2 UPLC法的仪器条件,根据文献[12-15]报道,以1.2.2 UPLC法的梯度洗脱程序和表3中A~D的洗脱程序进行调试,以确定最佳流动相,进样的9种生物胺的浓度均为50.0 μg/mL。
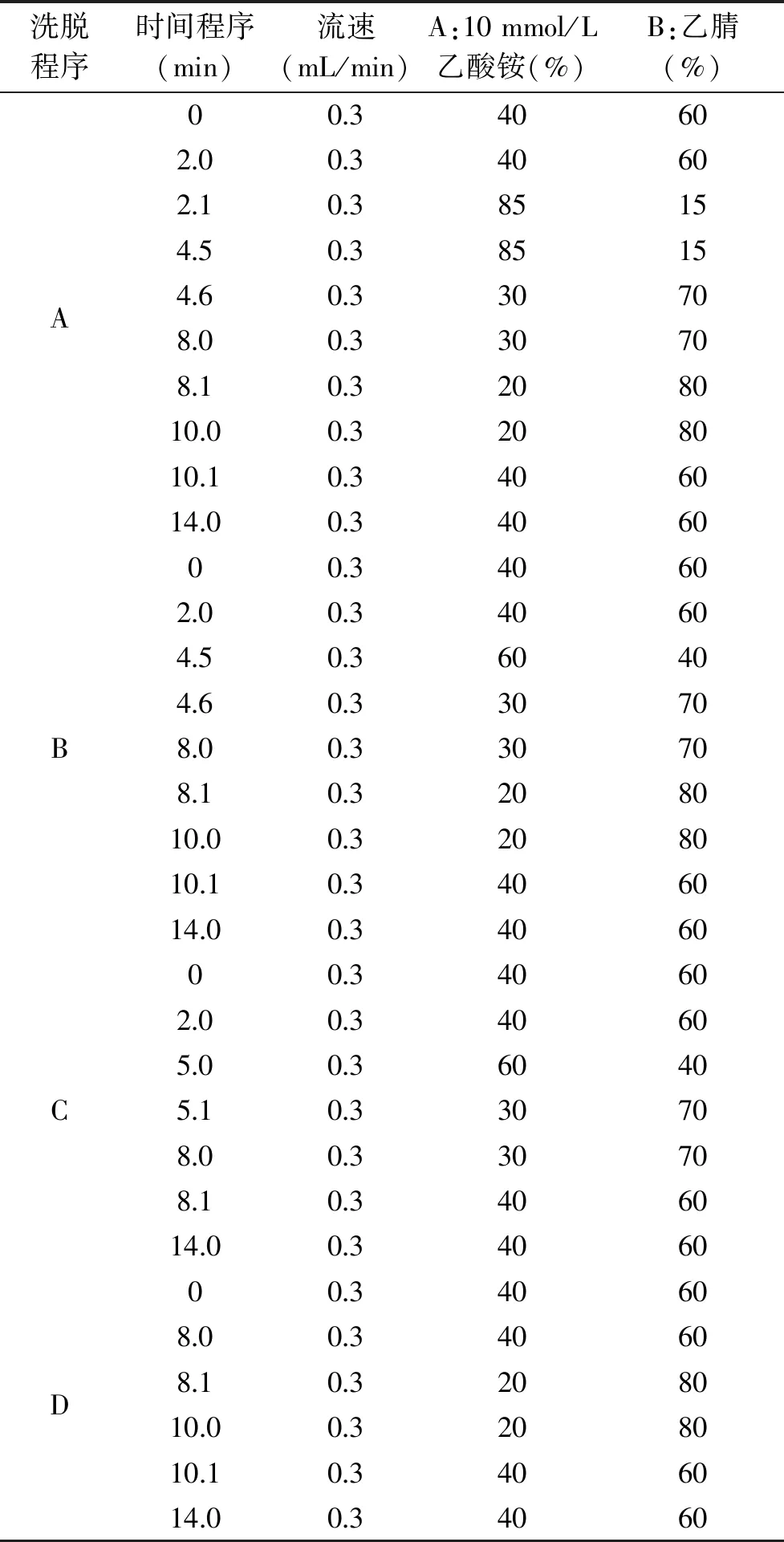
表3 梯度洗脱程序 表3 Gradient elution program
1.4 线性范围、检出限和定量限
精密吸取5.0~100.0 μg/mL系列标准品工作溶液,按照1.2.2 UPLC法仪器条件进行测定,以9种生物胺质量浓度(X)为横坐标,各生物胺与内标衍生物的峰面积比值(Y)为纵坐标,建立标准曲线,方法的检出限(LOD)和定量限(LOQ)是通过空白猪肉样品加入不同浓度的标准工作溶液的方法测定的,其中当信噪比S/N ≥3.0时的含量为检出限,S/N ≥10.0时的含量为定量限。
1.5 回收率实验
本实验以猪肉为基质做回收率实验,取空白的猪肉样品,9种生物胺的添加水平均为50、100、200 mg/kg,每个添加水平做6个平行,前处理方法及衍生化方法按1.2.3,仪器条件按1.2.2,进行检测,计算回收率和相对标准偏差。
1.6 仪器精密度实验
对质量浓度为50.0 μg/mL的9种生物胺标准品进行重复测定6次,计算相对标准偏差。
1.7 样品测定
通过建立的UPLC法对市场购买的8份猪肉样品中生物胺的种类和含量进行测定,每个样品平行测定2次。
1.8 数据处理
本实验采用Excel进行数据的结果计算,Waters仪器自带的Empower和岛津仪器自带的LC solution数据处理及绘图软件进行数据分析及绘图。
2 结果与分析
2.1 仪器及色谱柱的筛选
由图1~图2可知,LC-20A岛津和Waters e2695采用DAD检测器,9种生物胺均达到较好的分离,且峰型较好,灵敏度较高,说明LC-20A岛津(DAD检测器)和Waters e2695(DAD检测器)以及所使用的色谱柱Agilent ZORBAX-ABC18和Waters XBrige C18色谱柱均可用于生物胺的检测。由图3可知:采用Waters e2695(FLD检测器)检测,9种生物胺各组分有较好的分离度,但是FLD检测的组胺、章鱼胺和酪胺的响应值较小;由图4可知:采用Waters UPLC(DAD检测器)检测,9种生物胺组分在10 min内被全部洗脱出来,分离度良好,峰型较好,杂峰较少,灵敏度较高。
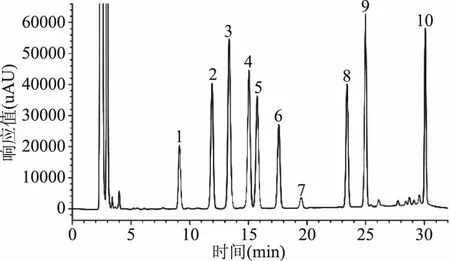
图1 LC-20A岛津高效液相DAD检测器检测的9种生物胺标品色谱图Fig.1 Standard of 9 biogenic amines HPLC chromatogram of LC-20A DAD detector
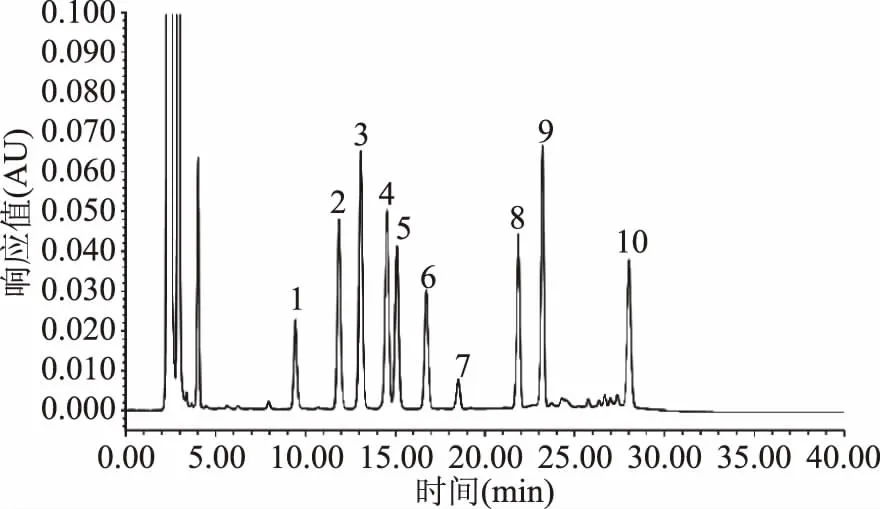
图2 Waters e2695高效液相DAD检测器检测的9种生物胺标品色谱图Fig.2 Standard of 9 biogenic amines HPLC chromatogram of Waters DAD detector
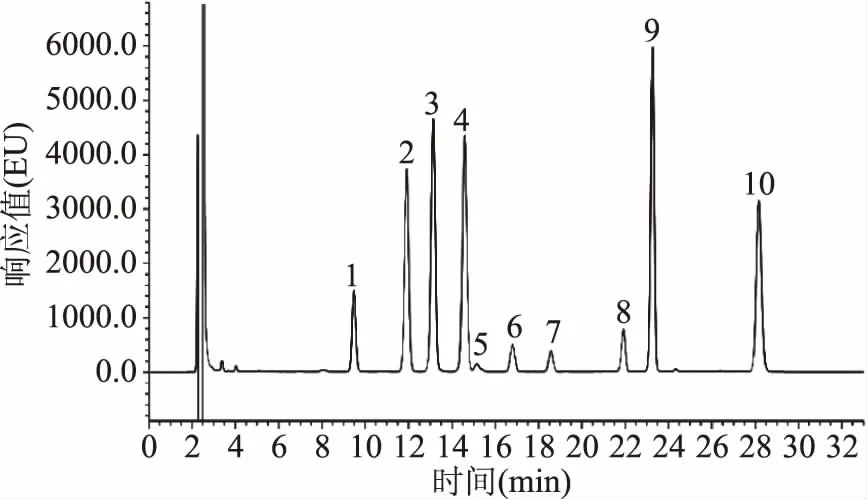
图3 Waters e2695高效液相FLD检测器检测的9种生物胺标品色谱图Fig.3 Standard of 9 biogenic amines HPLC chromatogram of Waters FLD detector
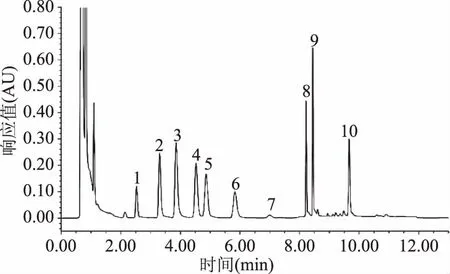
图4 Waters UPLC超高效液相DAD检测器检测的9种生物胺标品色谱图Fig.4 Standard of 9 biogenic amines UPLC chromatogram of Waters UPLC DAD detector注:1:色胺;2:β-苯乙胺;3:腐胺;4:尸胺;5:组胺; 6:章鱼胺;7:1,7-二氨基庚烷(内标);8:酪胺; 9:亚精胺;10:精胺;图1~图3,图6~图8同。
由图1~图3可知:LC-20A岛津(DAD检测器)和Waters e2695(DAD和FLR检测器)及所使用的色谱柱均可对9种生物胺进行检测,但每一针样品均耗时30 min以上,在实际检验中,对于大批量猪肉类样品中生物胺的检测耗时过长,降低了检测效率。因此,本文选择采用Waters ACQUITY H UPLC® CLASS超高效液相色谱仪(DAD检测器)进行生物胺检测方法的优化。
2.2 提取条件及衍生化条件的优化
优化的提取及衍生条件为:猪肉样品经5% TCA(三氯乙酸)两次提取,取提取液1 mL中加入0.2 mL 2 mol/L氢氧化钠溶液,0.3 mL饱和NaHCO3缓冲溶液,调节pH11左右,然后加入丹磺酰氯溶液2 mL,于60 ℃水浴衍生反应15 min,取出流水冷却后,立即加入0.2 mL氨水(25%)混匀,终止衍生反应,于暗处静置20 min,用乙腈定容至10 mL,于4 ℃条件下10000 r/min离心3 min,取上清液过滤膜上机。空白样品、样品、样品加标的图谱如图5~图7所示。在该条件下,9种生物胺分离度较好,每一针样品的上样时间比普通液相缩短近3倍,各组分灵敏度好,大大缩减了在实际应用中的时间成本,为快速测定猪肉类样品中9种生物胺奠定了基础。
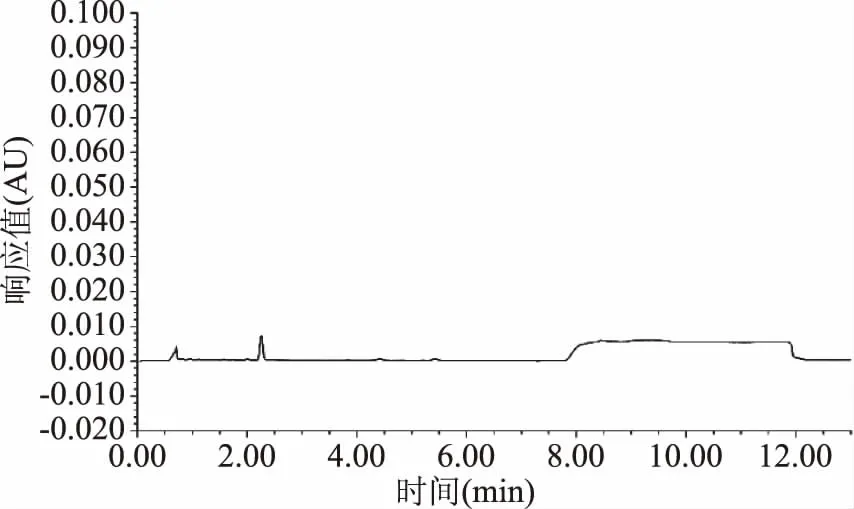
图5 空白样品中生物胺的色谱图Fig.5 UPLC chromatogram of biogenic amines in blank sample
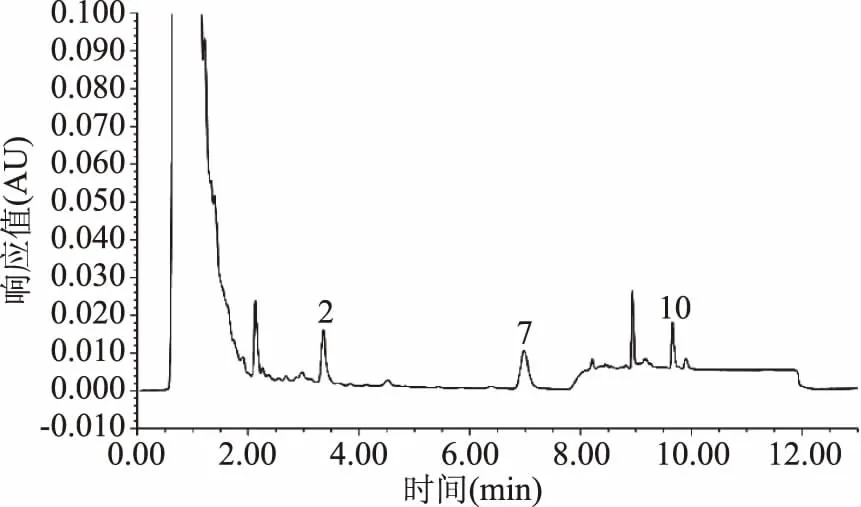
图6 猪肉样品中生物胺的色谱图Fig.6 UPLC chromatogram of biogenic amines in pork
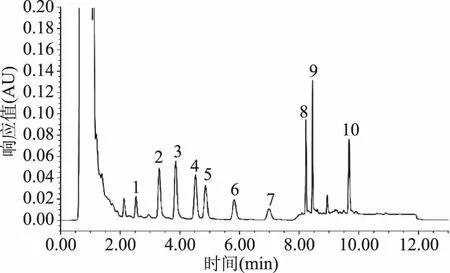
图7 猪肉样品中加入生物胺标准品的色谱图(10mg/kg)Fig.7 UPLC chromatogram of pork sample spiked biogenic amine at 10 mg/kg
2.3 流动相的优化
以表3洗脱程序A~D(表3洗脱程序A~D的出峰谱图分别对应图8A~D)及1.2.2 UPLC法梯度洗脱程序进行流动相的优化。由图8可知,图8A中β-苯乙胺出峰时间滞后,色胺和β-苯乙胺间有比较长一段平缓无杂质峰出现的时间,因此,将β-苯乙胺等洗脱时间提前,即在表3-A的洗脱程序基础上,将2~4.6 min内有机相比例增大,调至表3-B洗脱程序,β-苯乙胺等的出峰时间提前,洗脱结果见图8B;由图8B可知:β-苯乙胺和腐胺间有比较长一段平缓无杂质峰出现的时间,所以调节表3-B的洗脱程序至表3-C洗脱程序;从图8C可知:腐胺等的保留时间只缩短0.5 min,且峰型及分离度仍然不是很好,因此,调至表3-D的洗脱程序;由图8D可知:生物胺各组分达到很好的分离度,且峰型对称;从图8A~D可知,精胺均未出峰,调洗脱程序至1.2.2 UPLC法梯度洗脱程序,将7.1~11 min时间段内的乙腈比例调大后,精胺出现,说明高比例有机相可将精胺洗脱下来。因此,相比表3的洗脱程度结果(结果见图8A~D),采用1.2.2 UPLC法梯度洗脱程序进行实验(结果见图4)。
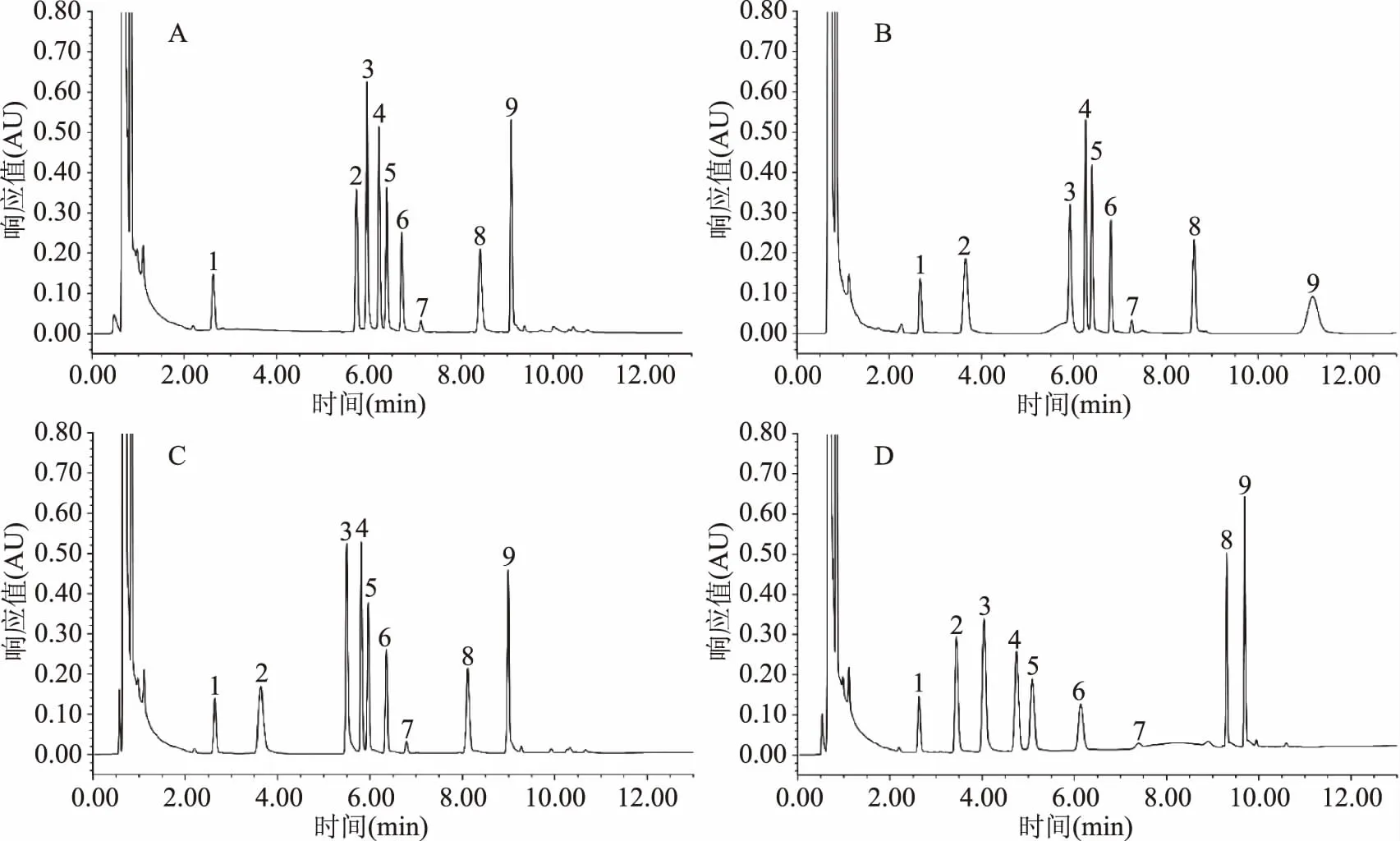
图8 流动相优化的谱图Fig.8 Chromatogram of the flow phase optimization
2.4 线性范围、检出限和定量限
UPLC法测定9种生物胺的保留时间、回归方程、相关系数、检出限以及定量限见表4。9种生物胺与内标衍生物的峰面积比值与其对应的标准浓度呈良好的线性关系,线性范围为5.0~100.0 μg/mL,相关性系数r≥0.999。色胺、β-苯乙胺、腐胺、尸胺、组胺、章鱼胺、酪胺、亚精胺、精胺检出限分别为0.240、0.018、0.095、0.130、0.170、0.290、0.033、0.028、0.080 mg/kg,比国标GB 5009.208-2016《食品安全国家标准 食品中生物胺的测定》中规定的检出限20 mg/kg低很多,说明本检测方法灵敏度较高。

表4 9种生物胺的保留时间、回归方程、相关系数、检测限及定量限Table 4 Retention time,linear equation,correlation coefficient,limits of detection and quantification of 9 biogenic amines
2.5 回收率实验
由表5可知,9种生物胺在猪肉中添加的回收率在70.70%~111.80%,相对标准偏差在0.33%~9.40%之间,说明本方法回收率和重复性较好。
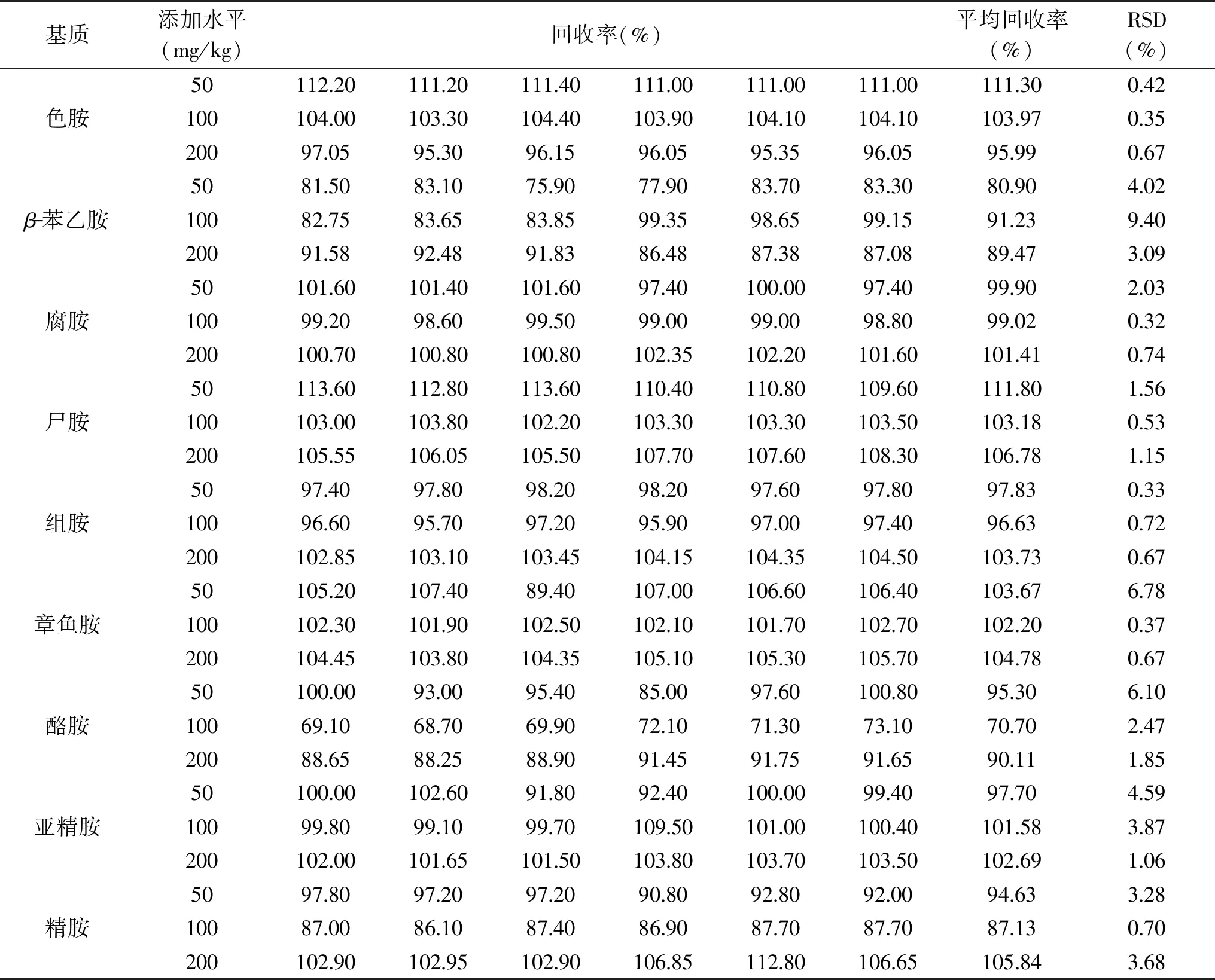
表5 回收率实验结果(n=6)Table 5 Experimental results of recovery rate(n=6)
2.6 仪器精密度实验
由表6可知:RSD(n=6)≤3.72%,这说明仪器具有较好的精密度,适用于生物胺的检测。
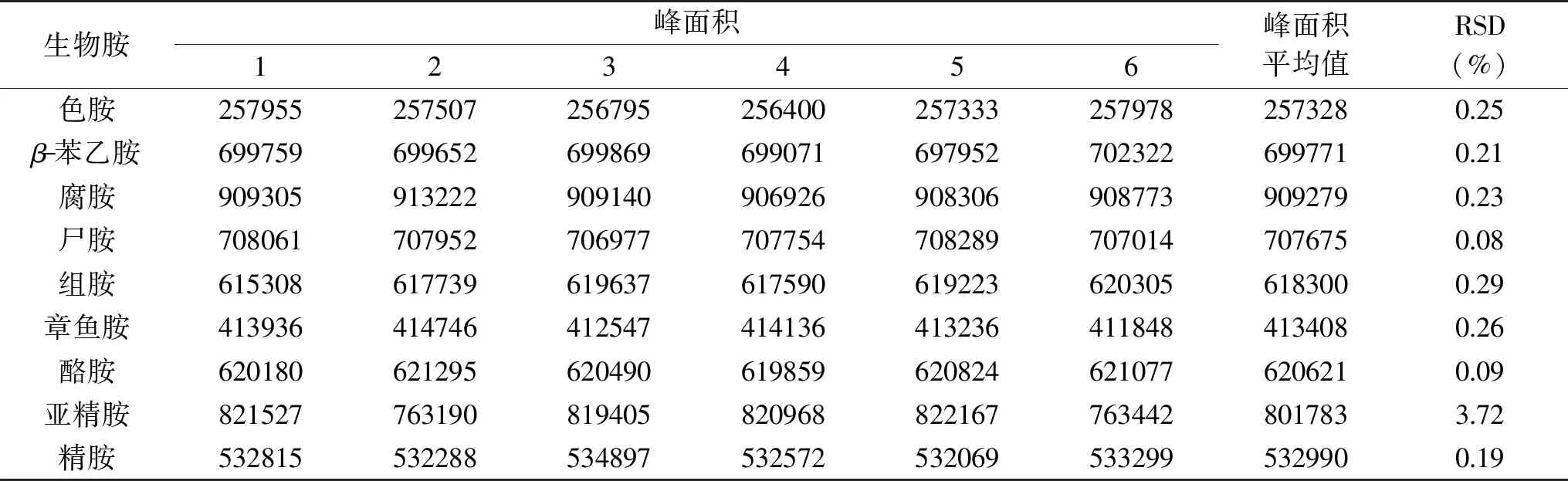
表6 精密度实验结果(n=6)Table 6 Experimental results of precision(n=6)
2.7 样品测定
由表7可知,不同猪肉样品中含有的生物胺种类、含量及比例基本一致,猪肉中均含有精胺和β-苯乙胺,部分含有亚精胺和酪胺;有文献报道:精胺和亚精胺是猪肉中的组成性胺类[18],β-苯乙胺也可能是在饲养猪时饲料中添加物质[19];酪胺与反映产品腐败品质的微生物数量、pH等相关,可以作为判断冷却猪肉腐败品质变化重要的指标。本样品是分批次购买,且一直放置于-20 ℃储存,部分检测时已放置5 d左右,因此,部分猪肉可能出现少量微生物增加的趋势,故部分猪肉中有酪胺检出,与文献报道一致[20]。
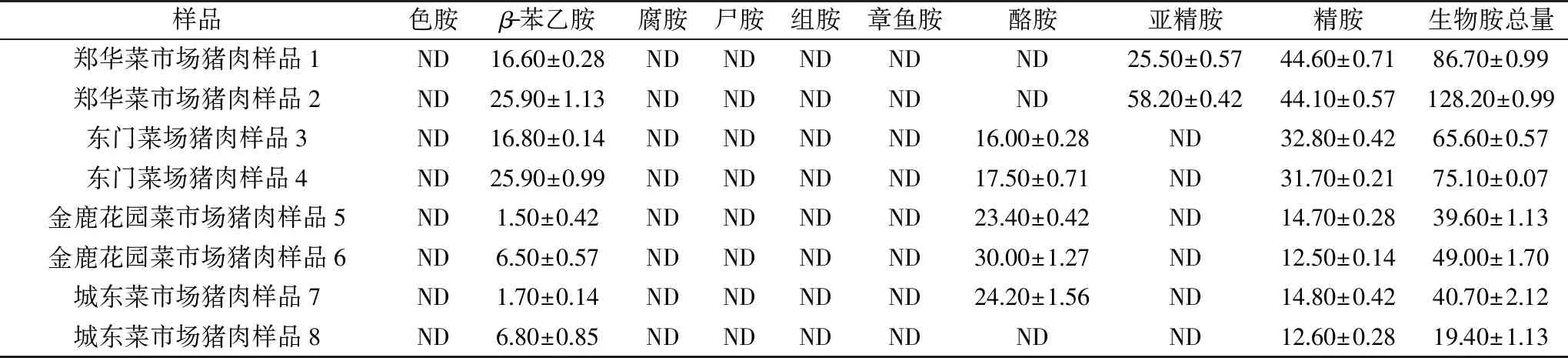
表7 猪肉样品中生物胺的含量(mg/kg)Table 7 Biogenic amines contents of pork samples(mg/kg)
3 结论
本实验建立了一种快速测定猪肉中9种生物胺的UPLC测定方法。样品经5%三氯乙酸溶液提取后用10 mg/mL丹磺酰氯进行衍生,流动相为乙腈-10 mmol/L乙酸铵,采用梯度洗脱,流速0.3 mL/min,检测波长245 nm。结果表明:采用5%三氯乙酸溶液提取,丹磺酰氯进行衍生,应用二极管阵列检测器能满足猪肉中生物胺的分析检测要求。色胺、2-苯乙胺、腐胺、尸胺、组胺、章鱼胺、酪胺、亚精胺和精胺能在10 min内得到良好分离,线性范围为5.0~100.0 μg/mL(r≥0.999),色胺、β-苯乙胺、腐胺、尸胺、组胺、章鱼胺、酪胺、亚精胺、精胺检出限分别为0.240、0.018、0.095、0.130、0.170、0.290、0.033、0.028、0.080 mg/kg,比国标GB 5009.208-2016《食品安全国家标准 食品中生物胺的测定》中规定的检出限20 mg/kg低很多。通过对8批市场购买的样品进行检测,其生物胺总量在(19.40±1.13)~(128.20±0.99) mg/kg,由于本样品是分批次购买,且一直放置-20 ℃储存,部分检测时已放置5 d左右,因此检测结果有差异。本实验建立的方法操作简单、灵敏度高、节省时间,且可同时测定9种生物胺的含量,其平均回收率在70.70%~111.80%之间,样品回收率相对标准偏差在0.33%~9.40%之间,仪器精密度RSD(n=6)≤3.72%,满足检测需要,对于猪肉中生物胺的快速批量检测有较大的实际应用前景,对我国开展食品中生物胺的风险技术评估和降低生物胺膳食摄入危险都具有重要参考意义。
