申克孢子丝菌STE20基因RNA干扰菌株的构建方法
2019-07-10赵林王林会郑方亮侯彬彬
赵林 王林会 郑方亮 侯彬彬
(1.大连医科大学附属第二医院,大连 116021;2.大连理工大学生命科学院,大连 116024;3.辽宁大学生命科学院,沈阳 110031)
RNA干扰是真核生物中相对保守的基因沉默机制,它通过内源或外源双链RNA介导细胞内mRNA发生特异性降解或翻译的抑制,从而导致靶基因的表达沉默,并产生相应的功能表型缺失。
1992年,Macino首次在粗糙脉胞菌中发现真菌中存在RNAi的现象后,RNAi技术渐成为一种对真菌进行遗传改造的新手段[1-3]。在丝状真菌中RNAi技术具有特殊的优势:不受丝状真菌的多核现象、异核现象和非同源重组频率高的干扰,特别是当需要使多个基因的表达同时下调时,使用RNA干扰比基因敲除更加方便。然而,真正将RNAi技术用在丝状真菌的各项研究时还存在很多问题:真菌细胞多为多倍体,细胞壁含有较多的多糖及多糖蛋白等成分,使得RNA沉默的效果并不如在原生、动物细胞中理想,存在干扰效率低下、有脱靶效应等缺陷。因此选择恰当的遗传转化方法并制备合适的转染载体,可以更高效的导入siRNA,保证导入siRNA的稳定性,有效延长RNAi的作用时间,进而大大提高靶基因抑制效率,更好的对丝状真菌进行基因改造。
本文对现有的植物双元表达载体进行改造,加入多克隆位点,引入真菌通用启动子Ptrpc、间隔序列和终止子Ttrpc,并引入潮霉素抗性基因,使其在间隔序列两侧加上目的基因的正反向干扰序列后即可广泛用在多种真菌基因干扰的研究中[4]。
1 材料与方法
1.1 材料
菌株 DH5α,EHA105。
质粒 PCB-309,PUC-PUT。
酶和主要试剂XbaⅠ,XhoⅠ,SpeⅠ,SacⅠ,KpnⅠ,BglⅡ,HindⅢ等限制性内切酶,T4 DNA连接酶,Taq酶、T载体、反转录试剂盒、DNA分子量Marker(Marker 2000, 5000)购自大连Takara公司。质粒提取试剂盒、RNA提取试剂盒、DNA纯化回收试剂盒购自天根生化科技有限公司。
培养基 LB(Luria-Bertani)液体培养基(g/l)。Tryptone 10g;Yeast extract 5g;NaCl 10gLB(Luria-Bertani)固体培养基(g/l)。Tryptone 10g;Yeast extract 5g;NaCl 10g;琼脂 15g。
实验所用引物STE20-F: 5’-CGGGGTACCCTCGAGTTGCAGCTCCAAGCACAAC -3’ 酶切位点:KpnI,XhoI
STE20-R: 5’-GAAGATCTAAGCTTCAGTGAGTTTGCCTCGGTAC -3’ 酶切位点:BglⅡ,HindⅢ
(扩增STE20基因引物)
CUT-F:5’-TACCCACTGGAGATTTGTTGG-3’
CUT-R:5’-CAACAAATCTCCAGTGGGTAC-3’
(pUC-PUT质粒中间间隔序列引物)
1.2 实验方法
质粒提取、DNA纯化回收 见天根试剂盒说明书。
总RNA提取 总RNA提取使用RNA提取试剂盒,方法如下:①提取RNA实验中使用的耗材等均为无RNase污染,水为RNase-Free超纯水。②菌体离心后,加入350 μL细胞裂解液RL(使用前加入β-巯基乙醇)。③裂解3 min后,将裂解液转移到过滤柱CS柱上,12000 r/min离心2 min,收集滤液。④加入等体积的70%乙醇,混匀后转移至吸附柱CR3中,12000 r/min离心1 min,倒掉收集管中的废液,将吸附柱放回收集管上。⑤吸附柱中加入350 μL去蛋白液RW1,12000 r/min离心1 min,倒掉收集管中的废液。⑥吸附柱CR3膜上加入80 μL稀释的DNase I工作液,室温静置15 min。⑦吸附柱中加入350 μL去蛋白液RW1,12000 r/min离心1 min,倒掉收集管中的废液。⑧取500 μL漂洗液RW加到吸附柱中,室温静置2 min,12000 r/min离心1 min,倒掉收集管中废液。重复操作1次。⑨12000 r/min离心2 min,倒掉废液。室温静置5 min,彻底晾干残留的漂洗液。⑩将吸附柱放入1个新的RNase-Free离心管中,取50 μL RNase-Free水加到吸附柱中膜上,静置2 min,12000 r/min离心2 min,得到RNA溶液。11用新配的琼脂糖凝胶进行电泳,电泳液也为新鲜配制,鉴定提取RNA的质量。
RNA反转录 将提取的总RNA反转录为cDNA作为PCR扩增的模板。具体方法如下:① 在RNase-Free PCR管中配制下列混合液:
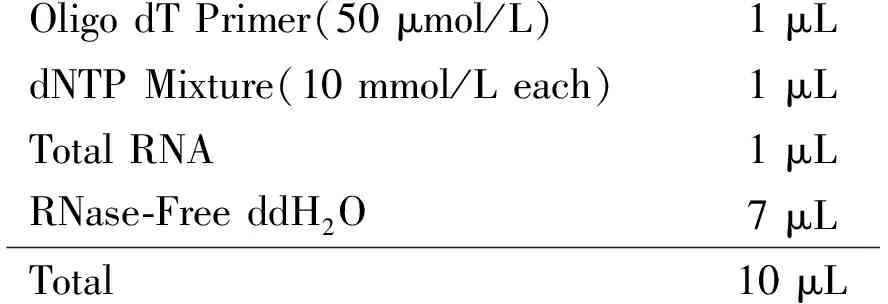
Oligo dT Primer(50 μmol/L) 1 μLdNTP Mixture(10 mmol/L each) 1 μLTotal RNA1 μLRNase-Free ddH2O 7 μLTotal10 μL
② 在PCR仪上进行变性反应,65 ℃ 5 min,冰上立即冷却。
③ 在该PCR管中继续配制下列反转录反应液:

变性后反应液10 μLRnase Inhibitor(40 U/μL) 0.5 μLPrimeScript RTase(200 U/μL) 1 μL5×buffer4 μLRNase-Free ddH2O4.5 μLTotal20 μL
④ 进行反转录反应,反应条件为30 ℃ 10 min,42 ℃ 60 min,95 ℃ 5 min使酶失活,冰上冷却。
感受态细胞的制备 将DH5α菌保接到LB液体培养基中,将接菌后的试管于温度37℃,220 r/min,培养16 h。然后转接到50 mL LB液体培养基中(按约1∶100的量转接),220 r/min,37℃培养到OD6000.6。然后,将培养物加到50 mL离心管中冰上预冷10 min。4℃,4000 r/min离心5 min,弃去上清。用预冷30 mL的CaC12(0.l mol/L)重悬,冰上放置30 min,然后,4℃,4000 r/min离心5 min,弃上清。最后用l mL预冷的CaC12(0.l mol/L)重悬,用枪吹吸,使其均匀,按100 μL一管分装。
转化感受态细胞 每管感受态细胞加入连接产物10 μL,轻轻旋转以混匀,在冰上放置30 min。将管放入预加温至42℃的水浴中,热激70s。快速将管转移到冰浴中,使感受态细胞冷却2 min。每管加入90 μL的液体LB,37℃摇床温育60 min,使细菌复苏并表达质粒编码的抗生素标记抗性基因。4000 r/min离心后用100 μL液体LB重悬,涂布于含有相应抗生素的固体LB平板上。倒置于37℃培养,16 h后挑选所需阳性克隆,提取质粒,酶切验证。
RNA干扰载体pCB309-PSUST的构建 ①构建PUC-PSUT:a.以cDNA为模板,用引物STE20-F和STE20-R扩增STE20基因的干扰序列,得到片段长度约540 bp。b.将PCR片段纯化回收,用XhoⅠ和HindⅢ双酶切;将PUC-PUT用XhoⅠ和HindⅢ双酶切。酶切后再分别纯化回收。c.将酶切后的纯化PCR片段与酶切后纯化的PUC-PUT载体进行连接,连接为环形质粒得到PUC-PSUT(见图1)。d.将连接产物转化到大肠杆菌DH5α,挑取单菌落,提质粒,测序验证[5]。
酶切体系:

PCR片段(50~100 ng/μL)5 μLXhoⅠ1 μLHindⅢ1 μL 10×buffer2 μLddH2O11 μLTotal 20μL
酶切温度:37℃,时间:3h。
连接体系:

PCR片段(50~100 ng/μL)8μLpUC-PUT载体2μLT4连接酶1 μL10×buffer2 μLddH2O7 μLTotal 20μL
连接温度:16℃,时间:16 h。
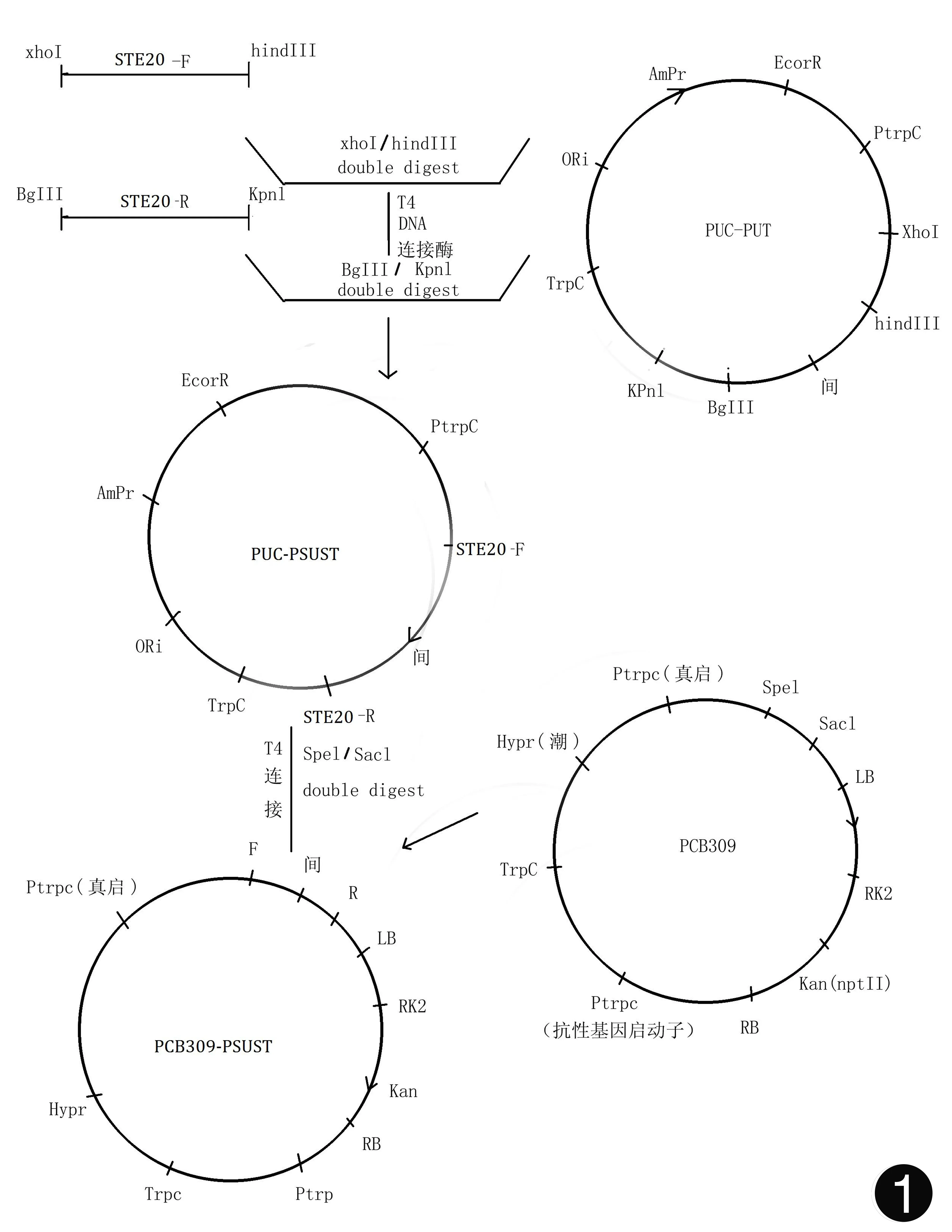
图1 载体构建模式图
②构建PUC-PSUST:a.以cDNA为模板,用引物STE20-F和STE20-R扩增STE20基因的干扰序列,得到片段长度约540 bp。b.将PCR片段纯化回收,用BglⅡ和KpnⅠ双酶切;将PUC-PSUT用BglⅡ和KpnⅠ双酶切。酶切后再分别纯化回收。c.将酶切后的纯化PCR片段与酶切后纯化的PUC-PSUT载体进行连接,连接为环形质粒得到PUC-PSUST。d.将连接产物转化到大肠杆菌DH5α,挑取单菌落,提质粒,测序验证。
酶切体系:

PCR片段或质粒(50~100 ng/μL)5 μLXhoⅠ1 μLHindⅢ1 μL 10×buffer2 μLddH2O11 μLTotal20 μL
酶切温度:37℃,时间:3 h。
连接体系:

PCR片段(50~100 ng/μL)8μLPUC-PSUT载体2μLT4连接酶1 μL10×buffer2 μLddH2O7 μLTotal 20 μL
连接温度:16℃,时间:16 h。
③构建pCB309-PSUST:a.将PUC-PSUST和PCB309分别用SpeⅠ和SacⅠ双酶切。酶切后再分别纯化回收。b.将从PUC-PSUST酶切并纯化的PSUST片段与酶切后纯化的PCB-309载体进行连接,连接为环形质粒得到PCB309-PSUST。c.将连接产物转化到大肠杆菌DH5α、挑取单菌落、提质粒、SpeⅠ和SacⅠ双酶切酶切验证及PCR鉴定。鉴定时用引物STE20-F分别与CUT-F、CUT-R搭配鉴定。
酶切体系:

质粒(50~100 ng/μL)5 μLSpeⅠ1 μLSacⅠ1 μL 10×buffer2 μLddH2O11 μLTotal20 μL
酶切温度:37℃,时间:3 h。
连接体系:

PSUST片段(50~100 ng/μL)8μLPCB-309载体2μLT4连接酶1 μL10×buffer2 μLddH2O7 μLTotal 20 μL
连接温度:16℃,时间:16 h。
电转感受态的制备 ①取EHA105菌保加入LB(含利福平抗生素)培养基中,30 ℃摇床过夜培养。②200 μl的过夜培养菌转接于新鲜的20 mL LB(含利福平抗生素)培养基中。③30 ℃摇床培养3~4 h,待OD600值达0.4~0.6时停止培养。4 ℃,4000 r/min,离心5 min,弃上清,收集菌体。④用20 mL 10%的甘油洗两遍(第2遍时甘油量减半)。
⑤离心后的菌体沉淀用150 μL 10%的甘油溶解,冰上放置2 h。使用时分装,每管50 μL。若不当天使用,与等体积的30%的甘油混合,于-80 ℃保存。
电转感受态的转化 ①回收的PCR产物跑电泳粗略估算浓度,取适量质粒加入电转感受态细胞中,用枪头混匀。②取电转感受态细胞至冰预冷的电转杯中。③将电转杯放置于电转仪上电激。一般电激条件为:0.1 cm的电转杯,1350 V,10 μF,600 ohms;理想的电激时间为4.5~4.9 ms。④电激后,冰上放置1 min。加入1 mL无抗性的LB培养基,30 ℃培养1 h。⑤培养液4000 r/min离心5 min,弃掉大部分上清,留200 μL溶解沉淀。涂布于LB(含利福平和卡那抗生素)固体平板上,30 ℃过夜培养,待长出重组子,PCR鉴定。
2 结 果
2.1 RNA干扰载体pCB309-PSUST的构建
①将STE20正向干扰序列540 bp连接到PUC-PUT载体的Ptrpc启动子和间隔序列之间,得到载体PUC-PSUT载体,双酶切鉴定3400bp,再通过测序鉴定(见图2)。②再将STE20反向干扰序列540 bp连接到PUC-PSUT载体的间隔序列和Ttrpc终止子之间,得到载体PUC-PSUST,双酶切鉴定5000 bp,再通过测序鉴定(见图3)。③将PUC-PSUST上的PSUST片段通过酶切切下来,与PCB309 (5.4 kb)连接,得到载体PCB309-PSUST(见图4)。④PCB309-PSUST质粒的农杆菌转化:将上步构建的PCB309-PSUST质粒用电转化的方法转到农杆菌EHA105中,对阳性克隆进行PCR鉴定(见图5)。⑤含有载体PCB309-PSUST的根癌农杆菌介导转化孢子丝菌的实验进行了3批次,每批次平均每皿所获得的转化子是比较恒定的。证明根癌农杆菌介导的转化方法比较稳定且重复性好。
图2PUC-PSUT质粒双酶切鉴定图,XhoⅠ和HindⅢ双酶切图3PUC-PSUST质粒双酶切鉴定图,用BglⅡ和KpnⅠ双酶切图4PCB309-PSUST 酶切鉴定图5PCB309-PSUST转化子质粒PCR鉴定图,鉴定引物STE20-F/CUT-F,STE20-F/CUT-R
Fig.2Identification of pUC-PSUT plasmid by double digestion and double digestion byXhoⅠ andHindⅢFig.3Identification of PUC-PSUST plasmid by double digestion withBglⅡ andKpnⅠFig.4Identification of PCB309-PSUST by restriction enzyme digestionFig.5PCR identification map of PCB309-PSUST transformants plasmid, identification primers STE20-F/CUT-F, STE20-F/CUT-R
3 讨 论
载体的构建复杂又精细,每一步的改造都至关重要。目前使用的双元载体多数在10kB以上,不利于载体构建等基因工程方面的操作。实验中保留双元载体pBI121的必须元件和序列,将其改造为较小的双元载体,并具卡那霉素抗性。为方便进一步的操作,将pBlueScriptII的多克隆位点(MCS)酶切下来构建干扰载体中;为使载体适于农杆菌转化,加入了T-DNA边界重复序列;为便于转化后的筛选,又将潮霉素抗性基因构建到干扰载体上。改造以前的干扰载体仅适于青霉菌属的RNA干扰,为扩大干扰范围,扩增了pSilent-1质粒中的真菌通用启动子Ptrpc,并将其置于干扰载体中,至此成功构建一种适于根癌农杆菌介导的,能对多种丝状真菌基因进行RNA干扰研究用的载体[6-7]。
利用本实验构建的载体PCB309-PSUST 及优化的反应体系成功实现了对孢子丝菌STE20基因的有效干扰,操作简便、转化效率高、转化子稳定,具有很好的应用前景。该方法的研发可使RNA干扰技术更广泛的用在真菌基因功能的研究中,有可能设计出RNAi芯片,高通量的筛选药物靶基因,并可望用于新型药物的研究及更广泛的生物医学研究领域中。近年来,RNA干扰技术的出现据报道,已成功应用于一些病原性真菌的基因功能研究中,如新生隐球菌、烟曲霉和荚膜组织胞浆菌等[8-10],本试验成功构建针对孢子丝菌STE20的RNAi表达载体,这将给深入系统的研究病原性真菌的致病机制提供更有力的技术手段,也为将来在基因组水平上开展大规模的基因功能研究打下坚实的基础。
