pUC19-pbp2b重组质粒转化对肺炎链球菌感受态菌株耐药性的影响▲
2016-02-17赵卫东忽胜和杨新原
赵卫东 忽胜和 杨新原 孔 山
(1 云南省大理大学临床医学院检验诊断学教研室,大理市 671000,E-mail:wdzhao1229@foxmail.com;2 云南省大理大学第一附属医院检验科,大理市 671000)
论著·基础研究
pUC19-pbp2b重组质粒转化对肺炎链球菌感受态菌株耐药性的影响▲
赵卫东1忽胜和2杨新原2孔 山1
(1 云南省大理大学临床医学院检验诊断学教研室,大理市 671000,E-mail:wdzhao1229@foxmail.com;2 云南省大理大学第一附属医院检验科,大理市 671000)
目的 探讨pUC19-pbp2b重组质粒转化对肺炎链球菌(SP)感受态菌株耐药性的影响。方法 收集13株对青霉素不敏感的SP菌株,其中8株青霉素结合蛋白(PBPs)编码基因pbp2b未突变,5株pbp2b基因突变,制备SP感受态。化学合成含SSN保守区的pbp2b基因片段,构建pUC19-pbp2b重组质粒,将重组质粒转化感受态菌株。测定青霉素、头孢呋辛、头孢噻肟、头孢曲松和头孢吡肟5种β-内酰胺酶类抗生素(BLA)对转化前后SP感受态菌株的最小抑菌浓度(MIC)。结果pbp2b基因扩增产物可见约300 bp的特异条带,13株SP菌株均能形成感受态。与转化前菌株比较,5种抗生素对转化后菌株的MIC均降低(P<0.05)。5种抗生素对5株转化后的pbp2b基因突变菌株的MIC均降低(P<0.05)。结论 外源重组质粒转化SP感受态可以协助减缓SP耐药性的进展。
肺炎链球菌;青霉素结合蛋白;感受态;重组质粒;耐药性;β-内酰胺酶类抗生素
耐青霉素肺炎链球菌(Streptococcuspneumoniae,SP)主要是由于SP自身青霉素结合蛋白(penicillin-binding proteins,PBPs)编码基因突变所产生[1]。感受态是细菌自然形成的一种状态,可摄取周围环境中裸露DNA片段,SP是最易形成感受态的细菌[2]。前期试验中,我们发现临床分离的13株青霉素不敏感SP中的5株存在PBPs编码基因pbp2b突变[3],为了进一步探讨外源重组质粒转化SP感受态菌株对β-内酰胺类抗生素(β-lactamase antibiotics,BLA)敏感性所产生的影响,本研究继续对13株临床分离的青霉素不敏感SP进行分析研究,现报告如下。
1 材料与方法
1.1 菌株来源与保存 收集临床送检的呼吸道感染婴幼儿的痰或咽拭子标本中分离的SP 24株,其中13株为青霉素不敏感菌株,用含30%甘油的脑心浸液肉汤(青岛海博生物技术有限公司,批号:HB8297-1)在-80℃低温冻存。前期实验[3]已验证,这13株青霉素中8株pbp2b基因未突变,5株pbp2b基因突变。
1.2pbp2b基因合成 根据GenBank(https://www.ncbi.nlm.nih.gov/nuccore/NC_003098)中SP标准菌R6株(NC-003098)基因序列,化学合成SP含SSN区的pbp2b基因片段,序列如下:GCG GTC CAA GCT CTG GAG TAT TCA TCA AAT ACC TAT ATG GTC CAA ACA GCC TTA GGT CTT ATG GGG CAA ACC TAT CAA CCC AAT ATG TTT GTC GGC ACC AGC AAT CTA GAG TCT GCT ATG GAG AAA CTG CGT TCA ACC TTT GGC GAA TAT GGC TTG GGT ACT GCG ACA GGA ATT GAC CTA CCA GAT GAA TCT ACT GGA TTT GTT CCC AAA GAG TAT AGC TTT GCT AAT TAC ATT ACT AAT GCC TTT GGG CAG TTT GAT AAC TAT ACG CCG ATG CAG TTG GCT CAG TAT GTA GCA ACT ATT,共300 bp,由上海铂尚生物技术公司合成。采用Primer 5.0软件设计包含BamH Ⅰ和Hind Ⅲ双酶切位点的pbp2b基因扩增引物,序列如下:上游 5′-CGC GGA TCC GCG GTC CAA GCT CTG GAG TAT-3′,下游 5′-CCA AGC TTA ATA GTT GCT ACA TAC TGA G-3′。将化学合成的pbp2b基因稀释至20 pmol,作为扩增模板,用2×Taq PCR MasterMix 试剂盒 (北京天根生化科技有限公司,批号KT201)进行PCR。热循环参数为:94℃预变性3 min,然后94℃ 30 s,55℃ 30 s,72℃ 30 s,最后72℃延长5 min,共30个循环,产物300 bp。PCR产物用1%琼脂糖凝胶进行电泳并纯化回收。
1.3 pUC19-pbp2b重组质粒构建pbp2b扩增产物和pUC19载体(Thermo Fisher Scientific公司,批号:SD0061)分别用BamH Ⅰ(Thermo Fisher Scientific公司,批号:ER0051)和Hind Ⅲ内切酶(Thermo Fisher Scientific公司,批号:SD0501)进行双酶切,回收pbp2b基因片段和载体片段,根据连接试剂盒(Thermo Fisher Scientific公司,批号EL0014)说明书方法,16℃连接过夜,回收pUC19-pbp2b连接产物,转化感受态大肠杆菌DH5α(北京天根生化科技有限公司,批号:CB101-01)。
1.4 蓝白斑试验 将pUC19-pbp2b转化后的大肠杆菌DH5α接种于含25 mg/ml异丙基硫代半乳糖苷(Sigma公司,批号:I5502)、20 mg/ml 5-溴-4-氯-3-吲哚-β-D半乳糖苷(Sigma公司,批号:B4252)和100 mg/ml氨苄西林(Sigma公司,批号:A6140)LB平板(海博生物公司,批号:HB0129),37℃培养18 h后,挑白色菌落,接种于含100 mg/ml氨苄西林的液体培养基中,37℃摇床摇菌过夜。用快速质粒小提试剂盒(北京天根生化科技有限公司,批号:DP105-03)抽提pUC19-pbp2b重组质粒,送上海铂尚生物技术公司进行测序验证。
1.5 SP感受态制备 按照Bättig等[4]的方法,将-80℃保存的SP迅速置于37℃水浴中3 min以复苏菌株,将菌液倒入感受态转化培养基(Sigma公司,批号:Y1625;其中含C+0.5%酵母抽提物、1 mmol/L CaCl2和5%胎牛血清)中,置于含5% CO2的培养箱中37℃静置孵育至A600=0.15,即得到感受态菌株。
1.6 pUC19-pbp2b重组质粒转化SP感受态 参照周侠等[5]重组质粒转化SP感受态的方法,将感受态刺激因子(由上海科肽生物公司合成;氨基酸序列为:EMRLSKFFRDFILQRKK,终浓度为100 ng/ml)加入含SP感受态菌株的培养液中,同时将pUC19-pbp2b重组质粒加入,37℃孵育1 h,接种于含氨苄西林(200 μg/ml)的哥伦比亚血平板(生物梅里埃公司,批号:43041),5% CO2的培养箱37℃孵育24 h,挑取菌落,接种于脑心浸液培养基(青岛海博生物,批号:HB8297-1)中增菌。
1.7 药敏试验 根据美国临床和实验室标准协会的标准[6],采用微量肉汤稀释法,分别测试转化前后的SP对青霉素、头孢呋辛、头孢噻肟、头孢曲松和头孢吡肟5种β-内酰胺酶类抗生素的药敏性,抗生素稀释采用2倍稀释法,浓度范围为0.125~1 024 μg/ml。质控菌为SP ATCC 49619(购自上海乐讯生物公司)。
1.8 统计学分析 采用SPSS 20.0软件进行统计学分析。计量资料以(x±s)表示,比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1pbp2b基因扩增产物 PCR产物经1%琼脂糖凝胶电泳分析,可见300 bp左右特异条带,见图1。
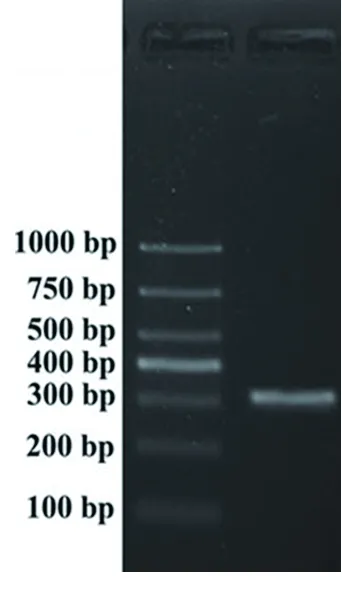
图1 pbp2b基因扩增条带
2.2 pUC19-pbp2b重组质粒构建 蓝白斑实验结果显示,白斑为pUC19-pbp2b阳性质粒,蓝斑为pUC19-pbp2b阴性质粒。见图2。
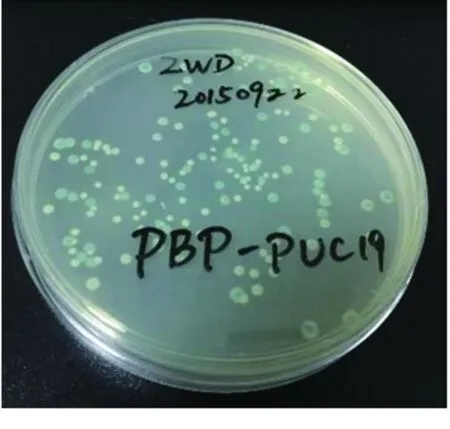
图2 pUC19-pbp2b重组质粒蓝白斑实验
2.3 SP转化前后药敏试验 13株青霉素不敏感(包括8株pbp2b基因未突变,5株pbp2b基因突变)SP感受态制备后进行转化,与转化前菌株比较,青霉素等5种β-内酰胺酶类抗生素对转化后菌株的最小抑菌浓度(minimum inhibitory concentration,MIC)均降低(P<0.05),见表1。

表1 13株青霉素不敏感SP 转化前后对抗生素药敏性比较
2.4pbp2b基因突变菌株转化前后药敏试验 转化后,青霉素等5种β-内酰胺酶类抗生素对pbp2b基因突变菌株(第2、5、6、7、10号菌株)MIC均降低,见表2。

表2 5株pbp2b基因突变菌转化前后对抗生素药敏性比较(μg/ml)
3 讨 论
BLA通过与细菌细胞膜上的PBPs结合,产生酰胺酶中间物来抑制细菌繁殖,因此,编码PBPs的基因(主要包括pbp1a、pbp2b基因)突变是导致SP对青霉素耐药的重要原因[7]。本研究的前期结果以及其他研究均表明,PBPs编码基因的突变不仅导致了耐青霉素SP的出现,而且也对其他BLA,如氨曲南、头孢菌素和替卡西林等抗生素产生交叉耐药情况,多重耐药细菌的出现给临床治疗感染带来巨大挑战[3,8-9]。
感受态是SP自然形成的一种状态,SP感受态可以摄取周围环境中的DNA片段[10]。SP对青霉素的耐药性除了编码PBPs的基因发生突变造成外,也可以通过摄取周围耐药细菌的裸露质粒而产生,所以,SP感受态的形成可能也是造成该菌耐药的重要原因[11]。我们通过对13株青霉素不敏感菌株感受态转化前后对抗生素药敏性的分析,结果显示,与转化前菌株比较,青霉素等5种β-内酰胺酶类抗生素对转化后菌株的MIC均降低(P<0.05),提示转化后的感受态菌株对抗生素的敏感性均明显提升。
SPpbp2b基因突变主要发生在保守序列SSN区,该区域T(苏氨酸)→A(丙氨酸)[12],因此本研究构建了含SSN区的pUC19-pbp2b重组质粒,然后转化对青霉素不敏感pbp2b基因突变SP感受态菌株和pbp2b基因无突变菌株,检测青霉素等5种β-内酰胺酶类抗生素对转化菌的MIC,从而分析pbp2b基因在SP耐药性变异中的作用,同时探讨该方法改变SP耐药性的可行性。结果显示,青霉素等5种β-内酰胺酶类抗生素对PBPs突变菌株MIC均有不同程度地降低(P<0.05)。这可能是由于感受态菌株拥有了对青霉素敏感的保守基因,对于pbp2b基因突变菌株而言,其可以逆转对β-内酰胺酶类抗生素的耐药性,因此将外源质粒导入耐药菌可以恢复细菌对抗生素的敏感性,而野生型的青霉素敏感SP也可以通过摄取外源耐药质粒来产生耐药性。因此,这一方面提示pbp2b基因突变在SP耐药机制的重要作用,另一方面也从基因水平为消除SP对β-内酰胺酶类抗生素耐药性提供了一个新的思路。
综上所述,外源重组质粒转化SP感受态可以协助减缓SP耐药性的进展。由此可见,要阻止耐药细菌的产生和扩散,一方面在临床感染性疾病的治疗中合理适量应用抗生素,另一方面,寻找对抗细菌耐药性的新药物以及合适的方法也同样重要。
[1] Albarracin Orio AG,Pias GE,Cortes PR,et al.Compensatory evolution of pbp mutations restores the fitness cost imposed by beta-lactam resistance in Streptococcus pneumoniae[J].PLoS Pathog,2011,7(2):e1002000.
[2] Balaban M,Bättig P,Muschiol S,et al.Secretion of a pneumococcal type Ⅱ secretion system pilus correlates with DNA uptake during transformation[J].Proc Natl Acad Sci U S A,2014,111(7):E758-E765.
[3] 孔 山,忽胜和,杨新原,等.呼吸道感染婴幼儿肺炎链球菌的耐药性及青霉素结合蛋白基因突变分析[J].广西医学,2016,38(5):632-634.
[4] Bättig P,Mühlemann K.Influence of the spxB gene on competence in Streptococcus pneumoniae[J].J Bacteriol,2008,190(4):1 184-1 189.
[5] 周 侠,唐紫薇,杨致邦,等.肺炎链球菌pbp1a基因重组原核表达质粒的构建与鉴定[J].中国生物制品学杂志,2012,25(10):1 267-1 270.
[6] Patel JB.Performance Standards for Antimicrobial Susceptibility Testing:Twenty Fourth Informational Supplement [M].24th edition.Wayne:Clinical and Laboratory Standards Institute,2014:84-86.
[7] Asli A,Brouillette E,Krause KM,et al.Distinctive binding of avibactam to penicillin-binding proteins of Gram-negative and Gram-positive bacteria[J].Antimicrob Agents Chemother,2016,60(2):752-756.
[8] Ip M,Ang I,Liyanapathirana V,et al.Genetic analyses of penicillin binding protein determinants in multidrug-resistant Streptococcus pneumoniae serogroup 19 CC320/271 clone with high-level resistance to third-generation cephalosporins[J].Antimicrob Agents Chemother,2015,59(7):4 040-4 045.
[9] Philippe J,Gallet B,Morlot C,et al.Mechanism of β-lactam action in Streptococcus pneumoniae:the piperacillin paradox[J].Antimicrob Agents Chemother,2015,59(1):609-621.
[10]Wholey WY,Kochan TJ,Storck DN,et al.Coordinated bacteriocin expression and competence in Streptococcus pneumoniae contributes to genetic adaptation through neighbor predation[J].PLoS Pathog,2016,12(2):e1005413.
[11]Kjos M,Miller E,Slager J,et al.Expression of Streptococcus pneumoniae bacteriocins is induced by antibiotics via regulatory interplay with the competence system[J].PLoS Pathog,2016,12(2):e1005422.
[12]Sanbongi Y,Ida T,Ishikawa M,et al.Complete sequences of six penicillin-binding protein genes from 40 Streptococcus pneumoniae clinical isolates collected in Japan[J].Antimicrob Agents Chemother,2004,48(6):2 244-2 250.
Effect of transformation by recombinant plasmid pUC19-pbp2bon drug resistance of competent strain ofStreptococcuspneumoniae
ZHAOWei-dong1,HUSheng-he2,YANGXin-yuan2,KONGShan1
(1DepartmentofLaboratoryDiagnostics,ClinicalMedicineCollegeofDaliUniversity,Dali671000,China;2DepartmentofClinicalLaboratory,theAffiliatedHospitalofDaliUniversity,Dali671000,China)
Objective To explore the effect of transformation by recombinant plasmid pUC19-pbp2bon the drug resistance of competent strain ofStreptococcuspneumoniae.Methods ThirteenStreptococcuspneumoniaestrains insensitive to penicillin were collected,including 8 strains withoutpbp2bmutation of penicillin-binding proteins(PBPs) gene and 5 strains withpbp2bgene mutation.All strains were used for the preparation of competent strain ofStreptococcuspneumoniae.pbp2bfragment containing SSN conservative region was chemically synthesized and then recombinant plasmid pUC19-pbp2bwas constructed.And the recombinant plasmid was transformed into competent strains.The minimum inhibitory concentrations(MICs) of five β-lactamase antibiotics(including penicillin,cefuroxime,cefotaxime,ceftriaxone and cefepime) for the pre- and post-transformed competent strains ofStreptococcuspneumoniaewere determined.Results A specific band of about 300 bp was observed in the amplification product ofpbp2bgene.Competence strains of 13Streptococcuspneumoniaestrains were successfully obtained.The MICs of 5 antibiotics for the post-transformed strains decreased compared to those for the pre-transformed strains(P<0.05).The MICs of 5 antibiotics for 5 strains withpbp2bgene mutation after transformation decreased(P<0.05).Conclusion Competent strain ofStreptococcuspneumoniaetransformed by exogenous recombinant plasmid is helpful for slowing down the progression of the drug resistance toStreptococcuspneumoniae.
Streptococcuspneumoniae,Penicillin-binding protein,Competence,Recombinant plasmid,Drug resistance,β-lactamase antibiotics
云南省科技厅应用基础研究青年项目(2013FD095)
赵卫东(1983~),男,在读博士研究生,助教,研究方向:临床病原微生物。
孔山(1972~),男,在职研究生,讲师,研究方向:临床检验诊断学。E-mail:185354177@qq.com。
R 378.14
A
0253-4304(2016)11-1485-04
10.11675/j.issn.0253-4304.2016.11.02
2016-06-05
2016-08-02)
