溶剂热氧化少层Ti3C2 MXene制备二维TiO2/Ti3C2复合光催化剂
2019-07-10关云锋徐畑祥李轩科
严 康 关云锋 丛 野*, 徐畑祥 朱 辉 李轩科*,
(1武汉科技大学,湖北省煤转化与新型炭材料重点实验室,武汉 430081)(2武汉科技大学,省部共建耐火材料与冶金国家重点实验室,武汉 430081)
0 引 言
TiO2具有氧化效率高、无毒、光稳定性好、成本低以及绿色环保等优点[1-2],是一种很有应用前景的半导体光催化剂。但是光生电子-空穴对复合效率高降低了TiO2的光催化性能[3-4],成为TiO2光催化剂最主要的缺陷;其次,TiO2的禁带较宽,在紫外光照下才能激发产生电子-空穴对,对太阳光的利用率低[5-6],使得TiO2难以被大规模应用于光催化领域。为了提高TiO2的光催化性能,研究人员对TiO2光催化剂进行了改性处理,其中包括贵金属沉积[7]、阳离子掺杂改性[8]、阴离子掺杂改性[9]、半导体复合改性[10]等。已有大量文献报道证实用RGO(还原氧化石墨烯)或GO(氧化石墨烯)修饰TiO2可以提高TiO2的光催化性能。Fan等[11]通过几种不同的方法合成了RGO/TiO2复合材料,形成的C-O-Ti键使得TiO2的带隙变窄,而RGO优异的导电性降低了TiO2光生电子-空穴对的复合率,光催化性能得到明显提升。龙梅等[12]利用水热法制备了RGO-TiO2复合光催化剂,相比于纯的TiO2而言,RGO-TiO2复合光催化剂禁带宽度变窄且电子空穴对复合率降低,具有更高的光催化活性。
Ti3C2TxMXene是一种新型的二维纳米材料,Tx代表表面的负载基团(如羟基、氧或氟)[13],可以由氢氟酸[13]或盐酸和氟化锂的混合液[14]处理Ti3AlC2前驱体得到。通过氢氟酸处理Ti3AlC2前驱体得到的Ti3C2TxMXene具有典型的手风琴结构,由多层的Ti3C2Tx堆叠而成,标记为ML-Ti3C2(multilayer Ti3C2MXene);通过盐酸和氟化锂混合液处理Ti3AlC2前驱体并经过超声插层处理得到的Ti3C2Tx由一层或几层 Ti3C2Tx组成[15-16],标记为 DL-Ti3C2。 DL-Ti3C2具有独特的类石墨烯二维结构、优良的导电性、高的比表面积、亲水性表面以及丰富的表面含氧基团等优点[17-18],是一种高效的半导体光催化剂的助催化剂。Zhang等[19]利用二氧化碳作为氧化剂在500℃氧化ML-Ti3C2,在ML-Ti3C2的层间和边缘形成了大量的TiO2纳米颗粒。相比于 ML-Ti3C2,TiO2/ML-Ti3C2复合材料电极的比容量更高,循环稳定性更好。Lotfi等[20]研究了Ti3C2Tx在不同环境(干燥空气、湿润空气和过氧化氢溶液)及不同温度(1 000~3 000 K)下的氧化情况,发现不同环境中Ti3C2Tx的氧化速率不一样,而且可以通过控制反应温度得到不同含量、晶型的TiO2与Ti3C2Tx的复合材料。Naguib等[21]利用水热法在不同条件下(150℃反应48 h;200℃反应8、12和20 h;250℃反应2 h)氧化ML-Ti3C2制备TiO2/MLTi3C2复合材料,与CO2氧化ML-Ti3C2制备的TiO2/ML-Ti3C2复合材料相比,TiO2在ML-Ti3C2片层上分布更均匀。溶剂热法具有产物分散性较好、粒径大小和形态容易控制等优点。
因此,本文采用溶剂热法,用乙醇作为反应溶剂,通过控制氧化DL-Ti3C2一步合成TiO2/DL-Ti3C2复合光催化剂,并考察不同氧化温度对TiO2/DLTi3C2复合光催化剂的结构和性能的影响。控制氧化DL-Ti3C2可以一步合成TiO2/DL-Ti3C2复合材料,TiO2光照下能够产生电子-空穴对,而DL-Ti3C2能够提供电子传输通道以提高电子空穴分离效率,同时TiO2和DL-Ti3C2之间形成的C-O-Ti等化学键能够有效减小TiO2的禁带宽度,以期提高其光催化性能。
1 实验部分
1.1 实验试剂
实验所用的Ti粉(300目,纯度为99.99%)和Al粉(300目,纯度为99.5%)购于北京中金研新材料科技有限公司;天然石墨(400目,纯度为99.9%)购于青岛金海石墨制品有限公司;LiF(纯度为99.9%)购于阿拉丁化学试剂有限公司;二氧化钛P25(纯度为99.5%)购于Degussa中国有限公司;实验所用的其它化学试剂均为分析纯,购于国药集团化学试剂有限公司。
1.2 DL-Ti3C2的制备
将Ti粉、Al粉和天然石墨按照物质的量之比3∶1.2∶2球磨混匀,然后于管式电阻炉中在Ar气氛下1 350℃(10℃·min-1)保温30 min合成Ti3AlC2前驱体。将5 mL蒸馏水与15 mL盐酸(36.5%(w/w))混合均匀。称取1.0 g LiF粉末加入到上述稀释的盐酸中,磁力搅拌30 min使其充分溶解。然后将1 g Ti3AlC2粉末分次缓慢加入上述混合溶液中,最后于30℃搅拌24 h进行刻蚀。之后对样品进行多次离心分离和蒸馏水洗涤,直到pH值达到6左右;然后向清洗过后的样品中加入20 mL蒸馏水超声30 min,离心(3 000 r·min-1)得到 DL-Ti3C2的悬浮液。
1.3 TiO2/DL-Ti3C2复合材料的制备
量取一定体积的悬浮液进行抽滤,通过抽滤前后滤膜的质量变化计算悬浮液中DL-Ti3C2的浓度。将DL-Ti3C2悬浮液和无水乙醇按照体积比1∶1加入水热反应釜中,在不同温度下(120、140、160和180℃)反应24 h,制备TiO2/DL-Ti3C2复合光催化剂,并将其标记为TiO2/DL-Ti3C2-T,其中T表示溶剂热反应温度。
1.4 材料表征
实验采用BrukerA X′Pert PRO MPD型转靶X射线粉末衍射仪对材料进行X射线衍射 (XRD)测试,测试电压为40 kV,电流为30 mA,并以波长为0.154 056 nm的Cu Kα辐射线为辐射源,扫描范围为5°~90°。样品的微观形貌和显微结构由场发射扫描电子显微镜(NOVA 400 NANOSEM,工作电压30 kV)和场发射透射电子显微镜(FEI Tecnai G2 F20 STWIN,加速电压120 kV)进行表征。采用激光拉曼光谱仪 (LabRam HR Evolution)对材料进行拉曼光谱(Raman)测试。材料的元素组成、元素含量和化学键等信息通过X射线光电子能谱(XPS)进行分析,测试仪器为ThermoFischer ESCALAB 250Xi。材料的比表面积通过ASAP 2020物理吸附仪测试得到。采用紫外可见分光光度计(日本岛津公司UV-2550PC)测试材料的紫外-可见漫反射光谱,以BaSO4标准空白样作参比,扫描波长范围为300~800 nm。采用荧光光谱分析光催化剂的电子和空穴分离效率,测试仪器为日立F-7000荧光分光光度计。
1.5 光催化性能测试
将0.05 g光催化剂加入到100 mL浓度为50 mg·L-1的罗丹明B溶液,之后将搅拌的悬浮液置于黑暗环境中吸附2 h,直至吸附/脱附平衡,然后在可见光下进行光催化降解。实验利用中教金源CELHXF300型氙灯光源模拟太阳光,并配备滤波片,将得到的波长大于420 nm的可见光用于光催化降解实验,利用X3PC UV-Vis分光光度计测定溶液的吸光度以确定其降解率。
2 结果与讨论
2.1 样品的物相与形貌分析
图1为所制备的Ti3AlC2前驱体及DL-Ti3C2的XRD 图 。 图 1(a)在 2θ=9.5°、34.0°、39.0°、41.8°和60.8°处的衍射峰分别对应Ti3AlC2(PDF No.00-052-0875)的(002)、(101)、(104)、(105)和(110)晶面,说明产物中主要存在 Ti3AlC2,且结晶度较高;在 2θ=35.9°和72.4°处的弱的衍射峰对应TiC(PDF No.00-031-1400)的(111)和(311)晶面,说明合成的Ti3AlC2前驱体中存在少量的TiC杂质。Ti3AlC2在盐酸和氟化锂混合液刻蚀处理之后(图 1(b)),Ti3AlC2的衍射峰消失,在2θ=6.4°、17.8°、28.2°、35.6°、43.0°和 60.8°处出现了新的衍射峰,分别对应 Ti3C2Tx的(002)、(006)、(008)、(0010)、(0012)和(110)晶面,说明 Ti3AlC2在刻蚀之后形成了Ti3C2Tx,而且与文献报道的ML-Ti3C2相比,(002)晶面的特征衍射峰向低角度移动,说明制备的Ti3C2Tx层间距比ML-Ti3C2更大。

图1 (a)Ti3AlC2和(b)DL-Ti3C2的XRD图Fig.1 XRD patterns of(a)Ti3AlC2 and(b)DL-Ti3C2
为了进一步证明实验成功制得了DL-Ti3C2,对Ti3AlC2刻蚀处理前后的微观形貌进行了SEM表征。图2为Ti3AlC2在盐酸和氟化锂的混合液处理前后的SEM图。从图2(a)中可以看出,合成的Ti3AlC2具有MAX相典型的三元层状结构且表面光滑。Ti3AlC2在用混合液处理后(图2(b)),形貌发生了明显的变化,Ti3AlC2的三元层状结构被剥离开,形成了一层或几层堆叠的卷曲片层,与文献[22]报道的DL-Ti3C2形貌一致。盐酸和氟化锂混合液能够成功剥离Ti3AlC2制得DL-Ti3C2是因为Ti3AlC2前驱体中Ti-C键主要是共价键和离子键,强度高;而Ti-Al和Al-Al键有较多的金属键成分,相对较弱,所以Ti3AlC2在用盐酸和氟化锂混合液处理之后能够剥离掉Al元素,后期经过超声处理将水分子插入ML-Ti3C2的层间可进一步扩大其层间距得到DL-Ti3C2。
为了表征DL-Ti3C2氧化后的物相组成,对DLTi3C2在不同温度溶剂热氧化后的产物进行了XRD分析。图3为不同温度氧化后的TiO2/DL-Ti3C2的XRD 图。 位于 2θ=25.3°、36.9°、37.8°、48.0°、53.9°、55.1°、62.8°、68.8°、75.1°和 82.7°处的衍射峰分别对应锐钛矿型 TiO2(PDF No.01-084-1286)的(101)、(103)、 (004)、(200)、 (105)、 (211)、 (204)、 (116)、 (215)和(224)晶面;位于 2θ=6.3°和 60.8°处的衍射峰分别对应Ti3C2Tx的(002)和(110)晶面。当氧化温度较低时,样品中存在明显的Ti3C2Tx的衍射峰,说明低温下DL-Ti3C2的氧化程度较低,只有部分DL-Ti3C2被氧化形成了锐钛矿型TiO2。随着氧化温度的升高,Ti3C2Tx的衍射峰强度逐渐降低,同时锐钛矿型TiO2的衍射峰逐渐增强,说明在高温下DL-Ti3C2的氧化程度加深,复合材料中锐钛矿型TiO2的含量增加。

图2 (a)Ti3AlC2和(b)DL-Ti3C2的SEM图Fig.2 SEM images of(a)Ti3AlC2 and(b)DL-Ti3C2

图3 TiO2/DL-Ti3C2-T的XRD图Fig.3 XRD patterns of TiO2/DL-Ti3C2-T
图 4 为 TiO2/DL-Ti3C2-120、TiO2/DL-Ti3C2-140、TiO2/DL-Ti3C2-160和TiO2/DL-Ti3C2-180的SEM图。当氧化温度为120℃时,样品的表面可以观察到尺寸较小的氧化物颗粒,说明此时样品的氧化程度较浅。随着反应温度的进一步升高,DL-Ti3C2的表面逐渐变得粗糙,可以在片层表面和边缘观察到氧化物颗粒逐渐变大且数量增多。说明随着氧化温度的升高,DL-Ti3C2的氧化程度逐渐加深,形成了大量的TiO2纳米颗粒,与图3中的XRD结果相一致。

图4 TiO2/DL-Ti3C2-T的SEM图Fig.4 SEM images of TiO2/DL-Ti3C2-T
图 5 为 DL-Ti3C2、TiO2/DL-Ti3C2-120 和 TiO2/DLTi3C2-160的TEM图。从图5(a)可以看出,DL-Ti3C2片较薄,具有褶皱的层状结构,由几层Ti3C2Tx片堆叠而成,而且在高压电子束作用下,DL-Ti3C2薄片是稳定的。由于盐酸和氟化锂的混合液比氢氟酸要温和得多,所以制备的MXene薄片中纳米尺寸的缺陷很少,这在氢氟酸刻蚀的样品中是常见的[23]。从选区电子衍射中可以看到明显的六角形衍射花样,表明DL-Ti3C2保持了Ti3AlC2前驱体的六方晶系结构。图5(b)测得的DL-Ti3C2的晶格间距约为1.37 nm,对应Ti3C2Tx的(002)晶面,与图 1(b)的 XRD测试结果一致。DL-Ti3C2在120℃氧化之后表面有明显的纳米颗粒形成,根据纳米颗粒的HRTEM图(图5(d))采用快速傅里叶变换((FFT)计算纳米颗粒的晶格间距为0.35和0.24 nm,分别对应锐钛矿型TiO2的(101)和(103)晶面,说明DL-Ti3C2在120℃氧化后形成了锐钛矿型TiO2晶体。图5(e)显示DL-Ti3C2在160℃氧化后,表面形成的纳米颗粒增多,根据纳米颗粒的HRTEM图(图5(f))采用快速傅里叶变换((FFT)计算纳米颗粒的晶格间距为0.35、0.19和0.17 nm,分别对应锐钛矿型 TiO2的(101)、(200)和(105)晶面。 说明随着氧化温度的升高,DL-Ti3C2的氧化程度加深。

图5 样品的TEM图Fig.5 TEM images of the samples
2.2 样品的拉曼光谱分析

图6 (a)TiO2/DL-Ti3C2-120和(b)TiO2/DL-Ti3C2-160的拉曼光谱Fig.6 Raman spectra of(a)TiO2/DL-Ti3C2-120 and(b)TiO2/DL-Ti3C2-160
图6 为TiO2/DL-Ti3C2-120和TiO2/DL-Ti3C2-160的拉曼光谱, 在 144、198、398、513 和 640 cm-1处的峰,归属于锐钛矿型TiO2,而且随着氧化温度的升高,锐钛矿型TiO2的衍射峰逐渐增强。表明DL-Ti3C2在溶剂热过程中氧化生成了锐钛矿型TiO2,并且随着氧化温度的升高,DL-Ti3C2的氧化程度逐渐加深,生成的TiO2的量逐渐增加。在1 350和1 590 cm-1处的2个峰分别对应于碳的D峰和G峰,D峰代表的是C原子晶格的缺陷,G峰代表的是C原子sp2杂化的面内伸缩振动。当氧化温度为120℃时,两者的强度比值(ID/IG)的值约为0.8,说明DL-Ti3C2在氧化形成了TiO2晶体的同时也形成了无定形碳。当氧化温度升高到160℃时,无定形碳的含量降低,这是因为氧化温度升高使得无定形碳氧化形成一氧化碳或二氧化碳,与文献报道一致[24]。
2.3 样品的XPS谱图分析

图7 样品的XPS谱图Fig.7 XPSspectra of the samples
为了分析DL-Ti3C2在氧化前后化学键的变化,对DL-Ti3C2及其氧化后的样品进行XPS测试,如图7所示。通过比较氧化前后样品的O1s谱图(图7(a,d,g))发现,刻蚀处理得到的DL-Ti3C2表面负载有大量的羟基,但是在氧化之后,O-H键的峰强度减弱,同时Ti-O键的峰强度增强。这是因为DL-Ti3C2在氧化过程中表面形成了TiO2,负载的含氧基团的相对含量减少。从图7(b,e,h)可以看出,随着氧化温度的升高,Ti-C键的Ti2p3/2(454.3 eV)和 Ti2p1/2(460.3 eV)逐渐被 TiO2的 Ti2p3/2(458.9 eV)和 Ti2p1/2(464.7 eV)取代,这说明DL-Ti3C2逐渐被氧化形成了TiO2,且氧化温度越高,DL-Ti3C2的氧化程度越深,形成的锐钛矿型TiO2也越多,但DL-Ti3C2并未被完全氧化,DLTi3C2与TiO2同时存在于复合材料中。从图7(c,f,i)中可以看出,随着氧化温度的升高,DL-Ti3C2的C-Ti(≈281.9 eV)键逐渐转化为 C-O-Ti(288.0 eV)键,这与O1s和Ti2p的谱图结果一致。
2.4 样品的比表面积分析
表1列出了不同温度氧化产物的比表面积,可以看出 DL-Ti3C2的比表面积(SBET)为 45 m2·g-1,相比于文献报道[12]的ML-Ti3C2的比表面积增大了几倍。这主要是因为ML-Ti3C2在剥离形成DL-Ti3C2后,堆积的片层充分暴露出来,使得其比表面积大幅度增加。随着氧化温度的升高,DL-Ti3C2片层表面氧化形成的TiO2纳米颗粒增加,比表面积也就越大。当温度达到180℃时,产物的比表面积开始下降,这可能是因为DL-Ti3C2氧化程度过深,使得部分DL-Ti3C2重新沉积堆叠。

表1 DL-Ti3C2和TiO2/DL-Ti3C2-T的S BETTable 1 S BET of DL-Ti3C2 and TiO2/DL-Ti3C2-T
2.5 样品的紫外-可见漫反射光谱分析
为了研究材料的光吸收性能,对DL-Ti3C2和TiO2/DL-Ti3C2-T进行了紫外-可见漫反射光谱测试。由图8可知,DL-Ti3C2和TiO2/DL-Ti3C2-T在可见光区域吸收强度均较高,相比于紫外区吸收强度明显增加。随着氧化温度的升高,TiO2/DL-Ti3C2对光的吸收能力下降,且吸收边缘略红移。这主要是因为随着氧化温度升高,DL-Ti3C2的含量逐渐降低,而TiO2在可见光区域的吸收与DL-Ti3C2相比低得多,使得复合材料TiO2/DL-Ti3C2对光的吸收强度下降。光照吸收边缘的红移是由于氧化过程形成C-O-Ti键,导致TiO2的带隙变窄,与文献报道一致[11,25-26]。
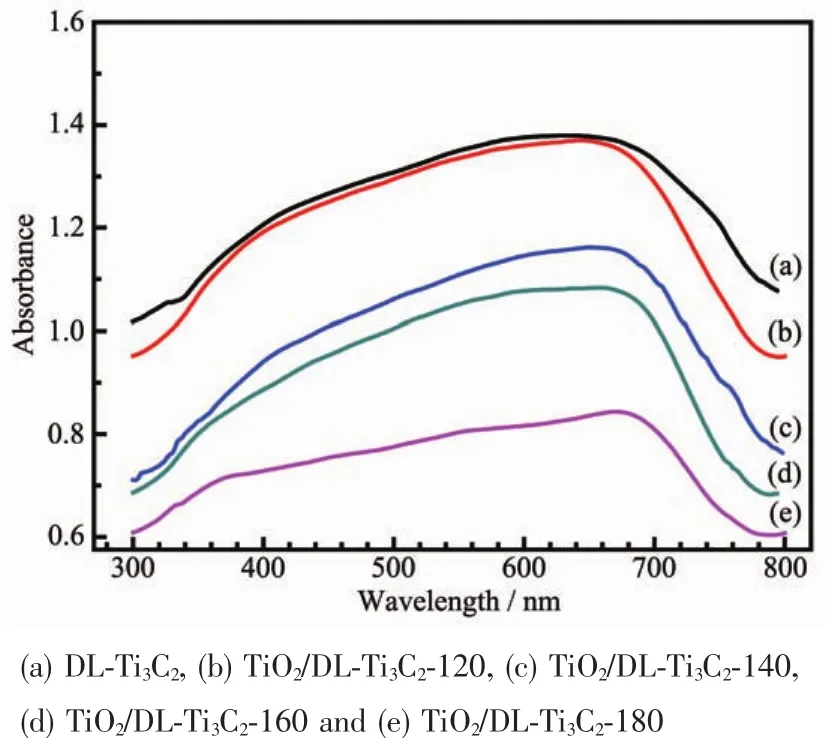
图8 DL-Ti3C2和TiO2/DL-Ti3C2-T的紫外-可见漫反射光谱Fig.8 UV-Vis diffuse reflection spectra and of DL-Ti3C2 and TiO2/DL-Ti3C2-T
2.6 样品的荧光光谱分析
荧光光谱主要由半导体中电子与空穴的复合产生,而电子-空穴对的复合率对催化剂的光催化性能有显著的影响。为了研究电子空穴的复合率,对样品进行了荧光光谱分析。图9为DL-Ti3C2和不同温度氧化制备的TiO2/DL-Ti3C2的荧光光谱。从图中可以看出,TiO2/DL-Ti3C2的发射峰位置几乎没有改变,但随着氧化温度的升高,发射峰强度逐渐增加。表明TiO2/DL-Ti3C2的电子-空穴对复合率随着氧化温度的升高逐渐增加。这是因为高导电性的DL-Ti3C2材料能够促进TiO2光生电子空穴的分离,但随着氧化温度的升高,TiO2/DL-Ti3C2复合材料中TiO2的相对含量增加而DL-Ti3C2的相对含量逐渐降低,会使得材料的导电率下降,光生电子和空穴的复合率升高。

图9 DL-Ti3C2和TiO2/DL-Ti3C2-T的荧光光谱Fig.9 PL spectra of DL-Ti3C2 and TiO2/DL-Ti3C2-T
2.7 光催化结果分析
图 10 为 DL-Ti3C2、TiO2/DL-Ti3C2-T、P25 以及不加催化剂时对罗丹明B溶液的脱除率曲线。由图可知,在不加催化剂时,光照下罗丹明B溶液基本没有降解。DL-Ti3C2在低温下经过溶剂热氧化处理之后,光催化性能得到了明显提高。随着氧化温度的升高,TiO2/DL-Ti3C2的光催化性能增强,当氧化温度为160℃时,光催化活性达到最高,对罗丹明B溶液的降解率达到了93.1%。TiO2/DL-Ti3C2-160降解罗丹明B溶液的UV-Vis光谱如图11所示,随着光照时间的延长,罗丹明B溶液的吸收光谱强度逐渐下降,表明罗丹明B在可见光下发生了降解反应,其浓度逐渐降低。并且罗丹明B在降解过程中的最大吸收峰波长并未发生改变,始终在554 nm左右,表明罗丹明B在降解过程中完全矿化,没有生成中间产物。且图10表明,TiO2/DL-Ti3C2-160的光催化性能明显优于P25。这是因为随着氧化温度的升高,形成的TiO2量增加,光照下产生的电子-空穴对数量增加;而DLTi3C2具有优良的电子导电性和较大的比表面积,使得光生电子更容易被转移,抑制了光生电子与空穴的复合,从而提高了复合材料的光催化性能。

图 10 DL-Ti3C2、TiO2/DL-Ti3C2-T、P25 和不加催化剂时对罗丹明B溶液的脱除率曲线Fig.10 Photodegradation rate for rhodamine B on DL-Ti3C2,TiO2/DL-Ti3C2-T,P25 and no catalyst
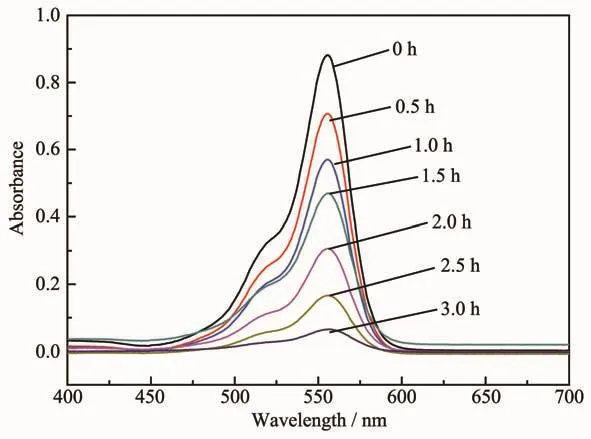
图11 TiO2/DL-Ti3C2-160降解罗丹明B溶液的UV-Vis光谱Fig.11 UV-Vis spectra of rhodamine B solution degraded by TiO2/DL-Ti3C2-160
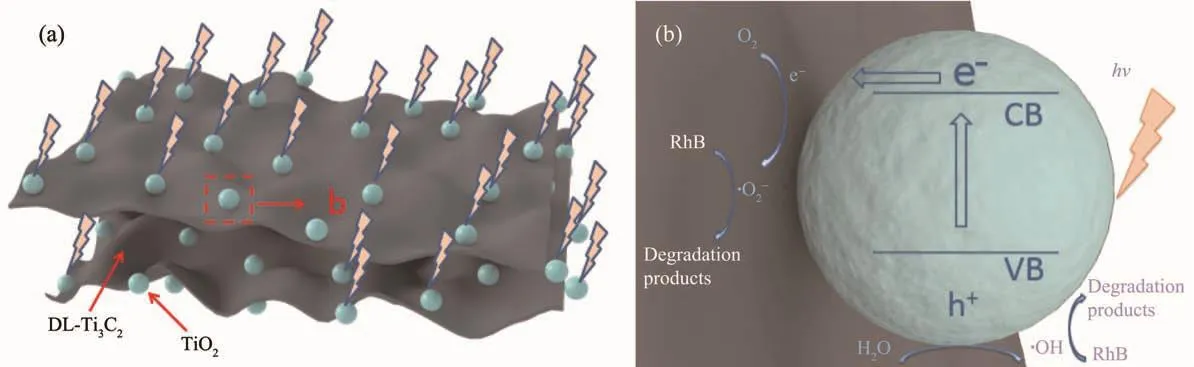
图12 TiO2/DL-Ti3C2复合材料光催化降解罗丹明B溶液机理示意图Fig.12 Mechanism diagram of photocatalytic degradation for rhodamine Bsolution by TiO2/DL-Ti3C2 composite
TiO2/DL-Ti3C2复合材料光催化降解罗丹明B溶液的机理示意图如图12所示。TiO2/DL-Ti3C2在光照后,TiO2的价带电子受激发跃迁到导带,产生光生电子-空穴对,而DL-Ti3C2的高导电性使得TiO2导带上的光生电子快速传输至DL-Ti3C2的表面,促进了光生电子和空穴的分离。之后,光生电子与催化剂表面吸附的氧作用形成超氧负离子(·O2-),空穴与催化剂表面的羟基和水分子作用形成羟基自由基(·OH),·O2-和·OH因其强氧化性能够有效降解罗丹明B分子。但是随着温度进一步升高,TiO2/DL-Ti3C2复合材料的光催化性能开始下降。这是因为高温下生成TiO2含量的增加虽然有利于光生电子和空穴的生成,但是DL-Ti3C2的氧化程度过深使其电子电导性降低,光生电子与空穴的复合率升高,导致TiO2/DLTi3C2复合材料光催化性能反而降低。所以,DL-Ti3C2和TiO2的协同作用对于提高光催化活性至关重要。因此,提高TiO2/DL-Ti3C2复合材料光催化性能的关键是通过控制氧化温度来调节TiO2/DL-Ti3C2复合材料中DL-Ti3C2和TiO2的相对含量。
3 结 论
采用溶剂热法控制氧化DL-Ti3C2制备了TiO2/DL-Ti3C2复合光催化剂,并以罗丹明B溶液为目标污染物,在可见光条件下测试TiO2/DL-Ti3C2复合材料的光催化活性。结果表明,在溶剂热反应过程中,DL-Ti3C2逐渐氧化形成TiO2纳米颗粒。随着溶剂热反应温度的升高,生成的TiO2纳米颗粒增加。TiO2/DL-Ti3C2复合光催化剂对可见光响应且光催化性能明显优于DL-Ti3C2,当氧化温度为160℃时,TiO2/DL-Ti3C2-160对于罗丹明B溶液的光催化解率达到最高,约为93.1%。这主要是因为,在TiO2/DL-Ti3C2复合材料中,作为光催化剂主体的TiO2在光照下产生光生电子和空穴,而DL-Ti3C2由于其良好的导电性、高的比表面积和丰富的表面含氧基团,促进了污染物在复合材料表面的吸附,加速了TiO2导带所生成的光生电子的转移,提高了光生电子-空穴的分离效率。此外,DL-Ti3C2原位氧化生成TiO2的同时,形成C-O-Ti键,使TiO2的带隙变窄,有利于提高TiO2对可见光的吸收和利用。因此,可以通过控制氧化温度来调节Ti3C2/DL-TiO2复合材料中DL-Ti3C2和TiO2的相对含量,使二者协同作用以提高TiO2/DLTi3C2复合光催化剂的性能。
