高容量梯度锂离子电池正极材料Li[Ni0.85Co0.08Mn0.07]O2的制备
2019-07-10胡国荣黄金龙曹雁冰彭忠东
胡国荣 黄金龙 杜 柯 曹雁冰 彭忠东
(中南大学冶金与环境学院,长沙 410083)
0 引 言
镍酸锂正极材料电极材料由于其具有高容量一直备受关注,但较差的电化学稳定性影响了其工业应用[1-4]。为了改善其性能,很多研究者采用钴、锰、铝对镍酸锂进行掺杂改性[5-11],研究发现钴的引入能减少材料中的阳离子混排,明显改善LiNiO2层状六方结构的稳定性[12];A13+由于没有电化学活性,能降低Li+的脱嵌程度,限制其充电电压,从而提高循环性能[13];锰元素的 加入也能提高LiNiO2结构的稳定性[14-15]。其中,Li[Ni0.8Co0.15Al0.05]O2被认为是目前最热的镍基复合材料之一[16-20]。尽管镍基复合材料的电化学性能和热力学稳定性有所提高,但其循环性能和倍率性能以及安全性能仍未得到本质性的解决,尤其是它的高温性能[21-22]。其中最有效果的措施之一便是对其进行表面包覆,采用具有电化学活性的正极材料 如 LiCoO2、Li[Ni0.5Mn0.5O2][23-26]、Li[Ni1/3Co1/3Mn1/3]O2[27-28]作为包覆材料,在一定程度上能改善包覆材料与被包覆材料之间的晶格匹配性问题。同时,此类材料比高镍材料要稳定,电化学性能特别是循环稳定性均比高镍材料要好,这些包覆材料的引入并不会明显降低材料的活性物质比重,因此具有明显的研究价值。2005年,以韩国Sun为代表的研究工者把包覆概念扩展到核壳,合成了具有核壳结构特点的镍基正极材料Li[(Ni0.8Co0.1Mn0.1)1-x(Ni0.5Mn0.5)x]O2[23-24]。 该材料以高镍含量的Li[Ni0.8Co0.1Mn0.1]O2材料为核,以保持其高容量;以低镍含量的Li[Ni0.5Mn0.5]O2为壳,以保持其循环稳定性。但由于该材料内核材料与外壳材料的结构和成分仍有较大的差异,使得该复合材料在烧结时还是出现了外壳脱落的情况。而韩国Sun等[29]于2009年提出了镍基梯度材料Li[Ni0.68Co0.18Mn0.18]O2,该材料以Li[Ni0.8Co0.1Mn0.1]O2为核、以Li[Ni0.46Co0.23Mn0.31]O2为壳,中间为梯度变化过渡层,在3.0~4.4 V充放电范围,55℃高温下,首次放电比容量可达209 mAh·g-1,50次循环容量可保持96%。梯度材料以其优越的性能引起了很多研究工作者的极大兴趣,并在最近几年掀起一股研究热潮。随着新能源汽车市场的不断发展和壮大,续航里程和电池寿命是制约其应用的关键因素,一大批工作者开始研发镍含量更高的锂离子电池体系。
本文将主流的镍含量提高到0.85,同时采用梯度沉积的方法,在保证更高能量的前提下,又能提高材料的稳定性能。采用连续控制结晶法,通过改变金属离子的浓度比例,梯度沉积镍钴锰的氢氧化物,制备出金属元素梯度连续变化前驱体[Ni0.85Co0.08Mn0.07](OH)2。再与LiOH·H2O混合,通过高温固相法得到新型镍基梯度复合材料Li[Ni0.85Co0.08Mn0.07]O2。考察了其电化学循环、倍率性能,并用XRD对其结构进行了分析,用SEM考察了其形貌,通过切面分析了其元素的梯度变化情况。
1 实验部分
1.1 前驱体的合成及正极材料的制备
以化学纯的 NiSO4·6H2O 配制 1.5 mol·L-1的NiSO4溶液;以 NiSO4·6H2O、CoSO4·7H2O 和 MnSO4·H2O配制混合离子溶液,其中Ni2+、Co2+、Mn2+离子的浓度分别为 0.5、0.9、0.9 mol·L-1。同时配制浓度为 3 mol·L-1的 NaOH 溶液和 0.5 mol·L-1的 NH3.H2O 溶液。先将NiSO4、NaOH和NH3·H2O三种溶液通过剂量泵同时输入反应釜中,同时将镍钴锰混合离子溶液连续输入NiSO4溶液中并进行搅拌混匀,保持反应温度为50℃且连续搅拌,使用pH计控制反应处于pH=11.5。控制加料速度,使得所有滴加溶液同时消耗完毕,待溶液滴加完毕后,陈化4 h。把反应得到的沉淀产物经去离子水洗涤3次。过滤后放在60℃的恒温烘箱中干燥24 h,最终得到镍钴锰混合离子氢氧化物前驱体。经ICP分析表明3种金属元素的原子比 nNi∶nCo∶nMn=0.850 52∶0.080 17∶0.069 31。根据分析数据计算可知,分子式可写为Ni0.85Co0.08Mn0.07(OH)2,此为梯度正极材料的前驱体。
同时,配制 NiSO4·6H2O、CoSO4·7H2O 和 MnSO4·H2O 混合离子溶液,其中 Ni2+、Co2+、Mn2+离子的浓度分别为 1、0.095、0.083 mol·L-1,将该混合离子溶液、NaOH和NH3·H2O三种溶液通过剂量泵同时输入反应釜中,以同样的反应条件和实验步骤得到纯相的氢氧化物前驱体。经ICP分析表明3种金属元素的原子比 nNi∶nCo∶nMn=0.851 89∶0.081 32∶0.068 63。 根据分析数据计算可知,分子式可写为Ni0.85Co0.08Mn0.07(OH)2,此为均相对比材料的前驱体。
按物质的量之比1.03∶1称取LiOH·H2O和上述前驱体,混合均匀,于马弗炉中550℃预烧4 h,然后转移到O2气流保护的管式炉中750℃焙烧12 h,自然冷却后研磨,过筛(200目)分别得到梯度正极材料和纯相对比材料Li[Ni0.85Co0.08Mn0.07]O2。
1.2 材料的分析和表征
本实验使用的X射线粉末衍射仪为日本理学Rigaku D/max 2550VB+18 KW转靶X射线衍射仪:Cu Kα1辐射(λ=0.154 06 nm),管电流 100 mA,管电压 40 kV,扫描速度 5°·min-1,扫描范围 2θ=10°~90°。采用JSM6360 LV型号扫描电子显微镜(SEM,日本JEOL公司)观察样品的表面形貌(工作电压30 kV)。通过控制结晶得到的镍基复合前驱体以及烧结的成品导电性好,可得到清晰的SEM成像图。为了观察材料的切面元素分布情况,将成品或前驱体分别加入高温下的聚酰胺树脂(AB胶)和环氧树脂混合液,制备成柱状固体树脂,采用金相砂磨机抛光得到切面试样,再对切面试样进行扫描电镜分析。采用电感耦合等离子体质谱法(ICP)测定元素含量。振实密度测定采用FZS4-4B型振实密度测试仪器 (北京钢铁研究院产),通过记录1 000次震动后材料所剩余质量与体积的比值,即为材料的振实密度。差热分析采用CFS-Ⅱ型热分析仪(日本产)对经配锂后的镍基前驱体进行分析测试,升温的速率为10℃·min-1,温度范围为25~810℃,控制气氛为O2。
1.3 材料的电化学性能测试
将镍基正极活性物质、聚偏氟乙烯(PVDF)和乙炔黑按质量比8∶1∶1混合均匀,加入N-甲基吡咯烷酮(NMP)制备成浆状物,然后均匀涂于铝箔上。烘干后冲孔得到圆形正极片。以金属锂片作为负极,以LiPF6(1 mol·L-1)的碳酸乙烯酯 (EC)+碳酸二甲酯(DMC)溶液为电解液(EC和DMC的体积比为1∶1),使用聚丙烯微孔隔膜(Celgard 2400),在真空手套箱中组装成CR2025扣式电池。用LAND电化学测试仪对其进行电化学性能测试,实验中镍基材料的电化学测试温度为常温25℃(高温为55℃),充放电压区间主要为 2.8~4.3 V,电流密度 1C=180 mA·g-1。采用上海辰华CHI760A电化学工作站进行循环伏安(CV)和交流阻抗(EIS)测试。交流阻抗测试的频率范围为 10 mHz~100 kHz,扰动电位为 10 mV。
2 结果与讨论
2.1 X射线衍射分析
图1的XRD图表明Li[Ni0.85Co0.08Mn0.07]O2梯度材料的晶格类型和纯相Li[Ni0.92Co0.08Mn0.07]O2接近,无明显杂相峰,属于空间群为R3m的六方α-NaFeO2结构。表1中两者的晶格参数表明梯度Li[Ni0.85Co0.08Mn0.07]O2具有更高的c/a值及I(003)/I(104)值,说明该梯度材料阳离子混排程度较低,有一个更好的层状结构,这有利于提高材料的电化学性能[30-31]。
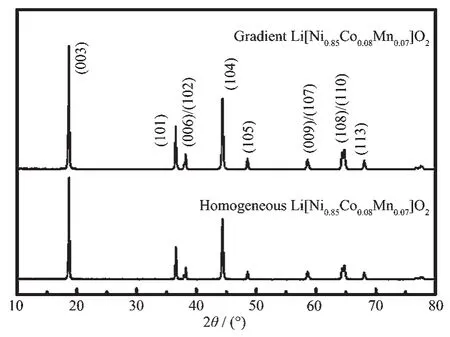
图1 梯度和纯相Li[Ni0.85Co0.08Mn0.07]O2的XRD图Fig.1 XRD patterns of gradient and homogeneous Li[Ni0.85Co0.08Mn0.07]O2
2.2 形貌分析
图2 是前驱体[Ni0.85Co0.08Mn0.07](OH)2在不同放大倍数下的扫描电镜图,前驱体形貌呈很规整的球形,粒径分布比较集中,颗粒直径主要分布在11.5~12 μm,由微小的屑状一次颗粒团聚成型,从大倍率电镜图中能看出球形表面比较粗糙。造成屑状一次颗粒的形成和表面粗糙的原因除了受实际反应条件的控制外,更主要是由于锰的加入改变了溶液的环境。球形颗粒轮廓比较清晰,基本上没有团聚现象,流动性好。同时,前驱体无单独形核的细小颗粒,说明较易单独形核的锰元素按设计方案均匀的沉在前驱体表面。
图3是梯度前驱体经配锂烧结后形成的成品Li[Ni0.85Co0.08Mn0.07]O2在不同放大倍率下的SEM图,且经测定成品的振实密度为2.4 g·cm-3。从图中可知,烧结后材料保持了较好的球形度,且锂源加入后并没有粉状颗粒夹杂其中,说明加入的锂都较好的融入球形颗粒中。烧结后的成品材料比较光滑,比表面积变小。图3d表明烧结后材料一次颗粒长大成块状,粗糙状表面由于块状颗粒相互融合变地更加平整,这有利于后续加工,特别是有利于在涂布环节不掉粉。同时这种表面形貌的结构使得该材料有较大的活性比表面,有利于充放电过程中的锂离子的嵌入和脱出。

表1 纯相和梯度Li[Ni0.85Co0.08Mn0.07]O2的晶格参数Table 1 Lattice parameters of gradient and homogeneous Li[Ni0.85Co0.08Mn0.07]O2

图2 梯度前驱体[Ni0.85Co0.08Mn0.07](OH)2在不同放大倍数下的SEM图Fig.2 SEM images of gradient precursor[Ni0.85Co0.08Mn0.07](OH)2 at different magnifications

图3 梯度Li[Ni0.85Co0.08Mn0.07]O2在不同放大倍数下的SEM图Fig.3 SEM images of gradient Li[Ni0.85Co0.08Mn0.07]O2 at different magnifications
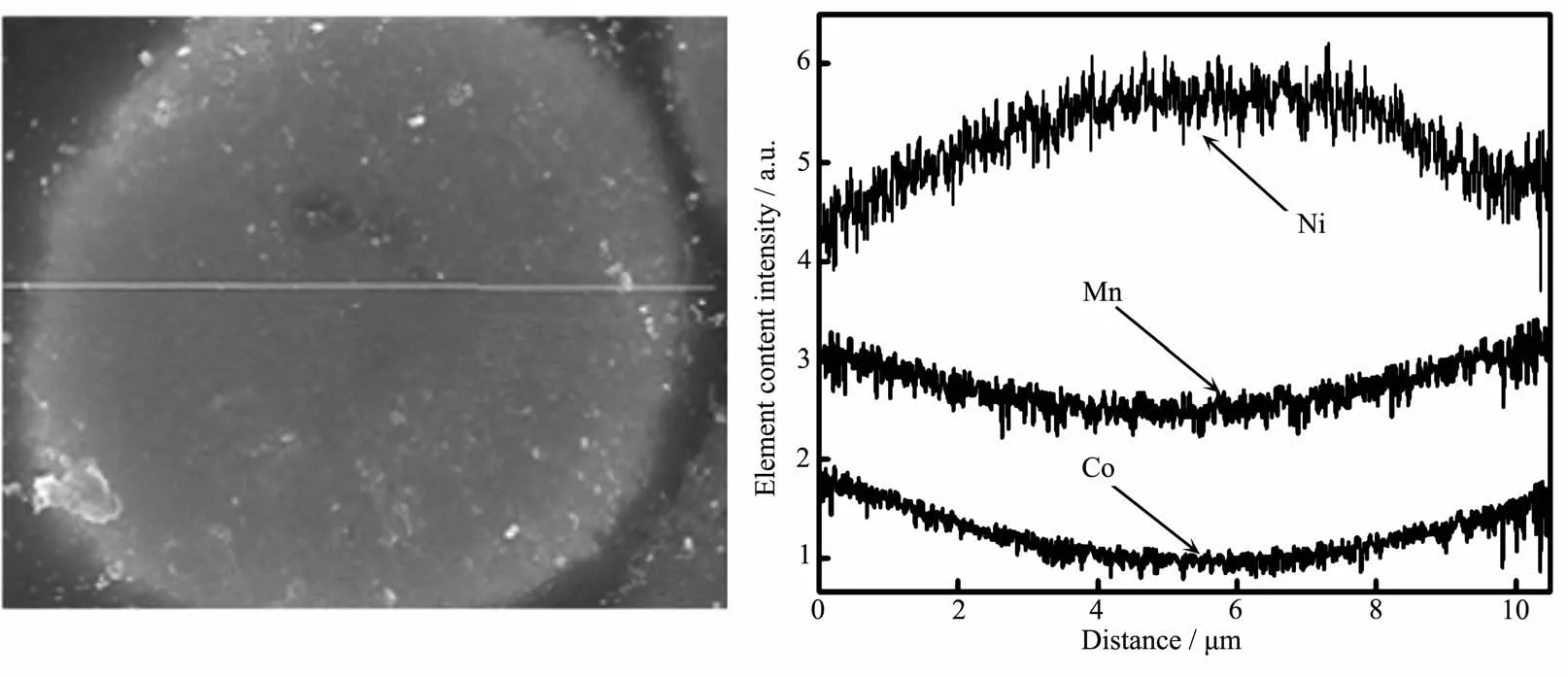
图4 主金属元素沿着梯度Li[Ni0.85Co0.08Mn0.07]O2颗粒直径方向的线扫描元素分布图Fig.4 Line scan element distribution of the main metal element along the diameter of the gradient Li[Ni0.85Co0.08Mn0.07]O2
图4 是材料的镍钴锰元素沿着成品颗粒直径方向的线扫描元素分布图结果,该图展示了Ni、Co、Mn三种元素的分布情况。沿着球径方向从球心到外壳,镍含量越来越低,而钴锰的含量越来越高。越靠近颗粒表面,镍的含量越低,而钴锰的含量越高,这与最初的设计一致,也是全梯度变化的重要依据之一。镍的高含量能保证材料的高容量,而锰的高含量能提高材料的稳定性和安全性能。
2.3 烧结工艺的考察
梯度材料Li[Ni0.85Co0.08Mn0.07]O2属于新型的镍基复合材料,其烧结工艺和普通镍基二元材料可能具有差异性,本实验主要考察了烧结温度和配锂量对材料电化学性能的影响,以期优化材料的烧结工艺,使电化学等性能达到设计值。
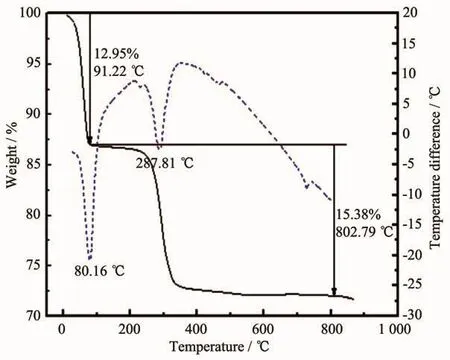
图5 [Ni0.85Co0.08Mn0.07](OH)2与LiOH·H2O混合物的TG/DTA曲线图Fig.5 TG/DTA curves of the mixture of[Ni0.85Co0.08Mn0.07](OH)2 and LiOH·H2O
图5 为前驱体[Ni0.85Co0.08Mn0.07](OH)2与 LiOH·H2O混合物(两者物质的量之比为1∶1.05)的TG/DTA(热重分析-差热分析法)曲线图。DTA曲线在测试温度范围内可分为脱水和分解2个过程,其中脱水失重为12.95%,分解成氧化物和微反应的过程失重为15.38%。这2个过程中的DTA曲线都出现了吸热峰,在80.16℃附近主要是由于前驱体中的水分挥发和发生部分反应而吸热的缘故;在287.81℃左右,前驱体吸收了大量的热,此阶段是前驱体[Ni0.85Co0.08Mn0.07](OH)2的分解阶段,分解生成预氧化物的过程。从TG曲线可以看出,曲线在温度大于550℃后基本不失重,从600℃开始趋于平缓,说明此时材料稳定不再分解。因此选择550℃作为实验的预处理温度,选择大于700℃的温度作为合成Li[Ni0.85Co0.08Mn0.07]O2的烧结温度,并考察了具体的烧结温度等条件对电化学等性能的影响,以优化烧结工艺。
图6为不同烧结温度下制备的梯度Li[Ni0.85Co0.08Mn0.07]O2的充放电循环图,循环倍率为1C,电压区间为2.8~4.3 V,锂和金属离子物质的量比值为1.05。如图所示,700、750和800℃煅烧温度下制备的材料首次放电比容量分别为175.7、186.3和204.7 mAh·g-1。煅烧温度为800℃时制备的材料的首次放电比容量最高,但其充放电循环稳定性不如700和750℃时制备的材料;700℃制备的材料的首次充放电比容量比较低,循环性能较好,100次循环后容量保持率为82.69%。750℃制备的材料首次放电比容量低于800℃时制备的材料,但其充放电循环性最好,循环100次容量保持率为90.76%,而800℃制备的材料循环100次容量保持率为74.20%。以上分析说明合成温度低时材料的电化学容量得不到最大程度的发挥,随着温度的升高,材料的结构将变得更加完整,有利于性能的提高,但温度过高会导致锂的挥发和高价镍的还原,使材料的电化学性能变差。因此,实验中采用750℃作为实验的烧结温度。
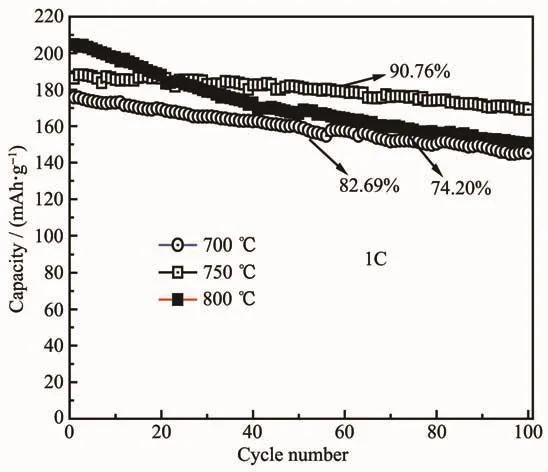
图6 不同烧结温度下梯度Li[Ni0.85Co0.08Mn0.07]O2在1C倍率下的循环性能Fig.6 Cycle performance of gradient Li[Ni0.85Co0.08Mn0.07]O2 at different sintering temperatures at 1Crate

图7 在1C倍率下不同锂和金属离子物质的量比值的条件下制备的梯度Li[Ni0.85Co0.08Mn0.07]O2的循环性能Fig.7 Cycle performance of gradient Li[Ni0.85Co0.08Mn0.07]O2 with different molar radios of Li and metal ions at 1Crate
锂和金属离子物质的量之比在工业化生产中对材料的电化学性能也起到了很重要的作用,锂也占成品材料成本的很大一部分,因此,锂和金属离子物质的量比值也是实验中应该考察的一个重要参数。图7为不同锂和金属离子物质的量比值(1.00、1.03、1.05和1.10)制备的Li[Ni0.85Co0.08Mn0.07]O2正极材料的循环曲线图。如图所示,在1C充放电倍率下,比值为1.00、1.03、1.05和1.10的材料首次放电比容量分别为 166.9、184.1、187.2 和 197.9 mAh·g-1,可知随着配锂量的不断增加,材料的首次放电比容量也在不断增加。说明一定量锂的加入,可以有效发挥材料的放电比容量的释放效果。从循环性能上看,材料的容量保持率会随着配锂量的增加而减小;另外,由于实验所使用的为氢氧化锂,过多的锂源会增加材料的碱性,在储存过程中易吸水,不利于材料后期的加工和涂覆,对电解液也会造成影响。50次循环结束时,比值为1.00的材料放电比容量最低,其它比例的放电比容量比较接近。综上所述,锂和金属离子物质的量比值为1.03时材料的电化学性能最好。
2.4 充放电截止电压范围的影响
实验中考察了Li[Ni0.85Co0.08Mn0.07]O2分别在2.8~4.5、2.8~4.3以及3.0~4.2 V的电压范围内的循环性能测试。从图8中能看出,材料在3.0~4.2 V的首次放电比容量最低,为170.3 mAh·g-1,当电压放宽到2.8~4.3 V, 首次放电比容量增加到 184.7 mAh·g-1,材料在2.8~4.5 V的首次放电比容量最高,可达202.7 mAh·g-1。由此可见,随着电压的放宽,材料的容量保持率逐渐下降,3.0~4.2、2.8~4.3 和 2.8~4.5 V的容量保持率依次为92.30%、89.17%和82.88%。这是因为充电电压升高时,更多的Li脱出材料晶格会使更多的相变情况出现,使得材料晶体结构稳定性下降,导致可嵌脱锂位减少,从而引起容量下降,同时高的截止电压会使电解液加速反应,使锂在传输的过程中遇到阻碍,导致容量衰减加快[32]。因此,选择容量和循环保持率较好的2.8~4.3 V的电压范围作为电化学考察电压范围。
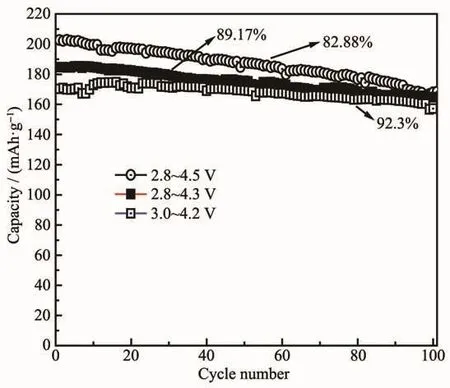
图8 梯度Li[Ni0.85Co0.08Mn0.07]O2在不同电压区间的循环性能Fig.8 Cycle performance of gradient Li[Ni0.85Co0.08Mn0.07]O2 in different voltage ranges at 1Crate
2.5 电化学性能测试
图9 为梯度和纯相Li[Ni0.85Co0.08Mn0.07]O2的首次充放电曲线的对比图,电压范围为2.8~4.3 V。全梯度材料的首次放电效率为89.8%,放电中值电压为3.81 V,Li[Ni0.85Co0.08Mn0.07]O2首次放电比容量高达204.0 mAh·g-1,略低于纯相材料的首次放电比容量(206.4 mAh·g-1)。从图中可看出,材料的首次充放电曲线呈现3个放电平台,可以认为与锂离子电池嵌入和脱出有关的相关。全梯度成品材料的首次放电过程电压平台差值比纯相要低,显示极化较小,有利于更好的电化学性能体现。
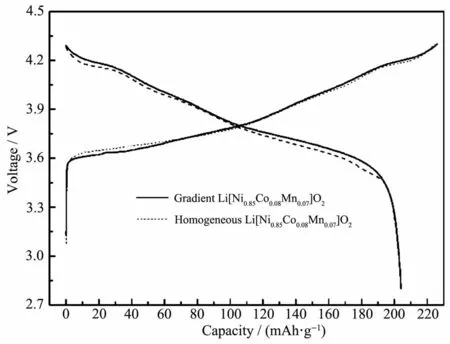
图9 梯度和纯相Li[Ni0.85Co0.08Mn0.07]O2在0.1C倍率下首次充放电曲线Fig.9 First charge-discharge curves of gradient and homogeneous Li[Ni0.85Co0.08Mn0.07]O2 at 0.1Crate
图10 展示了在25℃环境下,梯度和纯相Li[Ni0.85Co0.08Mn0.07]O2在2.8~4.3 V充放电范围内的倍率性能。从图中可以看出,当环境温度为25℃时,梯度材料在 0.1C、0.2C、0.5C、1C、2C 的放电倍率下的放电比容量分别达到 209.4、200.4、190.0、182.9 和172.4 mAh·g-1,经过较大倍率放电后,返回0.1C时仍能达到200.6 mAh·g-1以上;纯相材料在0.1C、0.2C、0.5C、1C、2C 放电倍率下可分别达到 211.2、198.4、184.7、177.6 和 180 mAh·g-1,显示出了较好的放电倍率性能。经过较大倍率放电后,返回0.1C后放电该材料仍能达到192.7 mAh·g-1以上。在经大倍率循环返回小倍率放电后,梯度材料能保持损失量较少的放电比容量,说明材料在经高倍率放电后,梯度材料因电化学反应而损耗的容量较少,其可逆性很好。

图10 梯度与纯相Li[Ni0.85Co0.08Mn0.07]O2的倍率性能Fig.10 Rate performance of gradient and homogeneous Li[Ni0.85Co0.08Mn0.07]O2
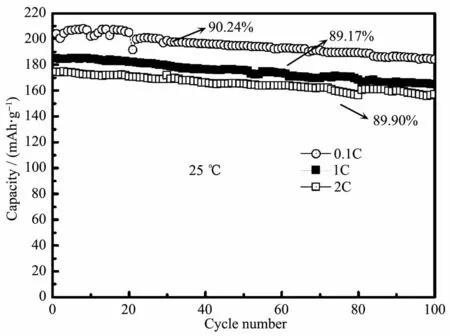
图11 梯度Li[Ni0.85Co0.08Mn0.07]O2在不同倍率下的放电循环性能Fig.11 Discharge cycle performance of gradient Li[Ni0.85Co0.08Mn0.07]O2 at different rates
图11 为25℃环境下,梯度Li[Ni0.85Co0.08Mn0.07]O2在2.8~4.3 V充放电范围内,0.1C、1C和2C的倍率下的循环图。在室温下,在0.1C、1C和2C的倍率下首次放电比容量分别可达204.3、185.3、174.4 mAh·g-1,100 次循环后分别仍有 184.1、164.7、156.8 mAh·g-1,容量保持率分别为90.24%、89.17%、89.9%。
图12为室温25℃和高温55℃环境下,梯度和纯相Li[Ni0.85Co0.08Mn0.07]O2在2.8~4.3 V充放电范围内,1C倍率下的循环曲线对比图。在25℃环境下,梯度材料在1C倍率下的首次放电比容量可达184.7 mAh·g-1,100 次循环后仍有 164.6 mAh·g-1,容量保持率为89.17%,循环效果均好于纯相材料Li[Ni0.85Co0.08Mn0.07]O2(首次放电比容量为185.7 mAh·g-1, 循环 100 次后为 155 mAh·g-1,83.47%的容量保持率)。在高温55℃环境下,1C首次放电比容量可达 202.7 mAh·g-1,100 次循环后仍可达 174 mAh·g-1,容量保持率为85.84%,循环效果均好于纯相材料(首次放电比容量为201.2 mAh·g-1,循环100次后为 162.6 mAh·g-1,80.82%的容量保持率)。高的放电容量、优秀的循环性能和较好的高温性能显然是来自于材料的特殊结构,通过镍钴锰3种元素的连续逐渐的变化,使得整个材料并不存在包覆层脱落的情况,从而使材料在充放电过程中产生的晶格应力得到很好的缓慢释放。

图12 不同温度下梯度和纯相Li[Ni0.85Co0.08Mn0.07]O2在1C倍率下的循环性能Fig.12 Discharge cycle performance of gradient and homogeneous Li[Ni0.85Co0.08Mn0.07]O2 for different temperatures at 1Crate
锂离子电池中锂的交互作用过程可看成是一个等效电路模型。图13是梯度和纯相Li[Ni0.85Co0.08Mn0.07]O2在循环前和100次循环后的电化学阻抗图谱及对应的等效电路图。在该图中,高频到中频半圆对应的是锂离子在电池材料表面膜通过时产生的阻抗(Rsf)。中频到高频的半圆则对应电极与电解液的电荷转移阻抗(Rct)。Rs是电解液电阻,Zw是锂离子在电极活性材料中的扩散阻抗,CPE是恒相位元件,通常每个介面都会形成一个电容。从图中可以看出,梯度和纯相材料循环前的Rct分别为46.36和47.53 Ω,两者相差不大。随着在1C倍率下循环次数增加到100次后,可以明显地看到两者Rct的增加,纯相对比材料的Rct值 (406.69Ω)明显高于梯度材料(363.73Ω)。这有可能是因为梯度材料的特殊结构使得材料表面镍含量较低,减少了电解质和材料发生的一系列表面副反应,在充电状态下,强氧化性的Ni4+含量较少,从而使其脱嵌锂的过程在后续循环中具有比纯相材料具有一个更稳定的结构。
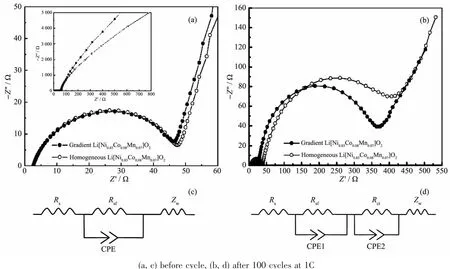
图13 梯度和纯相Li[Ni0.85Co0.08Mn0.07]O2的(a,b)Nyquist曲线及(c,d)对应的等效电路图Fig.13 (a,b)Nyquist plots and(c,d)corresponding equivalent circuit diagrams of gradient and homogeneous Li[Ni0.85Co0.08Mn0.07]O2
3 结 论
通过改变金属离子的浓度比例,采用连续控制结晶法制备出镍钴锰金属元素梯度连续变化的前驱体[Ni0.85Co0.08Mn0.07](OH)2。再与LiOH·H2O混合,通过高温固相法得到新型镍基复合材料Li[Ni0.85Co0.08Mn0.07]O2。结果表明,该材料切面元素显梯度变化,有更好的层状结构[33],在烧结温度750℃时,锂和金属离子的物质的量比值为1.03的较佳烧结条件下,1C放电倍率下的首次放电比容量为185.3 mAh·g-1,循环 100 次后,仍有 164.7 mAh·g-1,容量保持率达89.17%,体现了较好的倍率性能和高温性能,符合新一代锂离子电池正极材料的要求。
