Fe3O4@mMoO3介孔多功能纳米载体的制备及其微波响应药物传递
2019-07-10刘诗诗彭红霞胡继林贺爱兰陈占军彭秧锡
刘诗诗 彭红霞*,,2 胡继林 贺爱兰 陈占军 彭秧锡
(1精细陶瓷与粉体材料湖南省重点实验室,湖南人文科技学院,材料与环境工程学院,娄底 417000)(2中南大学材料科学与工程学院,长沙 410000)
0 引 言
癌症是导致人类死亡的疾病之一[1-2]。目前治疗癌症的主要方法有手术、放疗、化疗、光动力疗法和热疗法等[3]。其中,最为广泛的化疗存在着严重的毒副作用[4]。因此,国际上提出了通过组装制备兼具靶向和可控释放药物的多功能无机纳米载体,提高化疗药物的利用率,降低毒副作用,从而达到增强治疗效果的目的[5]。
目前已报道的可控释放方式主要包括利用温度、氧化还原剂、酶的活性和生物分子等来控制。其中,温度控制药物释放备受关注,主要归因于它不依赖于病变组织中特定化学环境的变化,一般病变组织的温度比正常组织温度要高[6-7]。另外,也可以人为的通过某种外界手段使病变部位的温度提高。因此通过温度的变化来控制药物的释放成为一个重要的研究方向。而与光和交变磁场诱导加热相比,微波加热具有加热速度快、穿透性好、无脂肪过热现象等优点。此外,还可以通过改变微波频率、功率密度、工作周期和辐射时间来准确有效地控制载体上药物释放的时间和剂量[8]。
近年来,研究人员发现磁性纳米颗粒和微波吸收纳米颗粒复合的新“二合一”双功能纳米颗粒因为在一个实体里同时具有独特的磁性和微波热转化特性2种性质。因此,其作为药物载体不仅可以通过外部磁场操纵实现靶向肿瘤部位,还可以利用微波加热刺激实现药物的可控释放。该特性在精准化疗应用中有着至关重要的作用。其中,利用磁性Fe3O4的大磁矩、高弛豫效能、低毒性、低成本等优点[9],以及金属氧化物微波吸收材料(MOn)的局部加热迅速、对生物组织的穿透性好、安全性高、易于控制、独特的微波吸收性能、良好的微波热响应特性和生物毒性低等特性[10-11],设计、合成磁-微波吸收双功能复合纳米材料成为当前研究的热点。例如,文献[12]报道了用沉淀法制备Fe3O4@ZnO@mSiO2核壳结构的双功能纳米颗粒,通过磁场引导药物直达患处,在微波刺激下进行药物释放,稳于患处。本课题组也成功制备了Fe3O4@MoO3@mSiO2用于药物载体的纳米复合颗粒[13]。但是,该类的复合材料存在明显的不足,如制备过程复杂、成本高等,最为主要的是由于mSiO2非磁性壳层的存在而大大减弱了其磁性和微波热响应性。
针对这个问题,拟在Fe3O4表面直接包覆介孔结构的金属氧化物微波吸收材料壳层,构建一种介孔结构,磁性靶向,微波加热控制定时定量释放药物的新型无机纳米载体,以提高抗肿瘤药物的治疗效果,同时还可以降低抗肿瘤药物对人体正常细胞的毒副作用。
氧化钼(MoO3)纳米材料具有优异的微波热响应特性,它可以吸收一定频率的微波并将其转化为热能用于加热纳米载体进而刺激药物的可控释放[14-15]。此外,根据其细胞毒性和体内毒性评价结果可知MoO3纳米粒子具有低毒性和较好的生物相容性等特点[16]。Fe3O4是一种良好的介质损耗型微波吸收材料,通过将介孔结构MoO3沉积到Fe3O4纳米粒子表面以平衡材料的复磁导率和介电常数,降低自由空间中微波吸收剂的阻抗匹配难度[17],提高其微波吸收性,同时赋予介孔壳层高的孔隙率,大的表面积,从而可以得到兼具磁性、强微波吸收性,独特微波热转换特性和高负载药物能力的新型纳米载体。
基于以上研究现状,拟构建一种新型核壳结构的Fe3O4@mMoO3磁-吸波介孔多功能纳米载体,即把磁性Fe3O4和具有微波吸收性能的负载药物的介孔MoO3纳米颗粒结合,得到具有磁性靶向、在微波加热控制下可以定时定量释放药物的新型无机纳米载体。以布洛芬为模板药物,通过微波辐射响应来研究药物的可控释放。另外,并对其结构、形貌进行了研究。
1 实验部分
1.1 试剂与表征
实验药品均为分析纯,无需进一步纯化。醋酸钠(C2H5COONa,99.0%)购于衡阳市凯信化工试剂有限公司;三氯化铁(FeCl3·6H2O,99.0%)、乙二醇((CH2OH)2,96.0%)购于北京朝阳区通惠化工厂;钼酸铵((NH4)2MoO4,54.0%)、 聚乙二醇 (分子量 6 000)、 乙酸(CH3COOH,99.0%)购于天津科密欧化学试剂有限公司;无水乙醇(C2H5OH,99.5%)、十六烷基三甲基溴化铵(C19H42BrN,CTAB,99.0%)购于湘中化学试剂有限公司;实验用水为去离子水。
德国Bruker D8 FOCUS多晶粉末X射线衍射(XRD)仪进行分析,以 Cu Kα1为 X 射线源(λ=0.154 056 nm),2θ为 10°~80°, 步长为 10°·min-1,扫描速率为0.1°·s-1,最大输出功率大于或等于2.2 kW,最大管压60 kV,最大管流80 mA)。采用日本JEOL公司的JEM-2010型透射电镜 (初始电压120 kV,初始电流 60~62 mA,最大工作电压 200 kV,稳定电流105 mA)观察粒子的形貌和尺寸。用美国Quantum Design公司的MPMS-XL-7超导量子干涉磁测量系统(SQUID)对样品的磁学性能进行测试。用表面吸附仪(TR2Star 3020)在液氮湿度下(77 K)测试样品的氮气吸附与解吸附过程。用日本岛津的UV-1800型紫外-可见分光光度计进行药物的负载和释放过程的紫外-可见光谱的测试。采用MCR-3微波化学反应器观察载体的微波热转化性。
1.2 样品的制备
该纳米载体的合成及微波控制给药过程如图1所示。
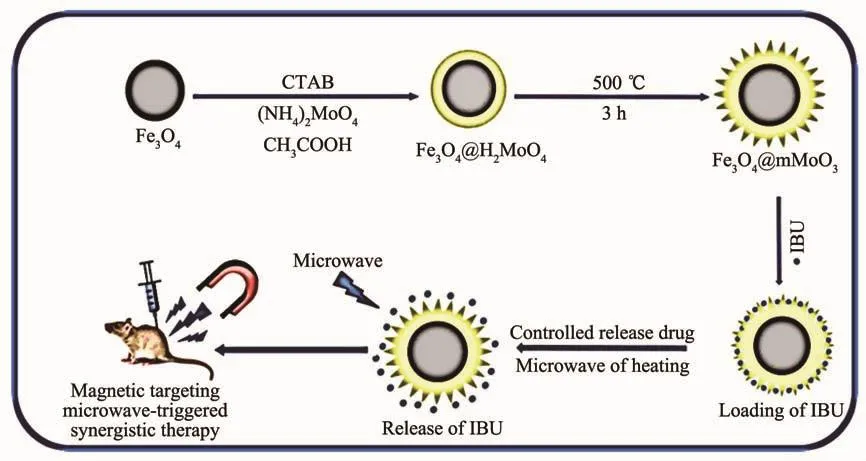
图1 Fe3O4@mMoO3纳米复合载体的合成及微波控制给药过程示意图Fig.1 Schematic illustration of the synthesis of the Fe3O4@mMoO3 nanocomposite carrier and microwave controlled drug delivery process
Fe3O4纳米颗粒的制备:将1.0 g三氯化铁溶于30 mL乙二醇中,然后加入2.0 g C2H5COONa和6.5 g聚乙二醇,室温下搅拌30 min,把所得溶液转移到50 mL带聚四氟乙烯内衬的反应釜中,在恒温箱中200℃反应6 h。室温下冷却后,将釜内黑色沉淀用去离子水和无水乙醇各洗涤3次,用磁铁吸附来收集样品,所制得的黑色沉淀在50℃下干燥5 h,得到Fe3O4纳米颗粒。
Fe3O4@mMoO3纳米颗粒的制备:将3.34 g钼酸铵溶入70 mL的去离子水中配置成无色透明的溶液,再加入0.5 g Fe3O4和 1.0 g CTAB,超声30 min,然后用磁力搅拌器搅拌(30 min)的同时缓慢滴加乙酸溶液至pH=3.5。滴加完毕后,静置一段时间,制得Fe3O4@H2MoO4纳米颗粒,用去离子水和无水乙醇清洗3次后在恒温箱中150℃干燥2 h,室温下冷却后在马弗炉中500℃烧结3 h,最终得到Fe3O4@mMoO3纳米颗粒。
1.3 载药与释放
药物负载过程:将0.1 g Fe3O4@mMoO3纳米颗粒分散到 50 mL IBU(0.3 g·L-1)的生理盐水(9 g·L-1)溶液中,磁力搅拌24 h。在药物负载过程中,分别在0、30、60、120、180、240 和 360 min 时取上清液,通过紫外分光光度计测量溶液中IBU的浓度 (石英比色皿)。通过朗伯-比尔定律计算纳米载体的载药量。
RM=Mads/Madd×100%
其中,RM是药物IBU的负载率,Mads是负载到纳米载体表面的IBU的质量,Madd是药物负载过程中IBU的初始量。
药物释放过程:药物IBU的释放实验全程是在生理盐水中进行的,为了研究微波辐射对药物释放率的影响,规定溶液的条件为37℃和pH=7.0,所采用的微波照射频率为2.45 GHz,具体实验过程是:称取0.1 g Fe3O4@mMoO3-IBU,使其均匀分散在50 mL 生理盐水中,在微波辐射 0、15、30、45、60 和 90 s时分别取上清液,然后将所取得样品用紫外可见光光谱进行IBU浓度的测试,再进一步计算药物的释放率。
2 结果与讨论
2.1 XRD分析
样品的相组成和结晶度由XRD进行测试分析。图2是纯Fe3O4、Fe3O4@mMoO3颗粒的XRD图。图2(a)中 30.1°、35.5°、43.1°、53.18°、56.9°和 62.5°处的特征衍射峰与Fe3O4的XRD标准图 (PDF No.65-3107)非常吻合,分别对应立方晶石结构Fe3O4晶体的(220)、(311)、(400)、(422)、(511)和(440)晶面。 由图 2(b)可以很清楚地观察到样品中除了存在尖晶石结构的Fe3O4晶体外,还出现较多的与PDF标准卡片(PDF No.35-0609)吻合良好的特征峰,对应结构为六方相的MoO3纳米晶体。图中没有检测出其他杂峰,表明磁性Fe3O4核与MoO3壳层之间并未发生明显的化学反应。此外,尖锐的强峰也表明样品的结晶较好。
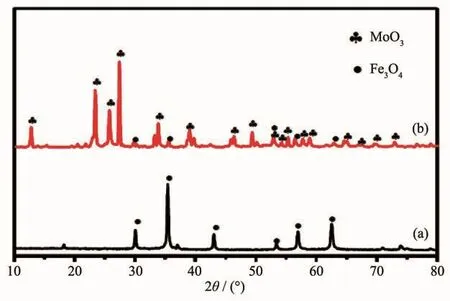
图2 (a)Fe3O4和(b)Fe3O4@mMoO3纳米颗粒的XRD图Fig.2 XRD patterns of(a)Fe3O4 and(b)Fe3O4@mMoO3
2.2 TEM分析
为了更清晰地观察复合颗粒的形貌以及包覆层的厚度,对制备的Fe3O4@H2MoO4和Fe3O4@mMoO3纳米颗粒的形貌和核壳结构分别进行了透射电镜分析。
图3为Fe3O4@H2MoO4和Fe3O4@mMoO3的TEM图以及Fe3O4@mMoO3的 EDS能谱图。图3(a,b)是Fe3O4@H2MoO4的透射电镜图,从图中可以看到,Fe3O4@H2MoO4颗粒外形为球形,粒径分布较均匀,进一步观测还可以清楚地看到外壳呈灰色的核-壳结构,平均厚度约为20 nm。结果表明,H2MoO4层均匀沉积在 Fe3O4纳米粒子上。图 3(c,d)中 Fe3O4@mMoO3的TEM图表明,煅烧后的样品(Fe3O4@mMoO3)仍保持原始尺寸,其外形依然呈单分散球形。但值得注意的是,煅烧后纳米粒子表面变得粗糙和松散,这是由于所制备的Fe3O4@H2MoO4在500℃下煅烧3 h时,模板CTAB分解产生了CO2和水蒸气导致在粒子内会留下大量的孔隙[10]。从高倍TEM图像(图3d)观察到在Fe3O4@mMoO3纳米颗粒的表面存在有较多的气孔且气孔形状不规则,孔径也不均匀。Fe3O4@mMoO3纳米颗粒的EDS能谱图(图3e)证实了 Fe3O4@mMoO3样品中存在 O、Fe、Mo元素(其他信号是用于测量材料的Cu)。再结合XRD结果分析,进一步证实了样品是介孔Fe3O4@mMoO3纳米颗粒。Fe3O4@mMoO3的多孔表面为其用作药物载体提供了机会。
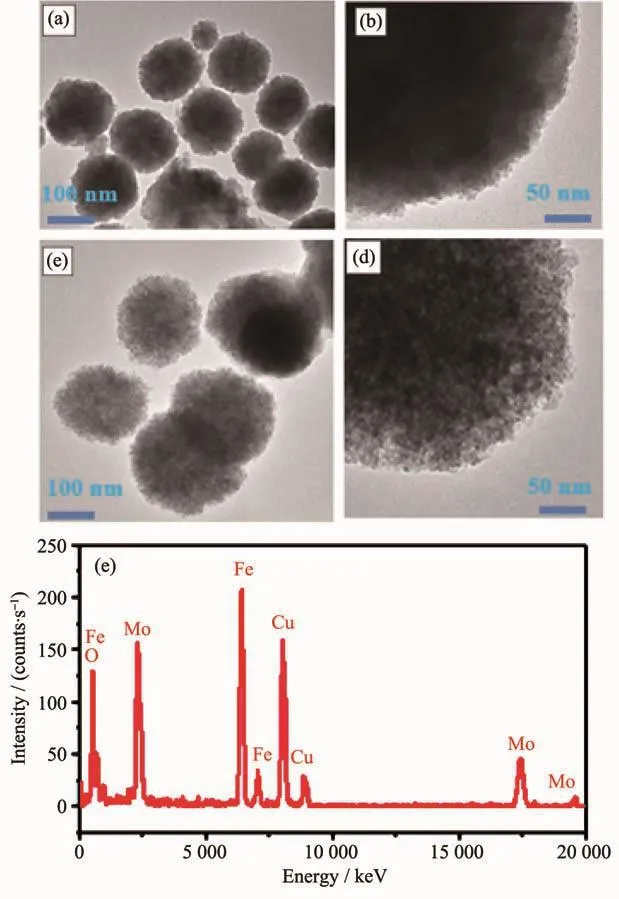
图 3 Fe3O4@H2MoO4(a,b)和 Fe3O4@mMoO3(c,d)的TEM图;(e)Fe3O4@mMoO3的EDS能谱图Fig.3 TEM images of Fe3O4@H2MoO4(a,b)and Fe3O4@mMoO3(c,d);(e)EDSspectrum of Fe3O4@mMoO3
为了研究Fe3O4@mMoO3纳米颗粒的介孔性能,对其进行了液氮吸附-脱附测试(图4)。根据国际理论和应用化学联合会(IUPAC)的标准,样品的吸附-脱附曲线表现出H2型滞后环的Ⅳ型等温曲线,这是典型的具有毛细管冷凝并且具有窄尺寸分布的多孔孔径的多功能材料所具有的特征[17]。通过BET计算其表面积为94 cm2·g-1。此外,图4插图中的孔径分布曲线也进一步证实了Fe3O4@mMoO3的平均孔径为2.5 nm。氮气吸附-脱附结果显示纳米粒子的孔道为介孔结构,表明该纳米颗粒适合作为药物载体来运输药物和吸附剂。
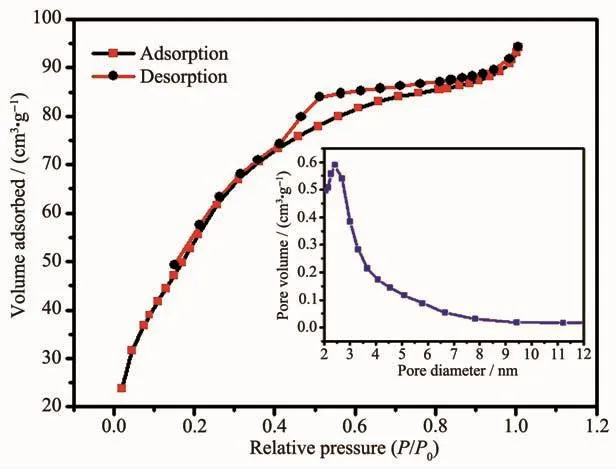
图4 Fe3O4@mMoO3的氮气吸附-脱附等温线与孔径分布曲线Fig.4 Pore diameter distribution and N2 adsorptiondesorption isotherms of Fe3O4@mMoO3
2.3 磁性分析
图5 a为Fe3O4和Fe3O4@mMoO3复合纳米颗粒的磁滞回线图,从图中可以看到2种样品具有相似的磁性质,其饱和磁化强度分别为80.2和42.3 emu·g-1。 与 Fe3O4颗粒相比 Fe3O4@mMoO3复合颗粒的饱和磁性强度有所降低,分析原因是由于Fe3O4颗粒表面包覆了mMoO3从而使Fe3O4的磁性质量分数降低(随着引入的非磁性物质的增多,磁性降低的更多)。与Fe3O4相比,Fe3O4@mMoO3复合纳米颗粒饱和磁化强度有所降低,但其磁滞回线仍具有较高的饱和磁化强度,足够用作磁靶向药物载体。图5b为分散在去离子水中的Fe3O4@mMoO3复合纳米颗粒在外加磁场下,不同时刻的磁响应性对比图。由图可见,均匀分散在溶液中的复合纳米颗粒Fe3O4@mMoO3在外加磁场的作用下迅速聚集到磁铁附近,说明制得的纳米颗粒具有良好的磁响应特性,可以用在磁性分离和磁靶向药物载体等方面。
2.4 微波热转化性
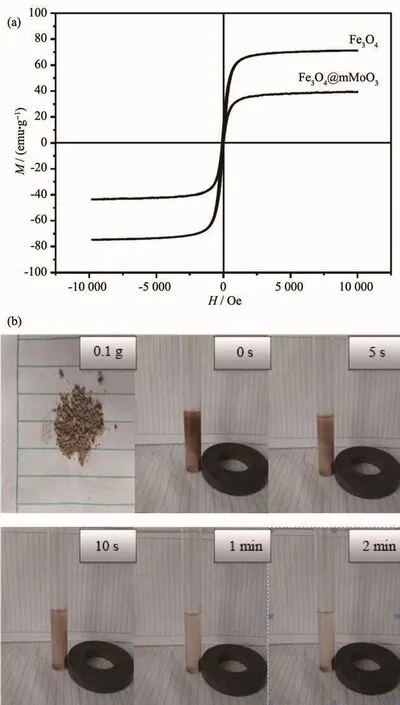
图5 (a)Fe3O4和(b)Fe3O4@mMoO3的磁滞回线;(b)分散在水溶液中的Fe3O4@mMoO3纳米颗粒在外部磁场作用下的磁响应图Fig.5 Hysteresis loops of(a)Fe3O4 and Fe3O4@mMoO3;(b)Magnetic response ability of Fe3O4@mMoO3 nanocomposites dispersed in aqueous solution under the magnetic field at different times
为了验证微波能否用来刺激控制药物释放,对Fe3O4@mMoO3纳米颗粒进行了吸收微波后的微波热响应测试。该测试是在室温条件下进行的,测试的微波频率为2.45 GHz(这与生物医疗上所用到的频率范围(2.45±0.05)GHz一致[7])。生理盐水溶液、Fe3O4悬浮液、Fe3O4@mMoO3悬浮液在微波辐射下的时间-温度的曲线如图6a所示。从图中可以看出,3种物质表现出了不同的微波热响应性能。其中样品Fe3O4@mMoO3的微波热响应速率最大,相比于Fe3O4@mMoO3分散液,生理盐水溶液和Fe3O4分散液的微波热效应相对要差一些,70 s时分别升温至57和69℃。当微波照射0.2 mg·mL-1Fe3O4@mMoO370 s时,Fe3O4@mMoO3分散液的温度升高至80℃,该温度已经足够用来进行疾病的热疗。结果表明,Fe3O4@mMoO3纳米颗粒具有很好的微波吸收性能和微波热转化性能,可以用在磁性分离和磁靶向药物载体等方面。
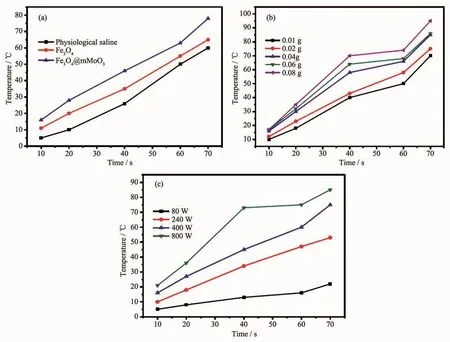
图 6 (a)在微波照射下(2.45 GHz,400 W)生理盐水溶液、Fe3O4(0.2 mg·mL-1)悬浮液和 Fe3O4@mMoO3(0.2 mg·mL-1)悬浮液的温度变化曲线;(b)在微波照射下(2.45 GHz,400 W)Fe3O4@mMoO3浓度对其微波转化特性的影响曲线;(c)在微波照射下(2.45 GHz)微波辐射功率对Fe3O4@mMoO3(0.2 mg·mL-1)微波转化特性的影响曲线Fig.6 (a)Heating curves of physiological saline solution,Fe3O4(0.2 mg·mL-1)supspension and Fe3O4@mMoO3(0.2 mg·mL-1)supspension under microwave irradiation(2.45 GHz,400 W);(b)Effect of the concentration of Fe3O4@mMoO3 on the microwave conversion property under microwave irradiation(2.45 GHz,400 W);(c)Effect of microwave radiation power on the microwave conversion property of Fe3O4@mMoO3(0.2 mg·mL-1)under microwave irradiation(2.45 GHz)
为了评价Fe3O4@mMoO3纳米颗粒的体外微波加热转化效率,在微波照射下探索Fe3O4@mMoO3纳米颗粒悬浮液的浓度对其微波转化率的影响。图6(b)显示,在一定范围内,随着Fe3O4@mMoO3浓度的增加,其悬浮液的温度升高,当浓度为0.4 mg·mL-1、微波功率为400 W时,悬浮液温度在不到20 s的时间内升高超过20℃。将Fe3O4@mMoO3纳米颗粒注射到肿瘤组织时可以在短时间内快速加热至43℃,该温度足以将肿瘤细胞杀死。结果表明,Fe3O4@mMoO3纳米颗粒表现出较好的微波吸收能力和良好的微波热转化,主要原因是铁电和介电材料结合的Fe3O4@mMoO3纳米颗粒能迅速将所吸收的微波能量以电能能量的损失形式转化为热能,导致其温度升高[11]。并且,Fe3O4@mMoO3纳米颗粒的微波热转换效率随着微波辐射功率的增加而增加(图6c)。以上结果表明,Fe3O4@mMoO3纳米颗粒可以快速将微波能转化为热能,并可用于热疗。铁电和介电材料的结合能迅速将所吸收的微波能量转化为热能,导致其悬浮液温度升高。介电材料和磁性材料之间的有效界面可产生较高的介电常数和反射损耗即界面极化和相关的弛豫,导致其微波吸收能力增强。由于mMoO3会迅速将电磁能转化为热能,在微波功率相同的条件下,对于纳米载体来说,mMoO3的比例越大,微波吸收能力越强,与实验结果一致。Fe3O4纳米颗粒也可以吸收微波能并有效地将微波能量转换为局部热量,这主要是由于软磁材料Fe3O4纳米粒子具有高磁饱和强度和高磁导率。Fe3O4与mMoO3的结合能改变材料的磁导率和介电常数,使介质的切线损耗和磁正切损耗相当,降低在自由空间内阻抗匹配的难度,从而增强吸收能力。
2.5 载药和释药
Fe3O4@mMoO3纳米载体的介孔层为药物分子的负载提供了较大的孔体积,其平均孔径大小为2.50 nm,比IBU药物分子的直径(0.60 nm)要大4.0倍。IBU分子与介孔三氧化钼表面上的羟基之间可以通过氢键相连或物理吸附,从而使IBU分子装载到介孔层的孔内,然后通过微波加热促使二者之间的氢键断裂或作用力破坏,使IBU药物分子从载体上释放出来,从而实现微波可控释放的目的。
图7为药物负载的动力学分析。图7(a)表明IBU在225 nm处有最大吸收峰,但随着时间的延长,所对应的吸光强度值减小,这说明溶液中药物的浓度是随负载时间的延长而减小的。由图7(b)可知,在开始的时候药物的负载率(R)迅速增大,在180 min内其负载率均达到约75%,但是随后药物负载率增长速度变得缓慢。360 min后Fe3O4@mMoO3的药物负载率大约为80%。纳米颗粒具有较高的装载率归功于介孔MoO3的多孔表面和其强大的装载能力。
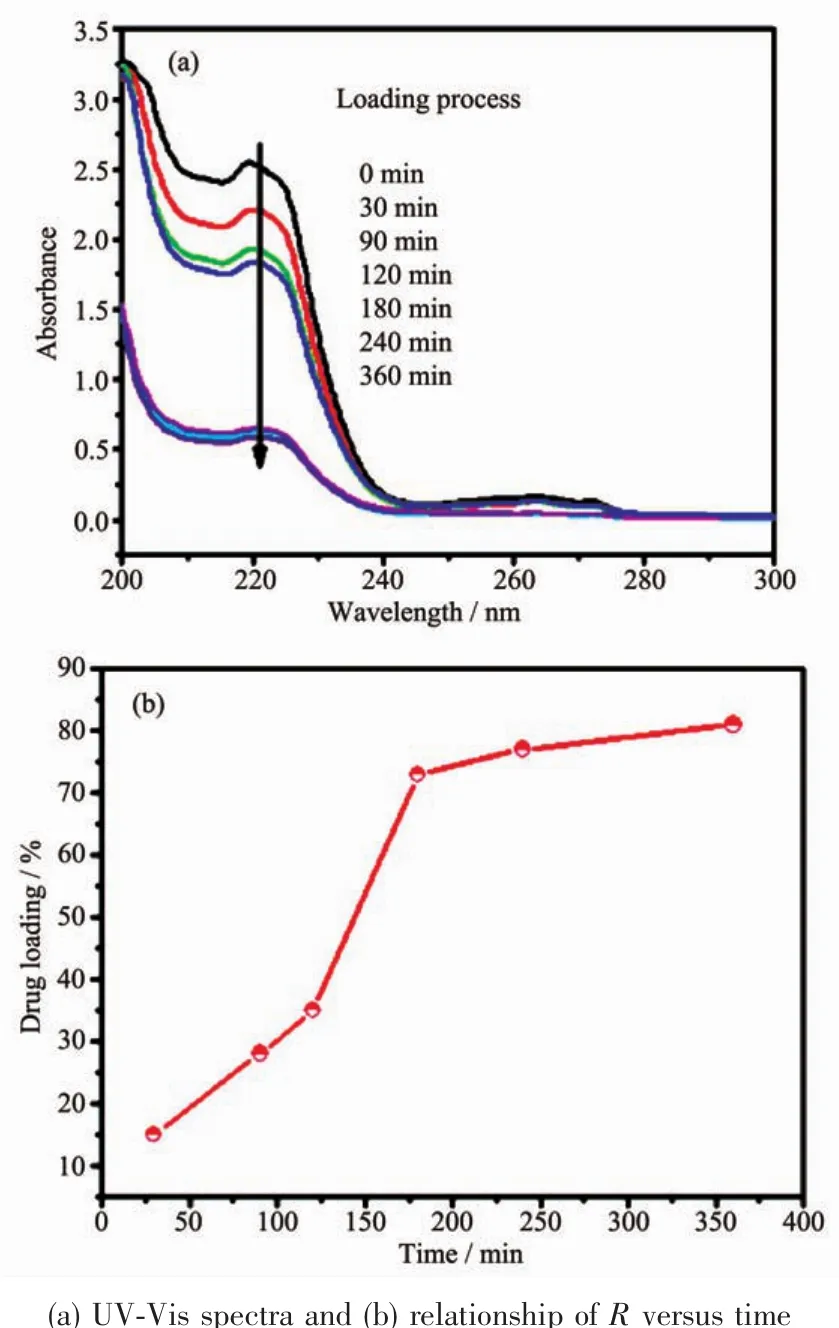
图7 药物负载的动力学分析Fig.7 Kinetic analysis of drug loading
为了进一步确定微波照射对载体释放药物的影响,对比研究了微波照射和无微波仅搅拌时药物释放速率的变化曲线,如图8所示。在没有微波照射下,纳米载体对IBU药物分子的释放速率非常慢,搅拌下经过90 s,IBU药物分子的释放量仅为1.6%。然而,当把药物释放体系转到微波照射的环境时IBU药物分子的释放速率会明显的提升,微波照射90 s药物分子的释放量达到了86%。在微波照射和无微波仅搅拌情况下(图8),载体上药物释放速率的变化十分明显,说明Fe3O4@mMoO3纳米载体具有很好的刺激响应释放性能。药物释放研究表明微波照射能大大提高纳米载体的药物释放速率,在微波照射下MoO3层能迅速吸收微波产生热量,破坏载体与药物分子之间的作用力,致使装载在纳米载体介孔中的药物分子释放出来,表明Fe3O4@mMoO3-IBU纳米载体具有的微波热响应促进了药物释放性能。
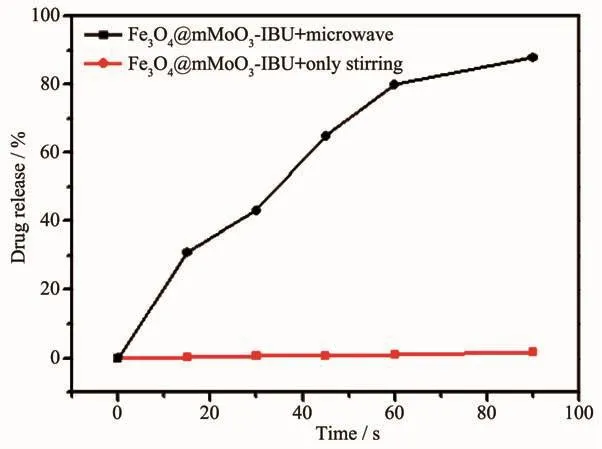
图8 Fe3O4@mMoO3@-IBU在微波照射和没有微波照射仅搅拌的条件下IBU的释放曲线Fig.8 Release profiles of IBU with microwave irradiation or without microwave irradiation(only stirring)for Fe3O4@MoO3@mSiO2-IBU
3 结 论
针对Fe3O4@MOn作为药物载体时MOn壳层缺乏孔结构引起的药物负载率较低这一科学难题,采用溶剂热法和沉淀法在Fe3O4表面包覆mMoO3介孔壳层,制备了具有磁-吸波性能于一体的Fe3O4@mMoO3介孔多功能复合纳米载体,并以IBU为药物模型研究和分析其对IBU的负载能力和可控释药行为,其结果表明所制备的纳米载体Fe3O4@mMoO3具有较大的表面积,可实现药物的有效装载。微波热转换特性研究表明纳米载体Fe3O4@mMoO3具有较高的磁化饱和强度和良好的微波热转化性,可实现靶向可控给药。此外,该合成方法也为其他多孔核-壳结构纳米颗粒的设计和合成提供了重要的途径。并且Fe3O4@mMoO3核-壳结构纳米颗粒不仅可成为癌症治疗中具有前景的微波热疗剂,也可用于水处理领域。
