FOXO 3抑制膀胱癌细胞生长的体外实验研究
2019-07-09何笑凯康郑军柴蕴珠郑州大学第五附属医院泌尿外科郑州455郑州大学第一附属医院消化内科郑州45
何笑凯,康郑军,柴蕴珠郑州大学第五附属医院泌尿外科,郑州455郑州大学第一附属医院消化内科,郑州45
膀胱癌是泌尿系统的恶性肿瘤,其发病率在全部泌尿系统恶性肿瘤中位居首位[1]。据统计,膀胱癌的发病率和病死率呈现逐年上升的趋势[2]。膀胱癌发病机制较为复杂,是多种基因、多种因素共同作用的结果,手术治疗和手术后的辅助治疗是目前治疗膀胱癌的主要手段,但是仍然存在膀胱癌患者手术后高复发、高转移的现象[3]。研究膀胱癌的发病机制对于膀胱癌的治疗具有重要意义。叉头框转录因子O3(forkhead box O3,FOXO3)是FOX家族的成员之一,能够调控细胞核内的靶基因转录,参与细胞生物学功能的发挥[4]。FOXO3参与肝癌、乳腺癌、卵巢癌等多种肿瘤的生物学行为,与肿瘤患者的预后有关[5]。有研究表明,FOXO3能够抑制胃癌、肝癌等肿瘤细胞的生长[6-7]。为了探讨FOXO3对膀胱癌细胞生长的影响,本研究以膀胱癌细胞为研究对象,运用噻唑蓝(methyl thiazolyldiphenyl tetrazolium,MTT)和细胞克隆形式实验等生物学手段,探讨FOXO3对膀胱癌细胞生长的影响,为靶向FOXO3治疗膀胱癌提供理论参考,现报道如下。
1 材料与方法
1.1 材料
人膀胱癌T24细胞购自中国科学院细胞库;兔抗FOXO3多克隆抗体、兔抗β-链蛋白(β-catenin)多克隆抗体、蛋白激酶B(protein kinase B,PKB,又称AKT)多克隆抗体、兔抗磷酸化蛋白激酶B(p-AKT)多克隆抗体均购自美国STANT公司;RNA提取试剂盒购自北京索莱宝科技有限公司;蛋白提取试剂盒购自北京普利莱基因技术有限公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量检测试剂盒购自美国Biomiga公司;FOXO3-pcDNA3.1和pcDNA3.1质粒由郑州大学实验室保存;FOXO3、GAPDH引物由美国Invitrogen公司合成;胎牛血清、青霉素、链霉素均购自美国Gibco公司;胰蛋白酶、DMEM、MTT均购自美国Sigma公司;LipofectamineTM2000购自美国Invitrogen公司。
1.2 实验方法
1.2.1 细胞培养 膀胱癌细胞T24在10%胎牛血清、青霉素和链霉素浓度均为100 U/ml的DMEM中培养,培养条件为37℃,5%CO2饱和湿度,细胞浓度保持(2~6)×105/ml。所有实验用细胞均为对数生长期细胞,培养至融合度为70%后,加入0.25%的胰蛋白酶消化传代。
1.2.2 细胞转染T24细胞以2×106/孔种植到6孔细胞培养板中,观察细胞生长到占满培养皿底部面积70%时,将培养液吸去。将FOXO3-pcDNA3.1、pcDNA3.1与DMEM混合后静置5 min,与LipofectamineTM2000混合,在室温条件下孵育20 min。取400 μl的上述混合液加入到6孔细胞培养板中,6 h后加入1 ml的细胞培养液,培养24 h。将转染FOXO3-pcDNA3.1和pcDNA3.1的T24细胞分别记为FOXO3组、Vector组,将没有转染的T24细胞记为对照组。
1.2.3 反转录-聚合酶链反应(reverse transcription-polymerase chain reaction ,RT-PCR)检 测FOXO 3 mRNA表达 对照组、Vector组、FOXO3组细胞转染后培养24 h,用RNA提取试剂盒提取细胞中的RNA,反转录合成cDNA,RT-PCR检测FOXO3 mRNA的表达。FOXO3正义序列:5'-AACCTTCTGATGTAAGTTAC-3',反义序列:5'-GTGATTGCCTTCAGGATTAC-3'。GAPDH正义序列:5'-AATGGGCAGCCGTTAGGAAA-3',反义序列:5'-GCGCCCAATACGACCAAATC-3'。以 2-△△Ct法计算FOXO3 mRNA相对表达量。实验重复3次,取均值。
1.2.4 蛋白质印迹(Westernblot)法检测FOXO 3蛋白表达 对照组、Vector组、FOXO3组细胞转染后培养24 h,倒掉培养液,加入冰预冷的磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤后,进行细胞裂解,4℃、12 000 r/min离心10 min,将上清液吸取至1.5 ml的EP管中。采用BCA法测定蛋白浓度。80 V电压电泳4 h,观察目的蛋白分子量的标记进入距离玻璃板底1 cm处。60 mA电流转膜80 min。5%牛血清白蛋白室温封闭2 h,加入1∶1000稀释的一抗,4℃摇晃过夜,加入1∶2000稀释的二抗,在室温环境下孵育2 h。用ChemiDoc XRS+System曝光机曝光,用Image LabTM software扫描灰度值。以目的蛋白灰度值/GAPDH灰度值作为蛋白相对表达量。实验重复3次,取均值。
1.2.5 MTT检测细胞增殖活力 对照组、Vector组、FOXO3组细胞用胰蛋白酶消化计数,使每100 μl的培养液中含有4000个细胞,种植到96孔细胞培养板中,每组设置4个复孔。培养24 h后,每孔加入10 μl的MTT溶液进行处理,孵育4 h后,将培养板取出,弃上清,依次在每个孔中重新加入100 μl的二甲基亚砜溶液,振荡反应5 min。观察蓝紫色的结晶溶解以后,酶标仪于570 nm的波长处测量光密度(optical density,OD)值。同时用 Western blot法检测培养24 h后各组细胞中β-catenin、AKT、p-AKT蛋白表达水平,步骤同上。实验重复3次,取均值。
1.2.6 克隆形成实验检测细胞克隆形成能力 对照组、Vector组、FOXO3组细胞接种到6孔板中,密度为200/孔,每组设置3个复孔,37℃、5%CO2培养14天后,待肉眼观察形成细胞克隆后,停止培养,将培养液吸除后,加入PBS洗涤两次,用10 g/L的戊二醛固定,用5 g/L的结晶紫染色,用水冲洗几次后,干燥,随机选择5个视野,置于显微镜下计数,含有10个以上的细胞记为1个克隆。实验重复3次,取均值。
1.3 统计学方法
采用SPSS 22.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,多组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 FOXO 3表达情况的比较
Vector组细胞中FOXO3 mRNA和蛋白相对表达量与对照组比较,差异均无统计学意义(P>0.05);FOXO3组细胞中FOXO3 mRNA和蛋白相对表达量均明显高于对照组,差异均有统计学意义(P<0.01)。(图1、表1)
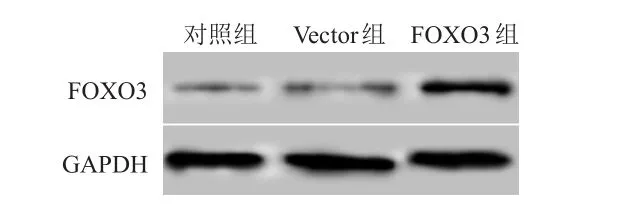
图1 Western blot法检测对照组、Vector组、FOXO 3组细胞中FOXO 3蛋白表达情况
表1 对照组、Vector组、FOXO3组细胞中FOXO3 mRNA和蛋白相对表达量的比较±s)
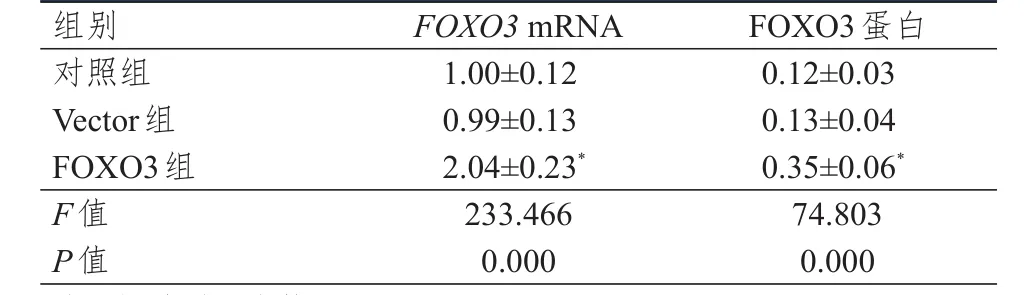
表1 对照组、Vector组、FOXO3组细胞中FOXO3 mRNA和蛋白相对表达量的比较±s)
注:*与对照组比较,P<0.05
FOXO3 mRNA 1.00±0.12 0.99±0.13 2.04±0.23*233.466 0.000 0.12±0.03 0.13±0.04 0.35±0.06*74.803 0.000对照组Vector组FOXO3组F值P值FOXO3蛋白组别
2.2 细胞增殖情况的比较
Vector组细胞OD值与对照组比较,差异无统计学意义(P>0.05);FOXO3组细胞OD值低于对照组,差异有统计学意义(P<0.05)。(表2)
表2 对照组、Vector组、FOXO 3组细胞中OD值的比较± s)

表2 对照组、Vector组、FOXO 3组细胞中OD值的比较± s)
注:*与对照组比较,P<0.05
OD值0.89±0.04 0.88±0.07 0.56±0.05*211.400 0.000对照组Vector组FOXO3组F值P值组别
2.3 细胞克隆形成能力的比较
Vector组细胞克隆数目与对照组比较,差异无统计学意义(P>0.05);FOXO3组细胞克隆数目低于对照组,差异有统计学意义(P<0.05)。(表3)
表3 对照组、Vector组、FOXO 3组细胞克隆数目的比较±s)

表3 对照组、Vector组、FOXO 3组细胞克隆数目的比较±s)
注:*与对照组比较,P<0.05
细胞克隆数目46.78±5.63 44.26±4.69 25.36±2.34*125.090 0.000对照组Vector组FOXO3组F值P值组别
2.4 β-catenin、AKT、p-AKT蛋白相对表达量的比较
Vector组细胞中β-catenin、p-AKT、AKT蛋白相对表达量与对照组比较,差异均无统计学意义(P>0.05);FOXO3组细胞中AKT蛋白相对表达量与对照组比较,差异无统计学意义(P>0.05);FOXO3组细胞中β-catenin、p-AKT蛋白相对表达量均低于对照组,差异均有统计学意义(P<0.05)。(图2、表4)
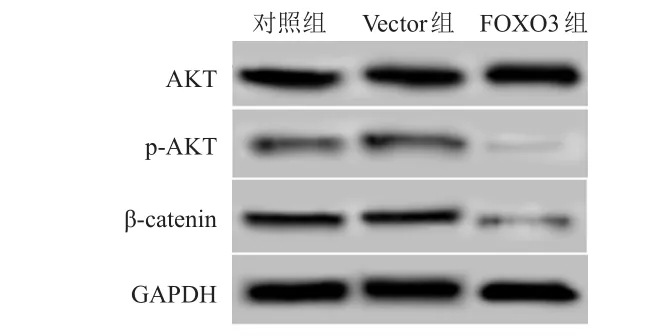
图2 Western blot法检测对照组、Vector组、FOXO 3组细胞中 β-catenin、AKT、p-AKT蛋白表达情况
表4 对照组、Vector组、FOXO 3组细胞中 β-catenin、AKT、p-AKT蛋白相对表达量的比较(± s)
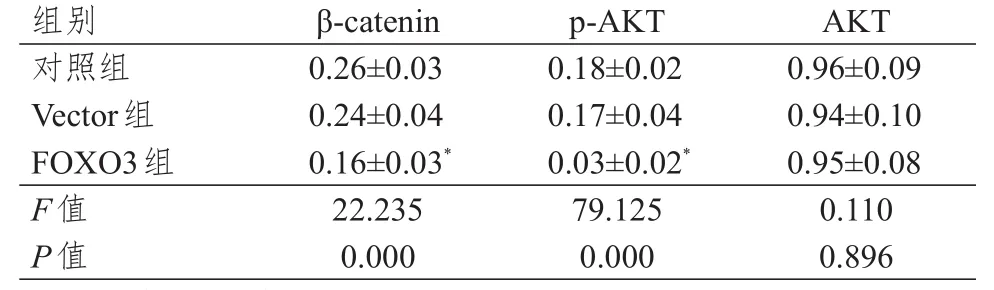
表4 对照组、Vector组、FOXO 3组细胞中 β-catenin、AKT、p-AKT蛋白相对表达量的比较(± s)
注:*与对照组比较,P<0.05
β-catenin 0.26±0.03 0.24±0.04 0.16±0.03*22.235 0.000 0.18±0.02 0.17±0.04 0.03±0.02*79.125 0.000 0.96±0.09 0.94±0.10 0.95±0.08 0.110 0.896对照组Vector组FOXO3组F值P值p-AKT AKT组别
3 讨论
FOXO3是存在于细胞内的重要信号转录因子,参与调控细胞的生长、分化、代谢等过程[8]。FOXO3无论是在正常细胞还是在肿瘤细胞中均参与内环境稳定、细胞生长等生物学过程,是细胞存活的长寿基因[9]。近年来的研究显示,FOXO3在肿瘤发生、肿瘤血管生成、肿瘤细胞耐受、肿瘤代谢等方面发挥关键作用[10]。FOXO3含有FOX结构域,是目前研究最为完善的FOX家族成员[11]。FOXO3不仅可以通过与靶基因的结构域结合调控靶基因的转录,还可以通过影响细胞内多种信号转导通路调控细胞的生长[12]。FOXO3在多种肿瘤中异常表达,并且与肿瘤的分期等有关[13]。梁超[14]的研究表明,FOXO3与肝细胞肝癌的生长、转移等有关。Lu等[15]的研究显示,S型雌马酚可以通过作用于FOXO3影响前列腺癌细胞的生长、凋亡等生物学行为。
有研究表明,FOXO3能够与细胞内多种信号通路的关键因子如β-catenin、AKT相互作用,形成多线条、立体的调控系统[16]。WNT信号通路是一个较为保守的信号通路,在线虫或人体等多种动物体内均有表达,在细胞的生长、分化、迁移、凋亡等过程中具有十分重要的作用[17]。WNT异常与结肠癌、胃癌、膀胱癌等肿瘤的发生有关。β-catenin是WNT信号通路的关键蛋白,激活后其表达水平升高[18]。AKT信号通路参与细胞的生长,在人体内的多个组织和器官内发挥调控作用。AKT信号通路在肿瘤中过度活化,其磷酸化水平异常升高[19]。Luo等[20]的研究显示,亚硒酸钠可以通过作用于AKT/β-catenin/FOXO3诱导结肠癌细胞的凋亡。
本研究对体外膀胱癌细胞转染了FOXO3过表达载体,RT-PCR和Western blot结果显示FOXO3过表达载体能够促进膀胱癌细胞中FOXO3 mRNA和蛋白的表达,成功构建了高表达FOXO3的膀胱癌细胞。MTT和细胞克隆形成实验结果显示,高表达FOXO3的膀胱癌细胞OD值下降,细胞克隆数目也减少,说明FOXO3抑制膀胱癌细胞生长。进一步通过Western blot法检测β-catenin、p-AKT蛋白相对表达量发现,FOXO3还能抑制膀胱癌细胞中β-catenin、p-AKT蛋白的相对表达量。这提示,FOXO3可能通过抑制β-catenin、p-AKT表达阻碍膀胱癌细胞生长。
综上所述,FOXO3能够在体外抑制膀胱癌细胞生长,这可能与FOXO3阻断WNT信号通路和AKT信号通路有关,其具体的作用机制还需要进一步深入研究。本研究具有一定的局限性,对于FOXO3在其他多种膀胱癌细胞中的作用还需要后续实验的验证。本实验结果为靶向FOXO3治疗膀胱癌提供了依据,为研究FOXO3在肿瘤中的作用奠定了基础。
