耐高温餐厨垃圾分解细菌的筛选、鉴定及应用
2019-07-09万文娟张赟彬聂志妍毛彦佳
万文娟 张赟彬,2 聂志妍 毛彦佳 许 静 喻 莹
(1. 上海应用技术大学香料香精技术与工程学院,上海 201418;2. 上海中医药大学公共健康学院,上海 201203;3. 上海健康医学院医学技术学院,上海 201318;4. 上海捷浩后勤设施技术服务有限公司,上海 201400)
餐厨垃圾是家庭、单位食堂以及餐饮行业等在食品生产、加工和消费过程中产生的有机废弃物[1-2],容易腐烂,在自然分解过程中,会产生大量的氨气、硫化物等有害气体,散发恶臭[3-4];如果将餐厨垃圾直接作为饲料,其中的致病菌可引发动物染病,人畜交叉感染病,危害人体健康[5-6]。随着社会经济的迅猛发展,中国餐厨垃圾的产量也急剧增长。据报道[7],餐厨垃圾产生量在2015年达到0.62亿~1.04亿t,已成为影响城市环境健康发展的一个重要问题。国外开展餐厨垃圾快速处理技术的研究较早[8],随着经济的发展以及国家对环保重视程度的提高,中国也已经开始研究。
目前,餐厨垃圾的处理方式主要包括粉碎直排法、脱水处理法、化学处理法、焚烧处理法、厌氧消化法和微生物处理法等[9]。这些方法中除微生物处理法外大都耗能高,甚至对环境造成二次污染[10],因此,采用微生物法处理餐厨垃圾成为国内外的研究热点[11-13]。由于中国饮食文化的不同,餐厨废弃物成分同国外有明显差别,尤其是其中的油脂类成分、纤维素成分和含盐量都偏高;此外,从目前中国餐厨废弃物实际处理的效果来看,国外进口的微生物降解菌制剂不太适用于国内餐厨垃圾的成分,导致处理餐厨废弃物的成本偏高,而降解效率偏低。因此,针对中国餐厨垃圾研制可高效降解的微生物菌制剂具有较好研究潜力和实际应用价值。而对于餐厨垃圾中4类主要有机物的降解问题,有学者已经做过一些相关研究。有研究表明枯草芽孢杆菌对氨基酸态氮、三氯乙酸可溶性蛋白都有明显的降解作用[14],Serratia marcescens和Aeromonas hydrophila对油脂有分解作用[15],但这些研究只研究了目标菌株对单一有机物的分解效果,对其他有机物的分解效果尚不明确,此外,目前一些研究[16-17]还存在着降解率低、稳定性差等缺点。在较高温度的条件下微生物对餐厨垃圾降解效率更高[18-20],因此研制出含耐高温降解菌的菌制剂,并与相应的餐厨垃圾处理设备相配套,将可实现餐厨垃圾的快速降解。
本研究拟分离耐高温且能够高效降解有机物的细菌菌株,制作成菌制剂,配合餐厨垃圾处理设备应用于餐厨垃圾处理工业,以期实现餐厨垃圾的减量化和无害化。
1 材料与方法
1.1 材料与设备
1.1.1 试验样品
取自某高校处理中的餐厨废弃物,过筛除去其中的骨头等大块杂质,混匀,样品置于55 ℃恒温恒湿箱中保存。
1.1.2 试验试剂
革兰氏染色剂、甲基红、无水肌酸:分析纯,上海源叶生物科技有限公司;
乙醇、氢氧化钾、三氯化铁、碘化钾、碘:分析纯,国药集团化学试剂有限公司;
石油醚:分析纯,上海泰坦科技股份有限公司;
过氧化氢、甘油:分析纯,上海凌峰化学试剂有限公司;
DNA提取试剂盒:上海生工生物有限公司;
1.1.3 仪器与设备
恒温恒湿培养箱:HC92-2型,美国SHELLAB制造股份有限公司;
实验室pH计:FE20-K型,梅特勒—托利多仪器有限公司;
数显恒温水浴锅:XMTD-204型,常州翔天实验仪器厂;
电热鼓风干燥箱:DHG-9140A型,上海凯朗仪器设备厂;
电子显微镜:BA210-T型,麦克奥迪实业集团有限公司;
立式压力蒸汽灭菌锅:TOMY SX-500型,日本Tomy Digital Biology公司;
电子天平:ME204E/02型,梅特勒—托利多仪器有限公司;
紫外可见分光光度计:UV-1800型,岛津仪器(苏州)有限公司;
超低温冰箱:WMQIS1M型,青岛海尔股份有限公司;
水浴恒温振荡摇床,VS-WHD型,无锡沃信仪器制造有限公司。
1.1.4 培养基
LA培养基和LB培养基:上海源叶生物科技有限公司;
葡萄糖蛋白胨水培养基:葡糖糖2 g,蛋白胨2 g,氯化钠1 g,蒸馏水200 g;
刚果红纤维素培养基:硝酸钠1.0 g,硫酸镁0.5 g,酵母浸出粉0.5 g,氯化钾0.5 g,磷酸二氢钾0.9 g,磷酸氢二钠1.2 g,刚果红0.2 g,纤维素粉5.0 g,酸水解酪蛋白0.5 g,琼脂15.0 g;
淀粉培养基:牛肉膏5.0 g,蛋白胨10.0 g,NaCl 5.0 g,可溶性淀粉2.0 g,琼脂20.0 g;
蛋白培养基:酵母膏5.0 g,可溶性淀粉10.0 g,KH2PO41.0 g,MgSO4·7H2O 0.2 g,脱脂奶粉50.0 g,琼脂20 g;
脂肪培养基:蛋白胨10.0 g,NaCl 5.0 g,CaCl2·7H2O 0.1 g,琼脂9.0 g,pH 7.4,121 ℃灭菌20 min,冷却至 40~50 ℃,加入121 ℃单独灭菌20 min 的Tween-80 至终浓度为1%。
1.2 试验方法
1.2.1 取样方法 按GB/T 9695.19—2008的取样方法取一定量的餐厨垃圾样品,装入无菌袋中密封,带回实验室,备用。
1.2.2 菌种分离与筛选
(1) 制备样品稀释液:使用电子天平精确称取样品10 g,倒入250 mL的锥形瓶中,加入90 mL的灭菌生理盐水,震荡15 min,使样品与生理盐水充分混匀,静置1 min,制备成为10-1浓度的菌稀释液,再使用经高温灭菌的枪头的移液枪,吸取1 mL上述液体加入9 mL小试管中,制成10-2菌液,以此类推,制得10-3,10-4,10-5浓度梯度的样品稀释液。
(2) 涂布:在LA培养基加100 μL各浓度梯度的样品稀释液,涂布均匀,各3个平行。
(3) 培养:将经过涂布后的培养皿倒置放于恒温恒湿培养箱中,在温度为55 ℃,相对湿度为50% RH的条件下在恒温恒湿箱中培养48 h。
(4) 分离纯化:选取培养后菌落个数为30~300个的培养皿,挑选形态大小不同、有明显差异的单个菌落,采用平板划线法在LA培养基上划线分离,传代纯化4~5次,得到纯菌落于4 ℃冰箱保藏。
(5) 菌种保藏:甘油与灭菌生理盐水按2∶3的体积比配制甘油溶液。将菌株接种于液体试管培养基中,在水浴摇床(55 ℃,120 r/min)中培养24 h,取菌液与甘油溶液按2∶1的体积混匀,于1.5 mL的保藏管于保藏-80 ℃ 的超低温冰箱[21]。
1.2.3 耐高温降解菌的分解效果测定
(1) 淀粉降解活性:配置淀粉固体培养基,取上述分离提纯后的菌株,点接于淀粉固体培养基,55 ℃下培养48 h,在菌落周围滴加少量卢戈氏碘液[22],反应15 s后,使用游标卡尺测量菌落周围透明圈的直径D与菌落直径D0的比值(D/D0),即为该菌株的淀粉降解活性。
(2) 蛋白质降解活性:配置蛋白质培养基,取上述分离提纯后菌株,点接于蛋白质培养基,55 ℃下培养48 h。使用游标卡尺测量菌落周围模糊圈的直径D与菌落产生不透明圈的直径D0的比值,即为该菌株的蛋白质降解活性。
(3) 纤维素降解活性:配置刚果红纤维素培养基,取上述分离提纯后的4类菌种,点接于刚果红纤维素培养基,55 ℃下培养48 h。使用游标卡尺测量菌落周围水解圈的直径D与菌落直径D0的比值,即为该菌株的纤维素降解活性。
(4) 油脂降解活性:将分离纯化后得到的各菌株点接到脂肪培养基平板上,倒置于恒温培养箱中在55 ℃下培养,48 h后取出,用游标卡尺测定晕圈直径D与菌落直径D0的比值,即为该菌株的脂肪降解活性。
1.2.4 菌种鉴定
(1) 形态学鉴定:经过复筛后,选取对淀粉、蛋白质、油脂和纤维素降解效果最好的菌株,通过对分离菌株同《伯杰氏细菌鉴定手册》相比对,进行形态学鉴定。
(2) 生理生化鉴定:通过革兰氏染色试验、糖发酵试验、V-P试验、过氧化氢酶试验、甲基红试验和苯丙氨酸脱氨试验来对有机物分解效果最好的菌种进行生理生化鉴定。
(3) 分子生物学鉴定:取1 mL过夜培养的菌液,入1.5 mL离心管中,8 000 r/min离心1 min,加入180 μL用Enzymatic lysis buffer 配制的20%的溶菌酶溶液,重悬菌液,再根据DNA提取试剂盒步骤要求完成提取成操作。收集DNA溶液,提取的DNA立即在-20 ℃保存。提取的DNA送生工生物工程(上海)有限公司测序。
测序结果分析:16S rDNA序列在核糖体数据库(http://rdp.cme.msu.edu/index.jsp)上比对。
1.2.5 生长曲线测定 保藏菌株活化后,挑取菌落接种于装有5 mL的液体培养基的试管中,在温度为55 ℃,120 r/min的水浴恒温振荡摇床中培养培养24 h,3组平行。按5%的接种量再次接种于装有100 mL液体培养基的250 mL的锥形瓶中发酵培养60 h,每隔2 h取样,在605 nm下测定发酵液值OD值,绘制该菌株的生长曲线。
1.2.6 餐厨垃圾的降解
(1) 菌制剂的制备:将降解效果最好的菌株接种于装有5 mL灭过菌的液体培养基的试管中,根据生长曲线确定的时间在温度55 ℃,120 r/min的水浴恒温振荡摇床中培养。使用同样的方法按15%的接种量比再次接种扩大培养,测量菌液浓度。将培养好的菌悬液在6 000 r/min离心10 min,弃2/3的上清液,剩余部分摇晃均匀,备用。
以锯末粉和活性炭质量比为10∶1作为载体材料,将制备好的浓缩菌悬液按质量比1∶1均匀喷洒在载体材料上制成菌制剂。
(2) 餐厨垃圾降解效果的测定:参考丁杰萍等[23]对于餐厨垃圾中淀粉、蛋白质、脂肪和纤维素主要成分的研究结果,结合日常食物营养成分表配制本试验的餐厨垃圾模型(表1)。

表1 餐厨垃圾主要构成
将米饭、熟鸡蛋、熟青菜、植物油按表1配比,测量水分含量和总重量,制成餐厨垃圾基质。与菌制剂按10∶1的质量比添加到餐厨垃圾处理器中,在55 ℃处理48 h左右,根据餐厨垃圾质量的变化情况测量减量化效果。
2 结果与分析
2.1 菌种分离
根据菌落的形态学特点,在LA培养基上筛选分离出耐高温的细菌20株,分别命名为:X1、X2、……、X20。
2.2 菌种复筛
将上述分离得到的20株细菌分别进行淀粉、蛋白质、脂肪、纤维素的降解效果试验,结果见表2。
参照其他研究[24],D/D0>2则表示该株菌对有机物分解效果较好。由表2可知,编号为X1、X3、X5、X6、X8、X10、X13、X18、X19、X20的D/D0>2,证明这些菌株对淀粉的分解效果较好。而对脂肪类有机物的分解效果,编号为X13和X17的细菌的D/D0>2。对于纤维素的分解效果,D/D0>2的菌株编号有:X6、X7、X8、X9、X11、X13、X14、X16、X17、X18。每株细菌对淀粉、蛋白质、脂肪、纤维素四类主要有机物的分解能力各不相同,综合各菌株对淀粉、蛋白质、脂肪和纤维素的降解效果,标号为X13细菌菌株对四类主要有机物分解效果俱佳,且分解效果系数>2。因此本研究选用对餐厨垃圾中四类主要的有机物降解效果俱佳的X13做进一步的菌种鉴定。
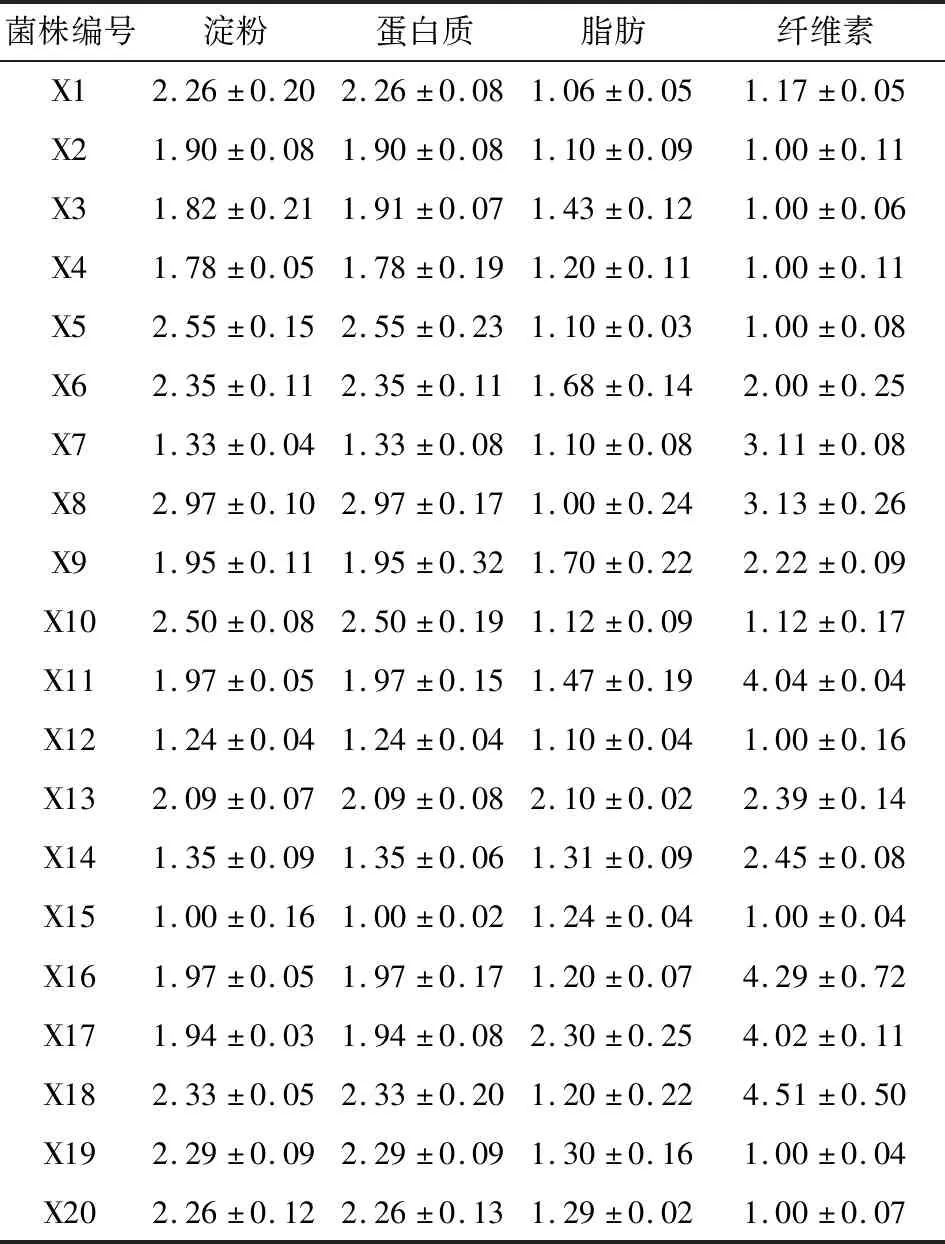
表2 全部菌株对淀粉、蛋白质、脂肪、纤维素的降解效果
2.3 菌种鉴定
2.3.1 形态学鉴定 菌株X13在LA培养基上的形态图特征为:菌落为白色,表面粗糙皱褶,边缘不整齐且较为扁平,无明显异味,见图1(a)。
2.3.2 生理生化鉴定 革兰氏染色:X13菌株经染色,脱色,在显微镜下该菌体都呈紫色,为革兰氏染色阳性见图1(b)。
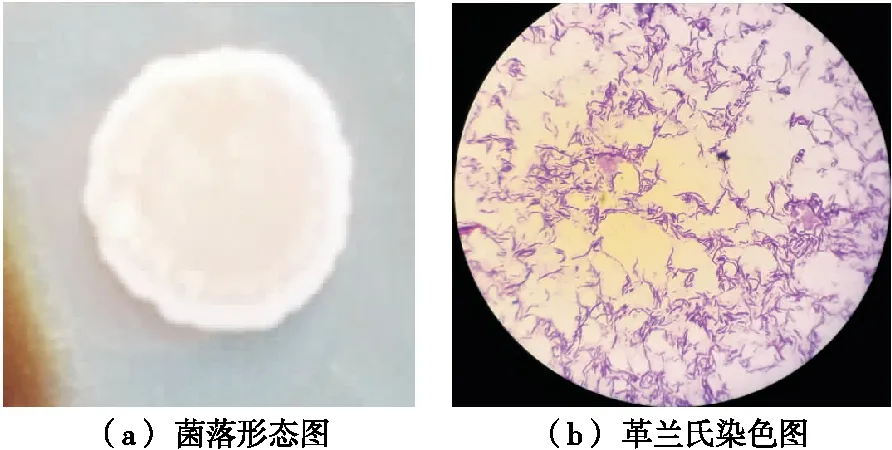
图1 X13菌落形态和革兰氏染色图
根据细菌的形态学鉴定方法[25],观察菌落的大小、表面特征、是否隆起、颜色、气味等形态学的特征,再根据革兰氏染色、过氧化氢酶和V.P试验等生理生化试验(表3)进一步判断,初步确定X13菌株为地衣芽孢杆菌(Bacilluslicheniformis)。

表3 生理生化试验结果†
† “+”表示试验结果为阳性,“-”表示试验结果为阴性。
2.3.3 基于分子生物学16S rDNA的鉴定 选用X13菌株rDNA长度为1 501 bp的片段进行16S rDNA的测序,测序结果在GenBank数据库中进行同源性比对,结果(表4)表明,细菌X13 菌株与GenBank中编号为KX785171.1的地衣芽孢杆菌(Bacilluslicheniformis)同源性最高,其相似度为100%,菌株X13的16S rDNA的PCR产物的琼脂糖凝胶电泳图见图2。
2.3.4 菌株生长曲线 根据图3生长曲线,菌株X13地衣芽孢杆菌的延滞期为极短,在第1个2 h区间内几乎可以忽略;在此后地衣芽孢杆菌进入对数生长期,其活菌数呈对数增长;在20 h后到达稳定生长期,在此期间活菌数最最高且不再增加;50 h后进入衰亡期,此后活菌数量开始下降。由此可知该地衣芽孢杆菌液体20 h活菌数达到最大,即确定为液体培养适宜时长。
2.3.5 餐厨垃圾降解 本试验中测得菌悬液离心前的浓度约为8×109CFU/mL,制备的餐厨垃圾水分含量约为22.21%。采用对有机物降解效果最优的菌株地衣芽孢杆菌制作的菌制剂处理自制的餐厨垃圾,55 ℃条件下在小型餐厨垃圾处理机中搅拌发酵48 h后,测得处理后的餐厨垃圾水分含量约为29.18%,餐厨垃圾减量化达到72.82%。

表4 X13菌株16S rDNA比对结果
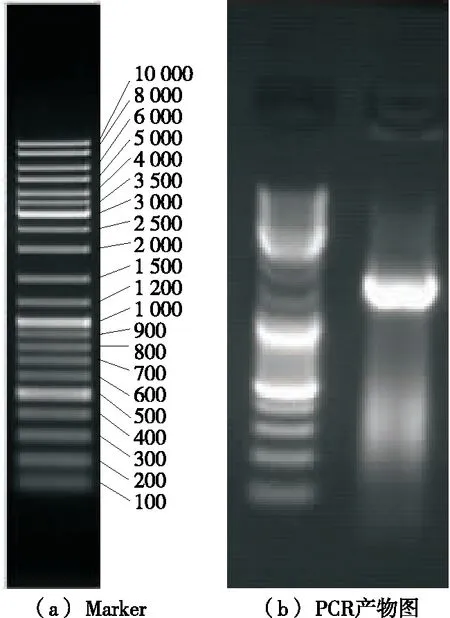
PCR长度为1 498 bp
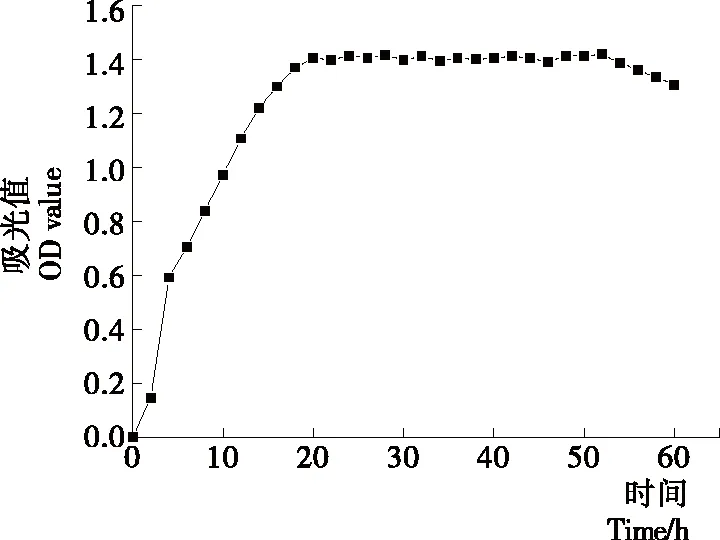
图3 地衣芽孢杆菌生长曲线
3 结论
本研究从餐厨垃圾中筛选出耐高温的细菌地衣芽孢杆菌(Bacilluslicheniformis),将其与载体配合制作成菌制剂,配合餐厨垃圾处理器使用48 h后,餐厨垃圾的降解率达到72.82%。与已有的研究[26-27]差异在于本研究获得的有效菌耐高温且对餐厨垃圾的降解效率高。因此,使用本研究筛选出的耐高温菌株地衣芽孢杆菌制作的菌制剂能够快速分解餐厨垃圾,有效缩短餐厨垃圾降解的时间,实现餐厨垃圾的有效减量化。此外,本研究中获得的地衣芽孢杆菌在较高的温度下能快速产生分解淀粉、蛋白质、油脂和纤维素的酶类,且在较高的温度下能加速生化反应的快速进行,与Aurepatipan等[28]和荆哲华等[29]的研究结果部分相似。
尽管降解餐厨垃圾中淀粉、蛋白质、脂肪和油脂四类主要有机物的微生物一般来说以细菌效果最好,但真菌和放线菌等也有一定的降解效率,后续研究将进一步筛选出耐高温且能高效降解餐厨垃圾的真菌和放线菌,与现有的菌株制成复合菌制剂,再配合餐厨垃圾处理器的各参数研究调试,实现餐厨垃圾的高效降解。
