糖尿病斑马鱼模型的建立与南极磷虾酶解物降血糖活性评价
2019-07-09章超桦
吉 薇 章超桦 宋 采
(1. 广东第二师范学院生物与食品工程学院,广东 广州 510303;2. 广东海洋大学食品科技学院,广东 湛江 524088;3. 圣彼得堡州立大学生物精神学实验室,俄罗斯 圣彼得堡 191036)
糖尿病是一种严重威胁人类健康和生命的代谢性疾病。目前治疗糖尿病的药物主要是人工合成的药物,有一定的毒副作用[1-2]。研究[3]表明,食物源的DPP-IV抑制肽不仅具有良好的降血糖效果,而且无毒副作用。南极磷虾蕴藏量巨大,潜在资源蕴量约6.0×108t。蛋白质含量高,单只虾的蛋白含量约为70.58%(干基),含有人体所需的全部必需氨基酸和一些具有生物活性的特殊氨基酸序列,是制备生物活性肽的良好资源[4]。DPP-IV抑制肽能直接抑制DPP-IV活性,降低GLP-1和GIP的降解速率,从而起到降血糖作用[5]。前期研究[6]证明,南极磷虾酶解物(AKEH)具有抑制DPP-IV的活性。
生物活性肽的体内活性评价主要采用动物模型来实现。以哺乳动物(大鼠、小鼠)为动物模型较为常见[7-8],这种模型虽然试验动物个体大,试验稳定性较好,但也有一定的缺点,如试验周期长,通常需要2~3个月,受试样品量大,动物发病后性情狂躁凶险等。斑马鱼具有体积小、与人类基因相似度高、建模周期短,受试物少等优点[9],作为建立糖尿病[10]、心血管疾病[11]、脂肪肝[12]、肾病[13]等模型的模式生物显示了非常大的潜力。
以斑马鱼为模式动物,建立糖尿病斑马鱼模型,已有相关报道。Gleeson等[14]采用2%的葡萄糖溶液浸泡的方式诱导斑马鱼产生2型糖尿病,但方法的诱导周期较长(28 d)。Capiotti等[15]采用0.111 mol/L葡萄糖溶液浸泡14 d的方法建立了斑马鱼的高血糖模型,诱导周期相对较短,但模型不稳定,而且葡萄糖浓度较高,容易造成斑马鱼死亡。Olsen等[16]通过腹腔注射链脲佐菌素方式来诱导斑马鱼持续高血糖,但是斑马鱼个体小,不易操作。王泽民[17]16采用3%葡萄糖浸泡和高脂食物喂养10 d 的方式建立高糖高脂模型,短时间摄入高糖高脂,容易造成斑马鱼的死亡。本研究采用联合葡萄糖溶液浸泡和胆固醇喂养的方法,建立糖尿病斑马鱼模型,并用该模型对3 000~100 Da AKEH的体内降血糖效果进行评价,旨在为寻求一种高产的具有降血糖功效的食品原料,同时也为南极磷虾资源的开发利用提供一定的指导依据。
1 材料与方法
1.1 材料与试剂
成年野生型(AB)蓝斑马鱼:购自湛江民享水族店;
胆固醇:纯度99%,阿拉丁试剂公司;
葡萄糖:分析纯,国药集团化学试剂有限公司;
Trizol试剂、PCR试验的相关耗材:广州齐云生物有限公司;
PrimeScriptTMRT Master Mix (RR036A)试剂盒、SYBER®Premix Ex TaqTMⅡ(RR820A)试剂盒:广州瑞真生物技术有限公司;
DPPIV/CD26试剂盒:欣博盛生物科技有限公司;
蛋白质试剂盒、胆固醇试剂盒、甘油三酯试剂盒:南京建成生物工程研究所;
葡萄糖试剂盒:苏州科铭生物有限公司。
1.2 仪器与设备
增力电动搅拌机:JB50-D型,上海精科仪器有限公司;
电子天平:BSA224S-CW型,赛多利斯科学仪器(北京)有限公司;
水族气泵:APE-960型,广东闽江水族实业有限公司;
高速组织研磨器:OSE-Y30型,天根生化科技有限公司;
核酸定量仪:SimpliNano型,美国GE公司;
PCR仪:SC300型,澳大利亚Kyratec公司;
荧光定量PCR:CFX型,伯乐生命医学产品有限公司;
离心机:Allegra X-30R型,贝克曼库尔特有限公司;
离心机:MLX-210迷你型,美国精骐有限公司。
1.3 南极磷虾酶解物的制备
南极磷虾原料与水等质量混合,添加动物蛋白水解酶237.6 U/g原料,调节pH值到7.6,45 ℃酶解3.8 h。根据张迪等[18]得到的南极磷虾酶解液脱氟工艺条件,在南极磷虾酶解液中加入21.5 mg/mL醋酸钙,用10 mol/L的NaOH调节pH到10,30 ℃反应140 min,4 000 r/min离心10 min得滤液备用。将滤液用200 nm孔径无机陶瓷膜进行分离。收集透过液依次通过3 000,100 Da的超滤膜,得到3 000~100 Da的超滤组分。冷冻干燥,备用。
1.4 糖尿病斑马鱼建模方法
1.4.1 斑马鱼的准备 提前3 d将自来水,用水过滤器过滤到储物箱,保持水温在(27±1) ℃。pH为7.0~7.4,通氧7.20 mg O2/L,昼夜循环为14 h光照/10 h避光[14]。将大小接近的黑色活泼斑马鱼连同原来的水缓慢地一起倒入预先准备好的过滤水中,前2 d禁食。第3天,斑马鱼对环境不紧张从容游动时,开始喂养,每天每条喂食0.003 g。喂养2 d即可开始后续试验。
1.4.2 斑马鱼饮食与喂养 糖尿病的主要特征是高糖高脂。高糖主要采用20 g/L的葡萄糖浸泡实现;高脂的实现是靠饲料中添加10 g/100 g的胆固醇喂养[17]16。随机将斑马鱼分为试验组(n=30)和对照组(n=30),每日投喂饲料2次(上午9点,下午6点),每次0.003 g。试验组每天用葡萄糖水浸泡,投喂添加胆固醇的饲料;对照组每天用系统水浸泡,投喂添加正常饲料;持续投喂20 d。每天换1次水。
1.5 3 000~100 Da AKEH的喂养
DPP-IV抑制肽的高剂量浓度是根据糖尿病斑马鱼浸泡10 min,头部无红色充血现象为依据,确定为5.40 g/L,中、低剂量组浓度的确定是在高剂量组的基础上成倍降低,确定中剂量组为2.70 g/L,低剂量组为1.35 g/L。随机将斑马鱼分成10组,每组40条。通氧7.20 mg O2/L,恒温(27±1) ℃,每条鱼每日正常饲料喂养0.003 g,清水饲养,每日上午10点,使用3 000~100 Da AKEH溶液浸泡糖尿病斑马鱼5 min,持续浸泡15 d。
1.6 指标评价方法
1.6.1 理化指标检测 斑马鱼放入冰水混合液中,1 min后取出超纯水清洗2次,取斑马鱼去除头部放入1.5 mL离心管中,加入相应缓冲液用组织研磨器将其匀浆。DPP-IV按照试剂盒说明测定;蛋白质采用BCA法测定;葡糖糖、甘油三酯(GPO-PAP酶法)、胆固醇(COD-PAP法)测定结果根据蛋白质含量推算。
1.6.2 实时定量PCR 根据理化指标检测前处理方法,在匀浆的鱼肉中加入TRIzol 裂解液,根据说明,提取RNA。使用Prime ScriptTMRT Master Mix (RR036A)试剂盒,按说明进行反转录;使用SYBER®Premix Ex TaqTMⅡ(RR820A)试剂盒,在冰上,按说明配制PCR反应液,包括正向和反向引物(表1)。依次加入到PCR反应的八连管中并混合,采用CFX荧光定量PCR仪检测。两步法进行PCR扩增。第一步:预变性95 ℃,30 s;第二步:39个循环(变性95 ℃ 5 s,60 ℃退火30 s,65 ℃延伸30 s)。

表1 基因检测引物列表†
†β-actin,Insa,Glucagon根据文献[17]20设计,Pck1由生工生物有限公司设计,4个基因都由生工生物有限公司合成。
1.7 数据分析
每组试验平行重复3次,基因表达水平计算采用CT法(2)[19],结果以(X±SD)表示,采用Excel 2013及SPSS 19.0(单因素ANOVA显著性分析)软件进行数据处理,用Origin 8.5进行绘图。
2 结果与分析
2.1 高糖高脂处理对斑马鱼理化指标的影响
由于斑马鱼体积较小,无法采集血液样本,直接将鱼体匀浆测定。用于糖尿病斑马鱼模型评价的理化指标主要有DPP-IV活性、葡萄糖、胆固醇和甘油三酯。DPP-IV抑制剂可以阻断DPP-IV酶发挥作用,使血糖保持正常水平,所以监测DPP-IV的活性,可以反映DPP-IV抑制剂的效果[20]。在糖尿病斑马鱼模型建立试验中,DPP-IV活性测定结果如图1所示。从图1中可以看出,未处理的斑马鱼,DPP-IV活性为43.56%。通过联合葡萄糖浸泡和胆固醇喂养方法饲养了20 d的斑马鱼,DPP-IV活性达到98.67%,斑马鱼DPP-IV活性增加了1倍多,说明通过联合葡萄糖和胆固醇饲养的方法可使DPP-IV活性增加,可侧面反映血糖升高。
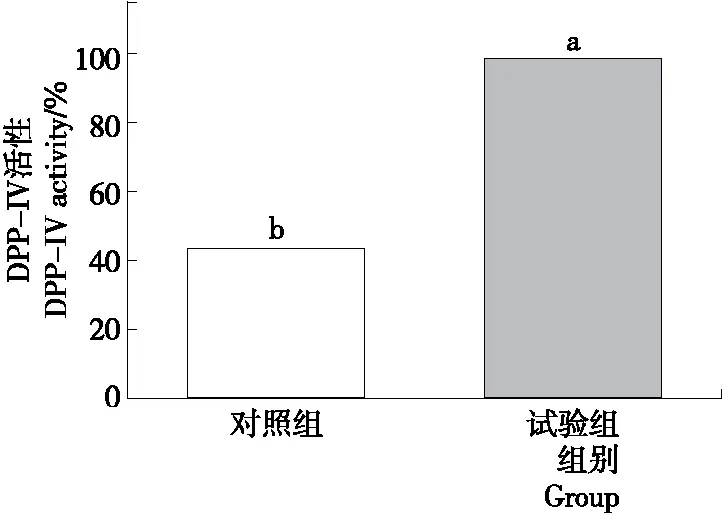
字母不同表示差异性显著(P<0.05)
虽然鱼体的葡萄糖、胆固醇和甘油三酯的水平与血液中的葡萄糖、胆固醇和甘油三酯的定量关系有待建立,但也可从侧面反映血糖的高低。图2中,试验组葡萄糖、甘油三酯及胆固醇含量分别为对照组的2.68,2.80,3.50倍,表明葡萄糖和胆固醇联合处理的方法能使斑马鱼出现高糖高脂的特征。Olsen等[16]根据斑马鱼体重,对其腹腔进行0.3%的STZ注射处理(350 mg/kg),每日1次,持续3周,结果表明,该方法能使斑马鱼空腹血糖值升高,非酶的糖化血清蛋白含量增加,胰岛素含量降低。王泽民[17]16-24采用3%的葡萄糖浸泡,10%的胆固醇鸡蛋喂养的方法,持续饲养10 d,根据胰岛素、胰高血糖素、葡萄糖、甘油三酯和胆固醇为指标,进行评价,相比空白组,试验组都有显著性差异,建立了糖尿病斑马鱼模型。本研究结果与这些研究结果相一致,证明糖尿病斑马鱼模型建模成功。
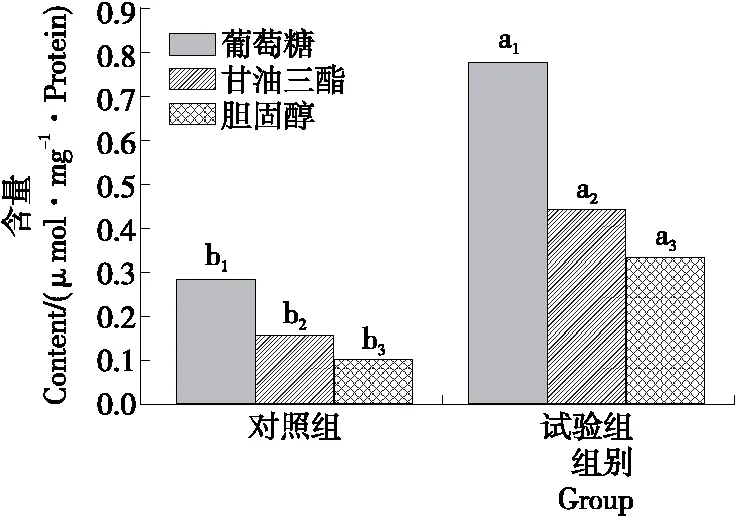
字母不同表示差异性显著(P<0.05)
2.2 高糖高脂处理对斑马鱼血糖相关基因表达水平的影响
胰岛素和胰高血糖素是人体血糖调控的一对重要激素。胰岛素基因有Insa、Insb两种类型。Insa基因的主要功能是控制葡萄糖的调节;Insb在生长发育中起到重要作用[21]。因此本研究考察斑马鱼Insa基因的表达水平。胰高血糖素通过腺苷酸环化酶来提高cAMP的水平,这样能够使磷酸烯醇丙酮酸羧激酶(PEPCK, phosphoenolpyruvate carboxykinase)的水平也相对提高。PEPCK有Pck1和Pck2两种,Pck1主要存在于细胞质中,Pck2主要存在于线粒体。Pck1是一种裂解酶,能限制糖质新生反应进程,阻碍葡萄糖类化合物的合成[10]。利用实时定量PCR检测了高糖高脂处理后的斑马鱼对Insa、Glucagon和Pck1基因的表达水平。从图3中可以看出,Insa基因的表达量较低,相比未处理的斑马鱼Insa基因表达量降低了50%左右。Capiotti等[15]采用0.111 mol/L 葡萄糖溶液浸泡14 d的方法诱导斑马鱼,结果表明眼部糖化蛋白增加,胰岛素mRNA水平也比处理前有所降低。撤去葡萄糖溶液后,斑马鱼的葡萄糖水平低于0.111 mol/L葡萄糖浸泡的斑马鱼,高于空白对照组。Glucagon基因和Pck1基因的表达量分别是原来的6.0,4.5倍。说明经过了葡萄糖和胆固醇处理组斑马鱼的血糖含量相比未处理的斑马鱼血糖含量是上升的。
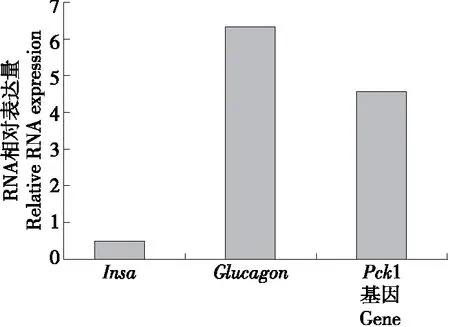
图3 糖尿病斑马鱼模型的基因表达相对水平图
考虑到本方法后续斑马鱼需要撤去葡萄糖溶液的环境,参考Gleeson等[14]14 d建立糖尿病斑马鱼模型的方法并对模型的稳定性进行了初步探究。本研究的建模时间在此基础上延长了6 d,更加保证了糖尿病斑马鱼模型的稳定性。综合理化指标和基因指标,采用20 g/L葡萄糖溶液浸泡和10%胆固醇喂养20 d的方法,能够建造糖尿病斑马鱼模型。
2.3 南极磷虾3 000~100 Da 酶解组分对糖尿病斑马鱼理化指标的影响
前期研究[5]得出南极磷虾酶解物具有DPP-IV抑制活性,其中3 000~100 Da的酶解组分对DPP-IV的抑制活性最高。在本研究中,以南极磷虾3 000~100 Da的酶解组分为材料,采用建立的糖尿病斑马鱼模型中来评价其降血糖效果,糖尿病斑马鱼经过15 d的南极磷虾3 000~100 Da 酶解组分浸泡后,对其DPP-IV活性和理化指标进行检测,结果见图4、5。从图4中可以看出,与阴性对照组相比,DPP-IV活性都有所降低,但都比阳性对照的DPP-IV含量高,中、低剂量组的DPP-IV活性无显著性差异,而高剂量组的DPP-IV活性有显著性降低,达到80.47%,降低了18.22%。结果表明,3 000~100 Da AKEH对糖尿病斑马鱼的DPP-IV具有一定抑制作用。
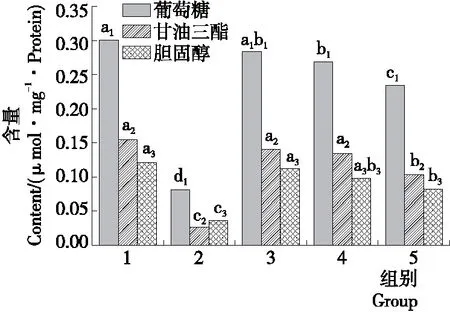
经3 000~100 Da AKEH浸泡后,糖尿病斑马鱼的葡萄糖、胆固醇和甘油三酯的含量如图5所示。从图5中可以看出,与阴性对照组相比,随着AKEH浓度的增加,各指标含量整体呈下降趋势。其中低剂量组的葡萄糖、甘油三酯、胆固醇含量与阴性对照组无显著性差异,中剂量组中,葡萄糖含量与阴性对照组有显著性差异,甘油三酯和胆固醇和阴性对照组无显著性差异。说明3 000~100 Da AKEH用低浓度浸泡糖尿病斑马鱼,降血糖功效不明显。而高剂量组葡萄糖、甘油三酯和胆固醇含量相比阴性对照组都有显著性降低,说明降血糖效果显著。综合理化指标,3 000~100 Da的高剂量组AKEH改善糖尿病斑马鱼的高血糖症状明显。研究结果与刘雪峰等[22]研究的杏仁多肽对糖尿病大鼠的降血糖活性结果相一致。
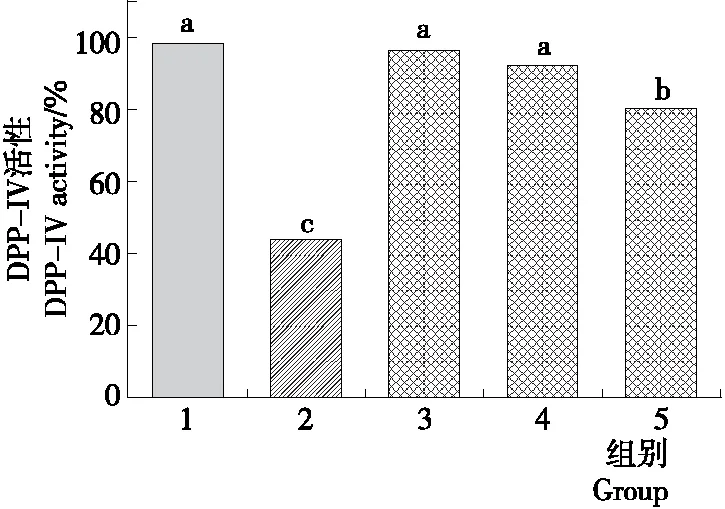
1. 阴性对照 2. 阳性对照(0.130 7 g/L 西格列汀) 3. 1.35 g/L 4. 2.70 g/L 5. 5.40 g/L
字母不同表示差异性显著(P<0.05)
图4 糖尿病斑马鱼3 000~100 Da AKEH处理15 d后DPP-IV活性测定
Figure 4 DPP-IV activity determination of diabetic zebrafish treated with 3 000~100 Da AKEH after 15 days
1. 阴性对照 2. 阳性对照(0.130 7 g/L 西格列汀) 3. 1.35 g/L 4. 2.70 g/L 5. 5.40 g/L
字母不同表示差异性显著(P<0.05)
图5 糖尿病斑马鱼经3 000~100 Da AKEH浸泡15 d后的理化指标
Figure 5 Physicochemical indexes of diabetic zebrafish treated with 3 000~100 Da AKEH after 15 days
2.4 南极磷虾3 000~100 Da酶解组分对糖尿病斑马鱼血糖相关基因表达水平的影响
糖尿病斑马鱼经3 000~100 Da AKEH浸泡15 d后Insa、Glucagon和Pck1 3个基因的实时定量PCR的结果如图6所示。糖尿病患者体内的胰岛素含量一般是维持在一个较低的水平。从图6(a)中可以看出,阴性对照的糖尿病斑马鱼组的Insa基因的表达量较低,随着AKEH浓度的增加,Insa基因的表达量都有不同程度的增加,其中,中、低剂量组相比阴性对照无显著性差异。高剂量组相比阴性对照有显著性差异,表达水平是处理前的1.563倍。胰高血糖素与胰岛素是相互拮抗的一对调节血糖的激素,因此Glucagon基因表达量越高,说明体内血糖越低,降血糖效果越好。从图6(b)中可以看出,随着AKEH浓度的增加,Glucagon基因的表达降低,Glucagon基因的表达量与3 000~100 Da AKEH浓度呈负相关关系。其中,相比阴性对照,中、低浓度的Glucagon基因表达无显著性差异;高浓度的Glucagon基因表达显著降低。PEPCK能限制糖质新生反应进程,阻碍葡萄糖的合成,所以葡萄糖含量越低,说明PEPCK含量越高,Pck1基因的mRNA表达量也越高Pck1基因与AKEH浓度呈负相关关系[图6(c)]。高浓度的3 000~100 Da AKEH处理后Pck1基因的表达水平是处理前的0.664倍。综合基因指标说明,低浓度的3 000~100 Da AKEH降血糖效果不明显,高浓度的3 000~100 Da AKEH具有较好的降血糖效果。Huang 等[19]采用风味酶酶解猪皮凝胶,将具有较强DPP-IV抑制活性的<1 kDa超滤组分进行大鼠动物试验,用<1 kDa 超滤组分以每天300 mg对糖尿病大鼠进行灌胃处理,饲养42 d后进行相关指标检测,血浆DPP-IV活性显示,试验组的DPP-IV活性(63.3%)与空白组的DPP-IV活性(112.4%)有显著性差异;试验组的血浆GLP-1水平也比未处理组有显著提高;胰岛素水平在DPP-IV抑制肽的作用下,能提升到2 mg/L;血浆胰高血糖素水平相比空白组,也有显著性降低。说明DPP-IV抑制肽能够提高GLP-1和胰岛素含量;能降低DPP-IV活性、胰高血糖素含量。
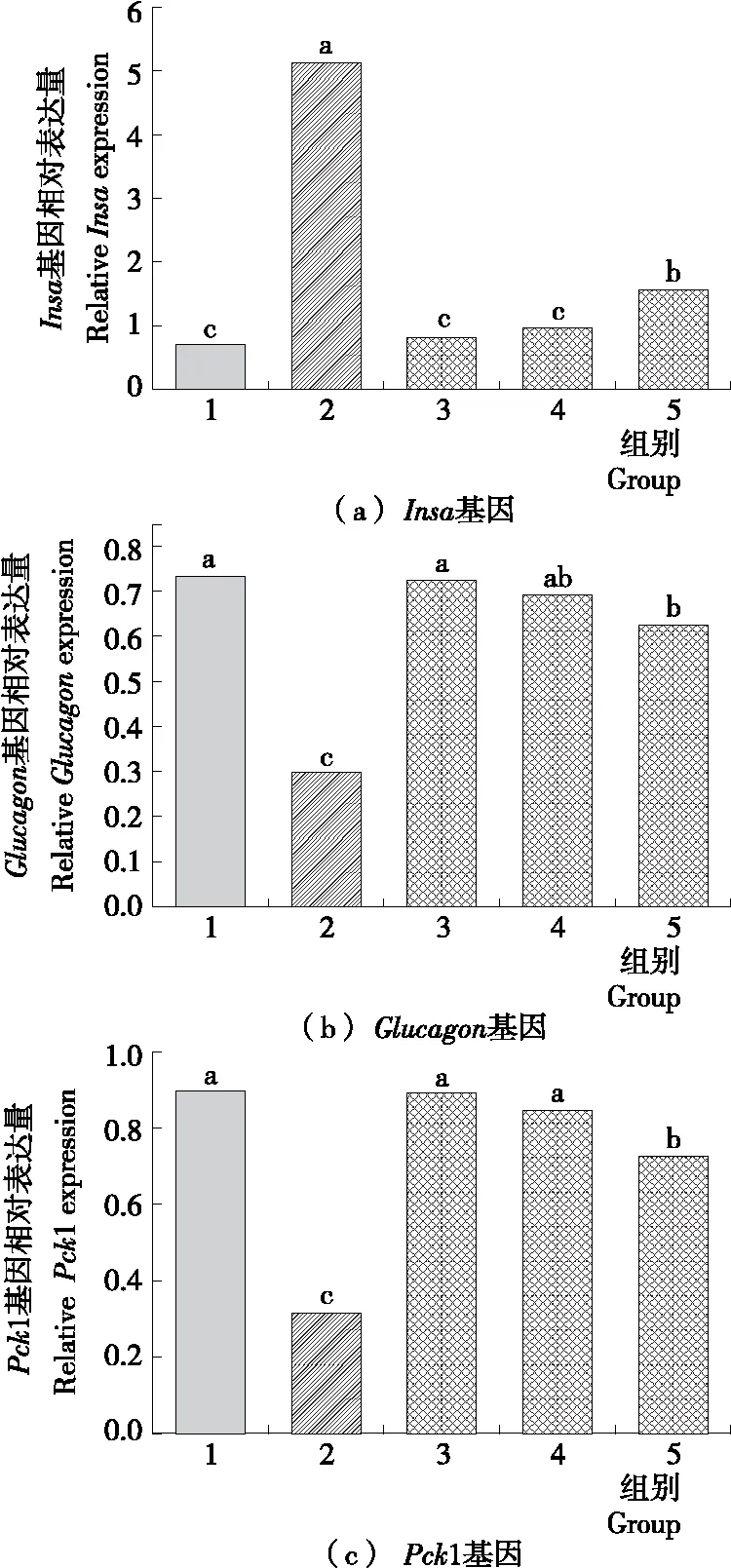
1. 阴性对照 2. 阳性对照(0.130 7 g/L 西格列汀) 3. 1.35 g/L 4. 2.70 g/L 5. 5.40 g/L
字母不同表示差异性显著(P<0.05)
图6 糖尿病斑马鱼经3 000~100 Da AKEH浸泡15 d后基因的相对表达
Figure 6 Relative Glucagon gene expression of diabetic zebrafish treated with 3 000~100 Da AKEH after 15 days
3 结论
通过联合20 g/L葡萄糖溶液浸泡和10%胆固醇喂养20 d的方法,快速建立了糖尿病斑马鱼模型,通过理化指标和基因表达水平的测定验证了该模型可靠性强。应用建立的糖尿病斑马鱼模型对3 000~100 Da AKEH的降血糖功效进行了评价,通过对糖尿病斑马鱼理化指标与血糖水平相关基因的水平检测,证实了高剂量(5.40 g/L)的3 000~100 Da AKEH具有一定的降血糖功效,表明了南极磷虾酶解物开发为降血糖产品原料的潜力,对于促进南极磷虾资源的开发利用具有重要意义。但AKEH如何在体内消化吸收和代谢,以及DPP-IV抑制肽的降血糖机制有待进一步的研究。
