脑梗死患者COX-1及COX-2基因多态性与阿司匹林抵抗的相关性分析
2019-07-09赵仕琪槐瑞雪史肖鹤李世平
李 霞,王 炜,赵仕琪,槐瑞雪,史肖鹤,李世平,董 梅
随着基因技术的飞速发展,越来越多的研究显示遗传因素可能与阿司匹林抵抗(AR)相关,阿司匹林为非选择性COX抑制剂,通过与环氧合酶(COX)不可逆乙酰化反应使酶失活,抑制花生四烯酸(AA)代谢,阻断血栓素A2(TXA2)介导的血小板聚集。阿司匹林对COX-1及COX-2两种同工酶均有不可逆抑制作用,但对COX-1的抑制强度是COX-2的170倍,故抗栓疗效主要取决于对COX-1的抑制程度。关于COX-1基因多态性已被广泛关注,国内外有文献报道,COX-1受体上-1676A>G及C50T、-A842G基因多态性可能与AR相关[1],但尚存在争议。COX-2属于诱生型酶,在动脉粥样硬化的慢性炎症过程中参与血栓形成。有研究报道,位于COX-2基因启动子区的-765G/C多态性可能与AR相关[2]。
脑梗死复发因素众多,关于AR基因多态性与脑梗死复发相关研究较少,本研究旨在探讨COX基因多态性与脑梗死患者发生AR的关系。
1 研究对象与方法
1.1 研究对象 采用前瞻性队列研究,选取2014年10月-2015年6月在河北医科大学第二医院神经内科住院的急性脑梗死患者,入选患者均行头部MR 1.5T检查证实有新发梗死灶。所有患者均签署知情同意书。共有70例患者进行血栓弹力图(TEG)检测和COX-1及COX-2基因分型。住院治疗稳定后,规律口服ASP 100 mg/d,半年后进行临床随访。通过门诊及电话随访。以患者发病时间为起点,进行6个月随访。主要终点事件是指脑梗死复发,次要终点事件包括脑出血、心肌梗死以及其他原因导致的死亡。排除标准:(1)短暂性脑缺血发作(TIA);(2)服用其他抗血小板药物或抗凝药;(3)有严重消化性溃疡或其他消化系统疾病;(4)血小板计数<100×109/L或>400×109/L、血红蛋白<90 g/L或>169 g/L;(5)有严重肝肾功能不全、恶性肿瘤、血液病、恶性高血压、严重感染及免疫系统疾病;(6)近期有活动性出血者;(7)房颤;(8)心源性脑梗死。剔除标准:(1)临床资料不全;(2)停药或间断服用ASP。
1.2 方法 初发缺血性脑卒中患者在规律服用ASP 100 mg/d 7 d后晨起空腹采肘部静脉血5 ml,存放于枸橼酸钠抗凝管,采用TEG-5000血栓弹力图仪(美国Haemonetics公司)及配套试剂检测。阿司匹林抵抗(AR)定义:TEG通过阿司匹林诱导剂花生四烯酸(arachidonic acid,AA),使用3个通道(高岭土、激活剂F和激活剂F+AA)进行检测。阿司匹林抑制率=(AA诱导的最大血凝块强度-纤维蛋白的最大血凝块强度)/(凝血酶诱导的最大血凝块强度-纤维蛋白的最大血凝块强度)×100%。阿司匹林抑制率<50%为AR,≥50%为阿司匹林敏感(aspirin sensitive)。根据TEG测定分为AS组(45例)和AR组(25例),对两组一般临床资料比较无统计学差异(P>0.05),具有可比性(见表1)。
1.3 基因提取及测序
1.3.1 DNA提取 采集患者晨起空腹肘静脉血2 ml,存放入枸橼酸钠抗凝管,应用DNA提取试剂盒(TIANGEN),提取全血DNA,-20 ℃保存。
1.3.2 聚合酶链反应(PCR)和DNA测序 COX-1、COX-2基因变异位点的数据获自HapMap中国汉族人群数据库。将最小等位基因频率(MAF)下限设为0.05,并以r2>0.8的原则从HapMap获得的变异位点中挑选tag SNP。COX-1上-A842G引物:上游5’-CGGTGGATGTGAGTCTAGCTAC-3’,下游5’-GTATTCTCATCTATAAAATCGGCTT-3’,扩增长度208 bp。COX-1 C50T引物:上游5’-CGGTGGATGTGAGTCTAGCTAC-3’,下游 5’-GTATTCTCATCTATAAAATCGGCTT-3’,扩增长度212 bp。COX-1-1676A>G引物:上游5’-CGGTGGATGTGAGTCTAGCTAC-3’,下游5’- GTATTCTCATCTATAAAATCGGCTT-3’,扩增长度250 bp。COX-2上-765G/C引物:上游 5’-CGGTGGATGTGAGTCTAGCTAC-3’,下游5’-GTATTCTCATCTATAAAATCGGCTT-3’,扩增长度297 bp。将PCR产物送于上海生工生物工程股份有限公司进行DNA测序检测。

2 结 果
2.1 SNP检测结果
2.1.1 Hardy-Weinberg平衡检验 对70例患者DNA进行检测,未发现COX-1 C50T及-A842G基因位点多态性。-1676A>G位点中,22例为AA纯合子,38例为AG杂合子,10例为GG突变纯合子,-1676G等位基因频率为41.43%。COX-2基因-765G/C位点中,61例为GG纯合子,9例为GC杂合子,未发现CC突变纯合子,-765C等位基因频率为6.43%。COX-1基因-1676A>G及COX-2基因的-765G/C位点等位基因频率符合Hardy-Weinberg平衡,表明所选样本具有群体代表性(见表2)。
2.1.2 COX-1基因-1676A>G位点及COX-2基因-765G/C位点基因型分布结果 AR组和AS组COX-1基因-1676A>G位点,其G等位基因携带两组比较无统计学差异[76.0% vs 62.2%;P=0.24;OR1.92(0.64~5.76)];COX-2基因-765G/C位点C等位基因携带,AR与AS组间差异无统计学意义(24.0% vs 6.7%;P=0.089;OR4.42(0.99~19.58)](见表3)。
2.2 临床随访结果
2.2.1 随访结果 70例初发脑梗死患者规律服用阿司匹林的半年随访期间,共发生12例(17.14%)不良事件,其中主要终点事件8例(11.4%),次要终点事件4例(5.7%):包括脑出血2例(2.9%)、非致死性心肌梗死1例(1.4%)及死亡1例(1.4%)。AS组与AR组两组终点事件发生率比较结果显示:脑梗死复发患者AR发生率高,具有统计学差异(24.0% vs 4.4%;P=0.021)(见表4)。
2.2.2 随访结果与rs1330344、rs20417基因型比较 COX-2 -765G/C基因携带C等位基因与临床主要终点事件脑梗死复发进行比较,差异无统计学意义[33.3% vs 8.20%;P=0.099;OR5.6(1.06~29.47)];COX-1 -1676A>G其G等位基因携带与脑梗死复发无相关性[14.9% vs 4.35%;P=0.367;OR0.26(0.03~2.25)](见表5)。

表1 基线资料比较
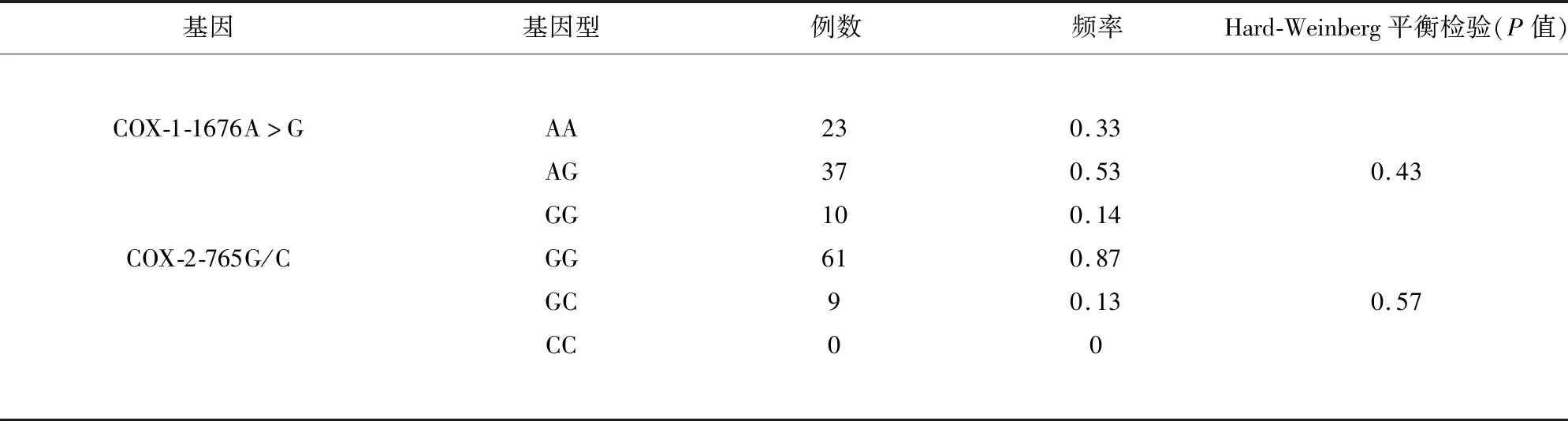
表2 所选位点的基因型频率分布及Hard-Weinberg平衡检验

表3 COX-1-1676A>G及COX-2-G765C位点基因型在AS组与AR组比较 [例数(%)]

表4 随访期间两组终点事件发生率比较[例(%)]
AS:阿司匹林敏感;AR:阿司匹林抵抗*P<0.05

表5 rs1330344、rs20417基因型与临床预后比较[例(%)]
3 讨 论
本实验共纳入70例研究对象,根据TEG检测分为AS和AR组,并进行为期半年的随访,研究发现AR组主要终点事件脑梗死复发(6例)较AS组升高,两组具有统计学差异(P<0.05),研究显示AR与脑梗死复发相关。随着基因技术的突破进展,从分子流行病学角度研究基因变异对心脑血管疾病的影响及其防治开辟了新的途径。越来越多的证据表明,阿司匹林抵抗(Aspirin Resistance,AR)与遗传的基因易感性相关,在人群中筛选有关AR的易感性基因对高危人群的识别及防治具有重要意义。
AR发生的机制复杂且影响因素众多,一些临床相关因素如性别、吸烟、急性冠脉综合征(ACS)、肥胖、糖尿病、肾功能不全等,可能影响患者基线状态下血小板活性从而影响抗血小板治疗反应性。本实验进行前对AR及AS组的临床基线资料进行比较,无统计学差异。排除了基线状态下混杂因素对阿司匹林敏感性干扰,旨在重点探讨COX-1、COX-2基因对阿司匹林疗效的影响。
本研究选取了COX-1基因的3个SNP位点,包括-A842G、C50T及-1676A>G以及COX-2基因-765G/C位点。COX-1基因-A842G位点位于COX-1基因的启动子,研究发现G等位基因(-842G)可以提供一个额外的结合位点给转录因子激活蛋白(AP2)启动子区域,阻断血小板中COX-1的表达,导致阿司匹林快速抑制COX1酶活性,增加阿司匹林敏感性[4]。它的变异可能影响COX-1的基因表达及阿司匹林的药物疗效,Ulehlova等[5]对捷克124例急性心肌梗死患者进行研究结果表明AR与COX-1-842G等位基因相关,其G等位基因的最小等位基因频率为7.26%,而徐旭等[6]对中国心脑血管患者群进行研究发现,COX-1基因-842G与阿司匹林低反应性无明显相关,Jalil等[7]研究表明中国、马来西亚和印度人群均没有COX-1基因-842G等位基因多态性。COX-1 C50T基因片段位于17位点,是调节阿司匹林治疗反应程度的决定性因素,与-A842G位点呈完全连锁不平衡,研究发现C50T基因变异在亚洲人群发生率极低,Yi等[8]研究发现中国脑梗死COX-1基因C50T等位基因杂合子仅5.8%,与AR无相关性。同样Weng等[9]及Mukarram等[10]研究显示C50T多态性与AR无明显相关性,本研究选取70例进行A-842G及C50T基因测序结果显示未发现野生杂合子及纯合子型。与既往发表的文献一致,结果显示急性脑梗死患者阿司匹林抵抗与-A842G/C50T无相关性。
而COX-1-1676A>G基因(rs1330344)位于启动子区,该等位基因在中国汉族人群中发生率很高。中国老年心血管疾病患者中,COX-1基因-1676A/G携带G等位基因 (rs1330344)变异体与阿司匹林耐药性显著相关。Fan等[11]对中国人群进行研究分析显示-1676A>G其G等位基因频率高达40%,证实携带G等位基因与AR相关,曹丽萍等[12]研究发现-1676A>G基因突变型与服用阿司匹林缺血性事件发生显著相关。可能与GG基因型上调COX-1 RNA及蛋白质表达增加,从而增加TXA2合成,促进血小板聚集,介导血栓形成过程。本研究结果显示70例患者中发现GG型10例(14.2%)、AG型37例(52.9%)、AA型23例(32.9%),其G等位基因频率为41.43%,与汉族人种变异基因型GA+GG发生率相近,本研究发现AR组GG+AG基因型频率达76%,高于AS组(62.2%),但两组无统计学差异;对70例患者进行随访发现主要终点事件脑梗死复发其GA+GG基因型频率达87.5%,未复发组达64.5%,两组无统计学差异。由于样本量较少,尚不能验证AR及缺血性不良事件发生与携带G等位基因相关。
COX-2基因位于1号染色体上,有10个外显子,许多研究人员发现它与阿司匹林的疗效有显著的相关性[13]。阿司匹林对其抑制作用是COX-1的170倍。90%的TXA2抑制被认为是阿司匹林潜在的抗血栓活性。而位于启动子区域的rs20417(-765G/C)与阿司匹林的应答显著相关[14]。Sharma等[2]人在一项包括450名缺血性脑卒中患者的研究中发现,COX-2-765G/C多态性C等位基因与缺血性脑卒中患者阿司匹林耐药性之间存在显著相关性。另一项Yi X等[15]研究发现COX-1(rs3842787)和COX-2(rs20417)变异型相互作用与阿司匹林耐药性显著相关。本研究结果显示70例患者中携带C等位基因突变率达12.9%,其中C等位基因携带在AR组为24%;在AS组为6.7%(P>0.05)。本研究显示AR组C等位基因携带的频率明显高于AS组,对携带C等位基因患者主要重点事件脑梗死复发进行比较,其携带异位基因的终点事件发生比例较高,但两组比较无统计学差异,可能跟研究的样本量较少有关系。
本研究在后续研究过程中会加大样本量,进一步验证COX-1-1676A>G基因以及COX-2-765G/C基因是否作为脑梗死患者发生AR的易患基因,并选取其他SNP位点,进一步全面了解AR的基因变异特性,为临床治疗提供新的平台。
