多组学技术揭示葡萄叶片响应灰葡萄孢菌侵染的抗性机制
2019-07-08方献平和雅妮奚晓军查倩张丽勍蒋爱丽
方献平,和雅妮,奚晓军,查倩,张丽勍,蒋爱丽
(上海市农业科学院林木果树研究所,上海 201403)
由灰葡萄孢菌(Botrytis cinerea)侵染植株引起的灰霉病是葡萄生产过程中的一类重要病害[1]。该菌在土壤或宿主中能够以菌丝或菌核形式休眠越冬,在春季温度适宜、湿度较高的条件下往往可迅速萌发形成大量孢子。真菌孢子可在风雨媒介等因素影响下,进一步感染葡萄叶片、叶柄和花穗等部位,从而在葡萄植株中广泛传播;在适宜的气候条件下,孢子能在发病的葡萄组织处快速增殖和分生出新的孢子,从而急剧加重被感染植株的病情[2-3]。当前针对灰霉病的防控主要以药剂防治为主,但面临着成本高和环境污染等一系列问题。
随着现代生命科学技术的发展,许多研究者纷纷借助不同的生物技术手段对植物-病原菌互作机制进行了探索。蛋白质组学是研究生物体内整体蛋白质组成成分及其变化规律的学科,能直接在蛋白表达水平上揭示生物变化的动态规律。蛋白质组学作为挖掘抗病基因工作中一种重要的功能基因筛查技术手段,在包括拟南芥、烟草和葡萄等多种作物的植病互作机制研究中已经得到了极为广泛的应用[4]。MUKHERJEE等通过二维电泳的方法在拟南芥中分离得到11个受黑斑病菌侵染而发生显著变化的蛋白,其中病程相关蛋白PR4、糖基水解酶及抗菌蛋白等在黑斑病菌侵染后表达水平显著上调,这些蛋白/基因可能对拟南芥抵御黑斑病菌的侵染起到一定的防御作用[5]。YAO等通过差异荧光凝胶电泳的方法研究葡萄与白粉病菌互作的过程,筛选得到了多种抗病相关蛋白,如PR类蛋白、NBS-LRR类膜上受体等[6]。在植病互作研究过程中,代谢组学研究手段往往能通过明确植物感染病菌前后代谢分子的变化规律,从而找到相关的代谢路径和关键蛋白/基因,为功能机制的探讨提供思路[7]。借助代谢组学研究方法,BATOVSKA等在葡萄叶片中鉴定了响应白粉病菌和霜霉病菌的一类重要代谢标志物——脂肪酸[8]。VON等借助代谢组学技术在拟南芥中找到葡糖基转移酶的底物——异亮氨酸,从而进一步揭示了茉莉酸信号途径在白粉病菌防御过程中的重要性[9]。
随着生物物理和分析化学等多学科技术的交叉融合,基于液相色谱-质谱联用的蛋白分离鉴定手段已经逐渐取代凝胶电泳技术,成为蛋白质组学研究中的主流研究方法[4,10-11]。基于液质联用的代谢物分离鉴定技术也在代谢组学研究中得到非常广泛的应用[12-15]。然而,单一组学研究得出的结论可能还不够全面,因此借助多组学技术有利于进一步解决单一组学研究中可能出现的片面性问题[16-17]。
因此,本研究以灰葡萄孢菌高抗葡萄品种叶片为试验材料,利用基于液质联用的非标记定量蛋白质组学和非靶向定量代谢组学技术比较其响应灰葡萄孢菌侵染的蛋白质和代谢物表达差异,并采用基于多层组学整合的生物信息学方法,对响应病菌侵染的差异蛋白和代谢物变化水平进行深入比较分析,挖掘抗性品种显著变化的信号通路,探索葡萄对灰葡萄孢菌的抗性机制,为今后抗病基因克隆和分子育种奠定重要的研究基础。
1 材料与方法
1.1 试验材料及取样
试验用葡萄品种‘申丰’和‘巨峰’由上海市农业科学院林木果树研究所葡萄生产基地提供。灰霉病菌株从感病的葡萄植株中分离,并通过形态学和序列分析进行鉴定,以0.001%体积比的吐温80为溶剂制成浓度为5.0×106U/mL的孢子悬液,喷洒于葡萄植株叶部进行病菌感染。同时,设模拟处理组,喷洒液为0.001%体积比的吐温80。真实接菌或模拟处理后将植株移入气候室继续生长,保持温度20℃,湿度90%,3 d后取叶片作为试验材料。每5株幼苗叶片组织取样混合作为1个生物学重复,蛋白质组每个样本设3个生物学重复;考虑到代谢物成分的复杂性和不稳定性,代谢组试验要求更严格,每个样本设5个生物学重复。
1.2 非标记定量差异蛋白质组学试验
1.2.1 蛋白质的提取及定量
称取1.5 g新鲜叶片,研磨成细粉,分装入1.5 mL离心管中,加入1 mL左右蛋白提取液Ⅰ(含10%三氯乙酸和0.07%β-巯基乙醇的丙酮溶液)沉淀粗蛋白(-20 ℃,1 h),在4 ℃、1.3×104r/min条件下离心20 min。再加入相同体积的蛋白提取液Ⅱ(含0.07%β-巯基乙醇的丙酮溶液)悬浮粗蛋白(-20℃,1 h),在4℃、1.3×104r/min条件下离心20 min。真空抽干得粗蛋白干粉。称取50 mg粉末,加入1 mL裂解液(8 mol/L尿素、10 mmol/L二硫苏糖醇、2 mmol/L乙二胺四乙酸和1 mmol/L苯甲基磺酰氟)中,振荡混匀,4℃放置1 h,其间取出振荡3~5次,在20℃、1.3×104r/min条件下离心15 min,弃沉淀,取上清液。用Bradford法进行蛋白质定量,并用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测总蛋白提取质量,分装,于-80℃条件下保存,备用。
1.2.2 还原烷基化、胰酶酶解与C18柱除盐
取约100 μg蛋白样本进行酶解,按1∶10体积比加入100 mmol/L二硫苏糖醇至终浓度为10 mmol/L,在56℃条件下还原反应1 h。冷却至室温后,按1∶10体积比加入500 mmol/L碘代乙酰胺至终浓度为50 mmol/L,避光反应45 min。按1∶10体积比加入100%的三氯乙酸至终浓度为10%,4℃沉淀2 h;用冷丙酮洗3次后离心得沉淀颗粒,溶于100 mmol/L NH4HCO3中,超声5 min。按酶与蛋白质量比1∶50加入胰蛋白酶,37℃反应12 h。酶解后的肽段经德国Qiagen公司的C18固相萃取柱除盐后,进行真空干燥。
1.2.3 液相色谱-质谱联用与数据库搜索鉴定
真空干燥后的肽段用0.1%甲酸水溶液溶解,之后使用EASY-nLC 1000超高效液相系统(Thermo Fisher Scientific公司,美国)进行分离。流动相A为含0.1%甲酸和2%乙腈的水溶液;流动相B为含0.1%甲酸和98%乙腈的水溶液。液相梯度设置:5%~8%,6 min;8%~30%,34 min;30%~60%,5 min;60%~80%,3 min;80%,7 min平衡;80%~5%,3 min;5%,7 min平衡。流速维持在200 nL/min。肽段经由超高效液相系统分离后被注入离子源中进行电离,然后于Q ExactiveTM质谱系统中进行分析。二级质谱数据使用Proteome Discoverer 1.4软件检索Uniprot葡萄蛋白数据库(https://www.uniprot.org/proteomes/UP000009183),在数据库中加入常见的污染库,用于消除鉴定结果中污染蛋白的影响。借助Thermo Fisher Sieve 2.2软件对差异表达蛋白进行相对定量,以峰面积作为每条肽段的定量值,差异定量标准必须满足某个蛋白至少在2个生物学重复中被鉴定到,且接菌组蛋白质/模拟组蛋白质>1.50或<0.67,P<0.05,CV<30%。
1.2.4 差异蛋白的信息注释、功能分类与功能富集
利用Uniprot蛋白数据库(http://www.ebi.uniprot.org)对所鉴定到的各差异蛋白进行基因本体(gene ontology,GO)分析,依据蛋白参与的生物学过程、细胞学组分和分子功能属性,对葡萄响应灰霉菌感染的差异蛋白进行GO注释和功能分类。以鉴定到的蛋白质为背景,分别进行GO富集和京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。
1.3 非靶标定量差异代谢组学试验
1.3.1 葡萄叶片代谢物的提取及定量
称取40 mg经液氮碾磨之后的叶片样品,加入800 μL预冷的0.1%甲酸甲醇溶液,立即充分涡旋30 s,然后持续超声破碎30 min,接着在4℃、1.2×104r/min条件下高速离心15 min。小心取出离心管,移取200 μL上清液,经0.22 μm细菌过滤器过滤后,转入进样小瓶中。
1.3.2 液相色谱-质谱联用分析
代谢组试验所用的仪器分析平台为高效液相色谱Ultimate 3000,质谱仪为 Orbitrap Q-Exactive,分离色谱柱为Hypergod C18(100 mm×4.6 mm,3 μm)(Thermo Fisher Scientific公司,美国)。色谱分离条件为:柱温40℃,流速0.3 mL/min;流动相A(0.1%甲酸水溶液)和B(0.1%甲酸乙腈溶液)。梯度洗脱程序为:95%,2 min;95%~5%,10 min;5%,3 min;5%~95%,2 min。流速维持在0.3 mL/min,进样量为4 μL,自动进样器温度4℃,在正负离子模式下各扫描1次。
1.3.3 数据处理、代谢物定性定量与代谢通路富集分析
原始数据经Thermo Fisher Sieve 2.2软件进行基线过滤、峰识别、积分、保留时间校正、峰对齐和归一化分析处理。采用多维分析和单维分析相结合的办法,筛选组间差异代谢物,筛选的标准为该软件中的一般变量权重值(variable important in projection,VIP)大 于 1,P<0.05。 基 于 Metlin、KEGG、KNApSAcK和HMDB等公共数据库及自建数据库,采用Thermo Fisher Sieve 2.2软件对代谢物进行定性分析。借助Thermo Fisher Sieve 2.2软件对差异代谢物进行相对定量,以峰面积作为每种代谢物的相对定量值,差异定量标准必须满足某个代谢物至少在3个生物学重复中被鉴定到,且接菌组蛋白质/模拟组蛋白质>1.50或<0.67,P<0.05,CV<30%。对满足条件的目标差异代谢物进行KEGG代谢通路富集分析。
1.4 差异蛋白质组和代谢组联合分析
利用KEGG数据库对差异蛋白和代谢分子参与的信号通路进行联合分析:一方面,根据差异蛋白及差异代谢物的KEGG路径分析结果,寻找其共同参与的路径,进行后续综合分析;另一方面,通过ID转换,将蛋白和代谢物ID统一转换为KEGG格式,然后映射到KEGG数据库,获取其整合的路径图形,直观地展现分析结果。
2 结果与分析
2.1 葡萄叶片在接种灰葡萄孢菌前后的病症变化
葡萄品种‘申丰’叶片在模拟接种后未见任何病症,在真实接种灰葡萄孢菌3 d后仅出现个别极微小病斑,而‘巨峰’在真实接菌3 d后出现了较为明显的病斑(图1),反映出葡萄品种‘申丰’对灰葡萄孢菌极强的抗性。本研究仅对模拟和接菌3 d的‘申丰’叶片进行了比较多组学分析。
2.2 葡萄叶片差异应答蛋白质的定性与定量
本研究在每一个生物学重复中都鉴定到了2 400个以上的蛋白质(图2A~B)。模拟组中3次生物学重复试验总共鉴定到3 285个蛋白质(图2A),接菌组中总共鉴定到3 481个蛋白质,取得了比较全面的鉴定结果(图2B)。在差异蛋白质定量比较中,我们采取非常严格的筛选策略,须同时满足以下2个条件:1)某个蛋白质至少在各组样本的2次生物学重复中被鉴定到。模拟组和接菌组中分别有2 396和2 602个蛋白满足此要求,其中2 092个蛋白质在2组样本中被共同鉴定到(图2C)。2)在差异表达蛋白质中,满足接菌组蛋白质/模拟组蛋白质>1.50或<0.67,P<0.05,CV<30%,才能被界定为显著差异表达。经过这2个条件筛选,有304个蛋白质在病菌处理后表达消失,510个蛋白质表达新增,而在2 092个共性蛋白质中只有358个蛋白质表达发生显著上调,202个蛋白质表达发生显著下调(图2C)。这些发生消失或新增的差异蛋白质和显著上下调的共性蛋白质共计1 374个,在本研究中被界定为显著差异表达蛋白质,其中差异表达3.0倍以上的共性蛋白质如表1所示。

图1 模拟和真实接种灰葡萄孢菌3 d后‘申丰’‘巨峰’葡萄叶片的病症变化Fig.1 Symptom of Vitis vinifera cultivar‘Shenfeng’and‘Jufeng’leaves induced by mock and B.cinereainfection for three days

A.模拟接种组中3次重复试验的蛋白鉴定情况;B.真实接菌组中3次重复试验的蛋白鉴定情况;C.模拟与接菌样本蛋白组鉴定情况。A.Summary of the identified proteins in three repeated experiments of mock-infected samples;B.Summary of the identified proteins in three repeated experiments of B.cinerea-infected samples;C.Diagram of total proteins identified in mock-and B.cinerea-infected samples.
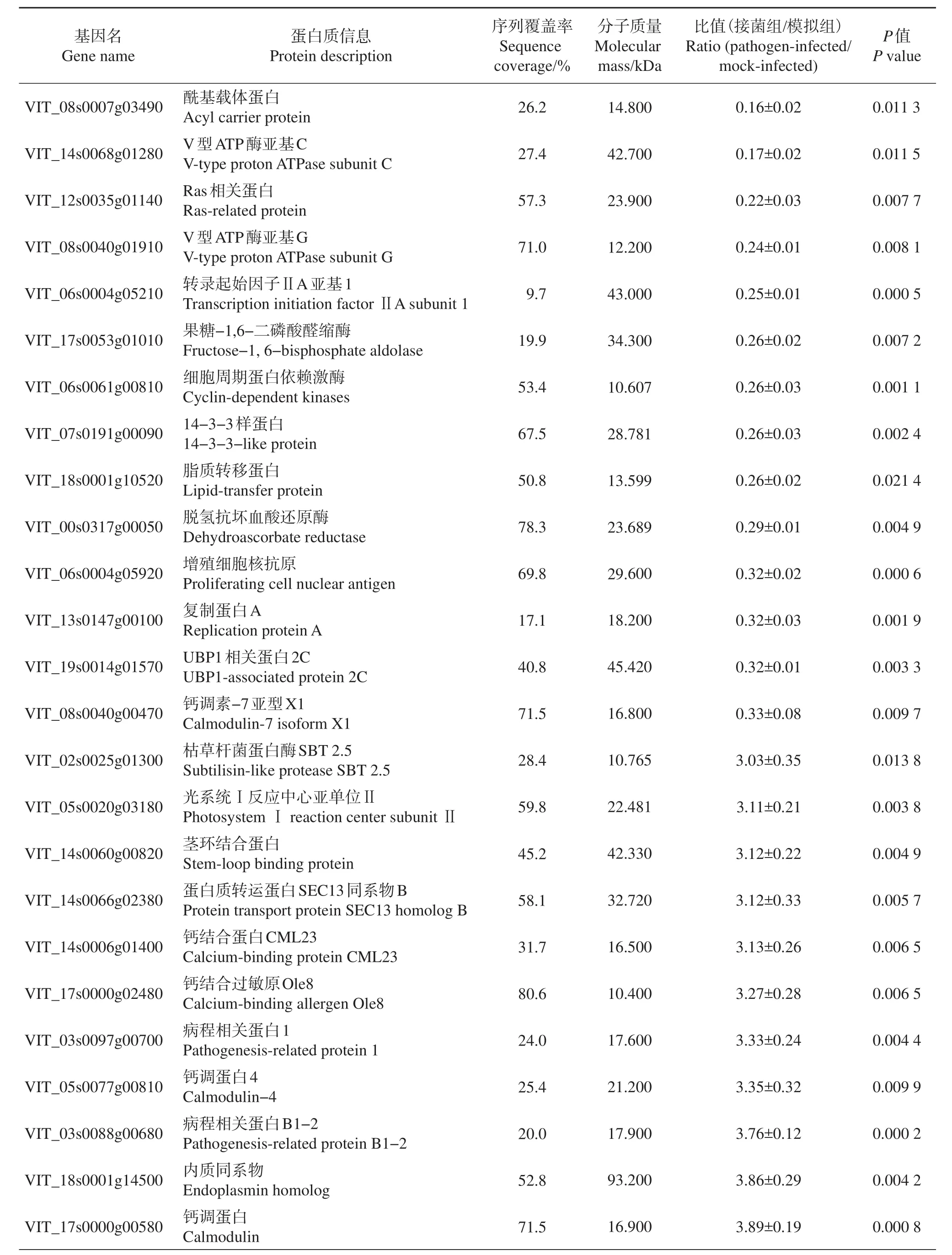
表1 葡萄叶片差异表达3.0倍以上的蛋白质定量信息Table 1 Quantitation information of differentially expressed proteins for more than three folds
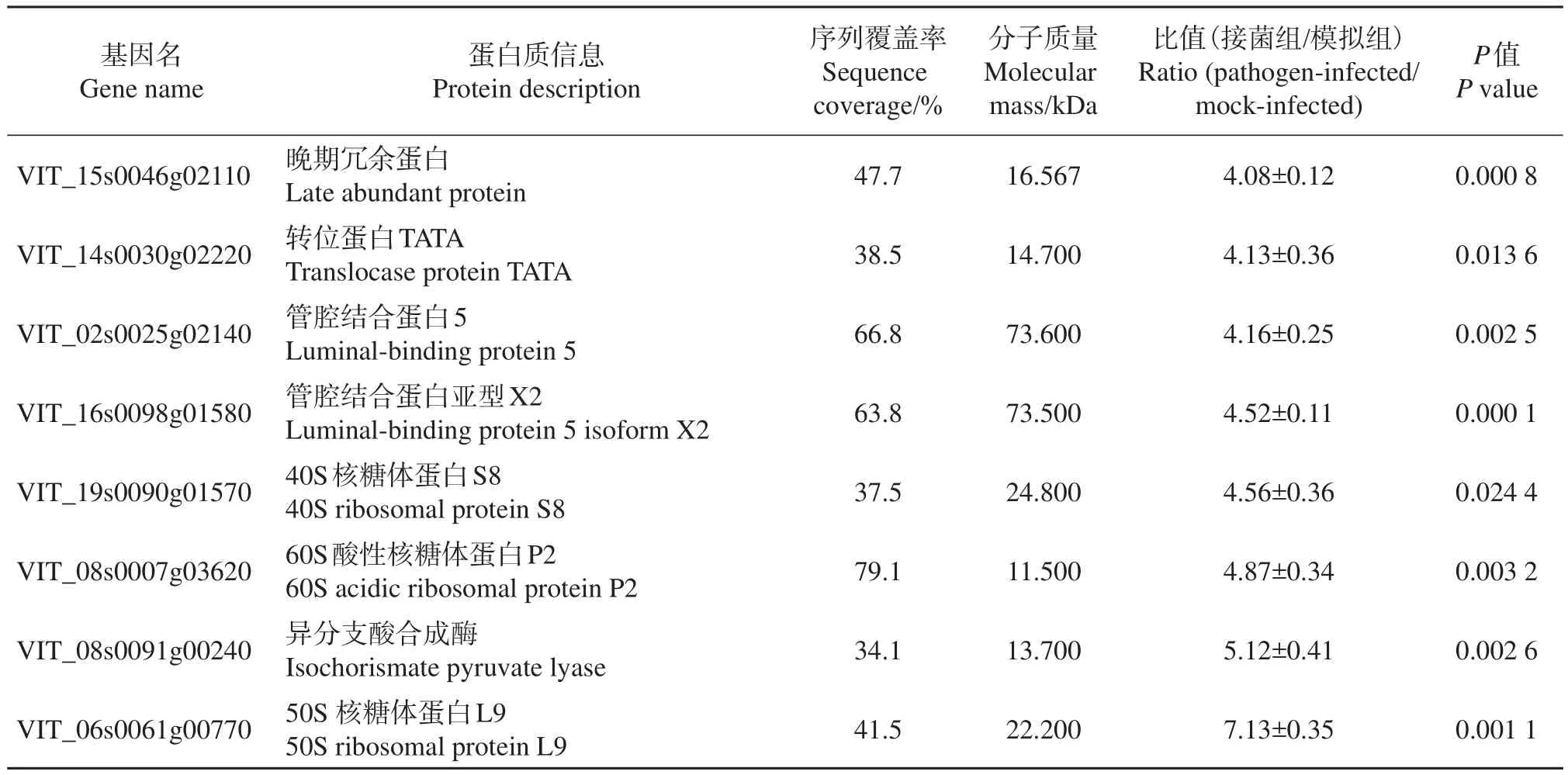
续表1 Continuation of Table 1
2.3 差异表达蛋白质的功能分类
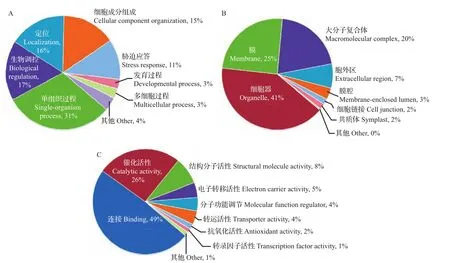
图3 差异表达蛋白质的GO功能归类分析Fig.3 GO functional category analysis of differentially expressed proteins
对1 374个差异蛋白质进行GO功能分类(图3)发现:在生物学进程中,生物学调控、定位和胁迫应答等过程占据了较大比例,分别为17%、16%和11%;在细胞成分分析中,较多差异蛋白质位于各种形式细胞器(41%)和细胞膜(25%)中,且往往参与了大分子复合体(20%)的组成;而在分子功能的分类中,连接活性(49%)和催化活性(26%)占比较高。
2.4 差异表达蛋白的功能与代谢通路富集分析
本研究以鉴定到的蛋白为背景,分别进行了GO富集和KEGG通路富集分析。GO富集分析显示:叶绿体、核酮糖-1,5-二磷酸羧化酶活性和氧化还原过程3个子集的富集程度最高(图4A);除了以上3个子集之外,质体、氧化还原活性和单位代谢过程等子集的富集程度都排在了各个二级注释的前列位置。KEGG富集分析显示,植病互作过程、核糖体和MAPK信号通路的富集程度都比较高(图4B),预示这几条路径改变最为明显。
2.5 差异代谢物的筛选和定性定量分析
我们采用多维分析和单维分析相结合的办法,来筛选组间差异代谢物,并结合Metlin、KEGG、KNApSAcK和HMDB等多种公共数据库进行定性分析,共鉴定和定量筛选到64种差异代谢物。其中,变化倍数为接菌组蛋白质/模拟组蛋白质>1.5或<0.67的差异代谢物有33种(P<0.01)(表2)。

图4 差异表达蛋白质的GO功能(A)和KEGG代谢通路富集(B)分析Fig.4 GO function(A)and KEGG pathway enrichment(B)analysis of differentially expressed proteins
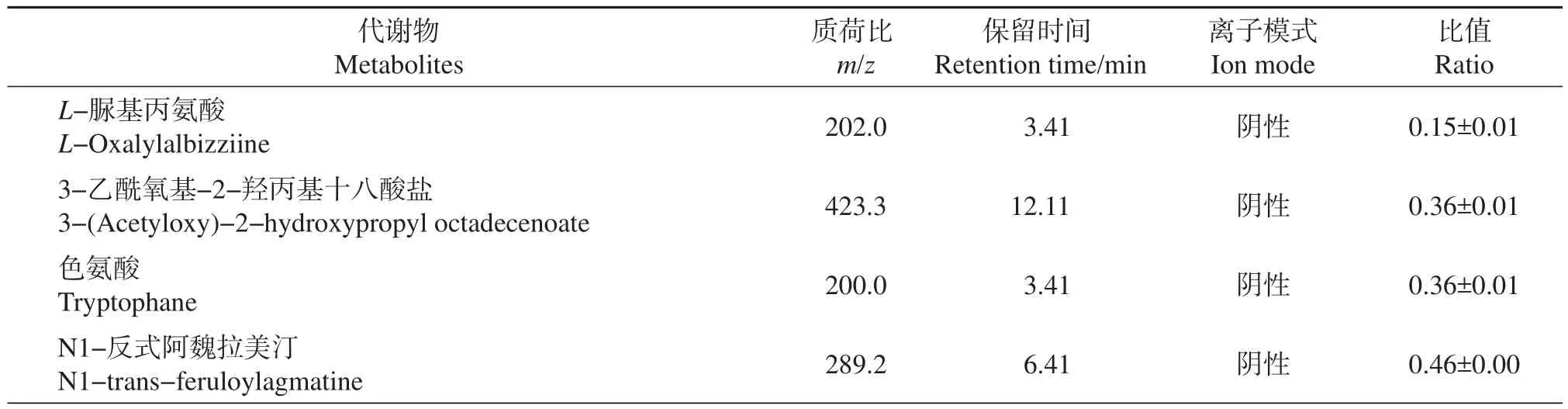
表2 33种变化1.5倍以上的差异代谢物Table 2 Thirty-three differentially expressed metabolites(more than 1.5-fold)
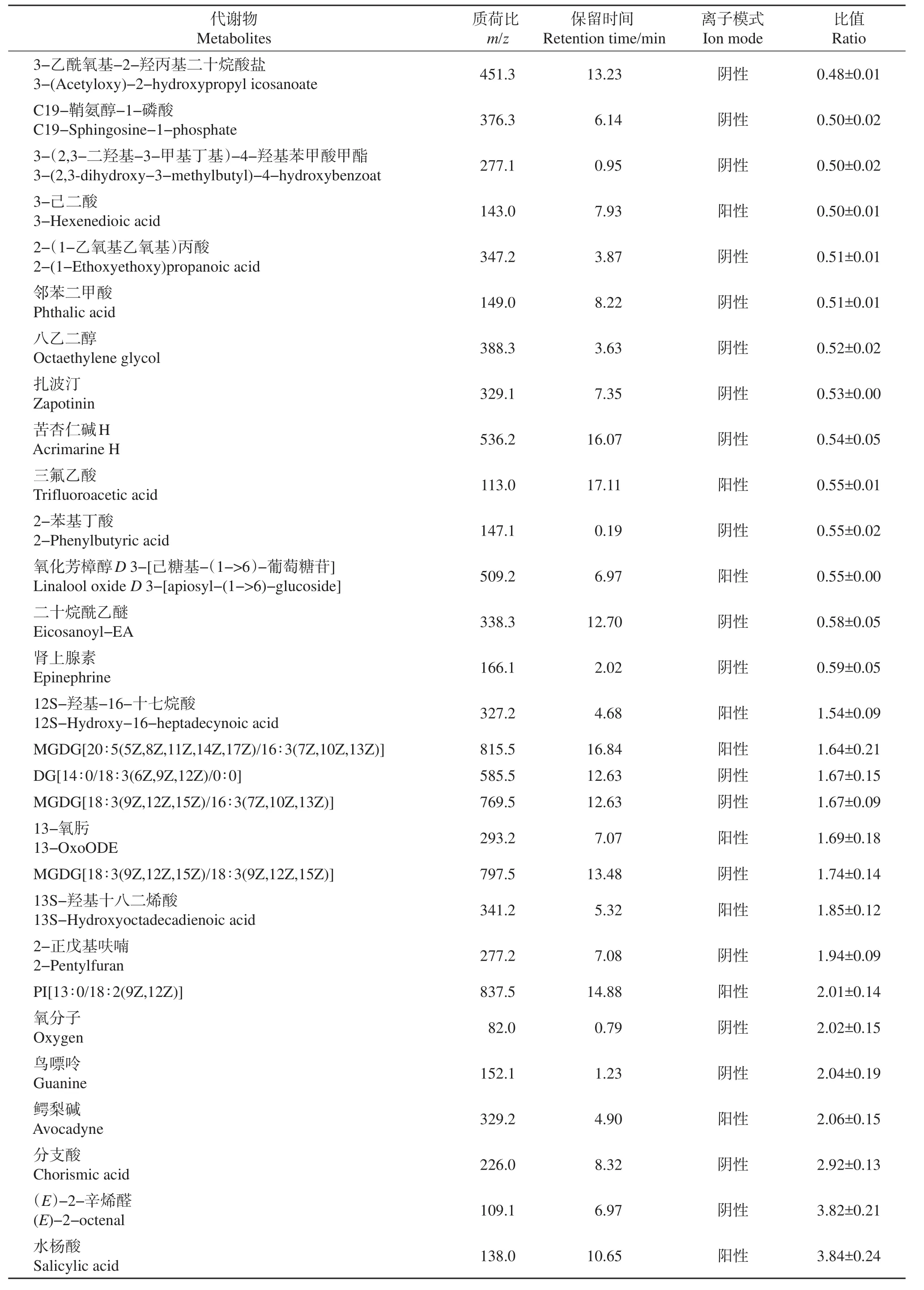
续表2 Continuation of Table 2
2.6 差异代谢物参与的代谢通路分析
利用差异代谢物的KEGG ID进行通路富集分析,获得代谢通路富集结果。该代谢通路的P<0.05表示差异显著,P值越小,则差异性越显著,并计算出了-lgP。本研究分析发现,差异代谢物参与了硫胺素代谢、苯丙氨酸合成和生物碱合成等众多代谢过程,其中以植物激素的生物合成代谢通路改变最为明显(图5)。
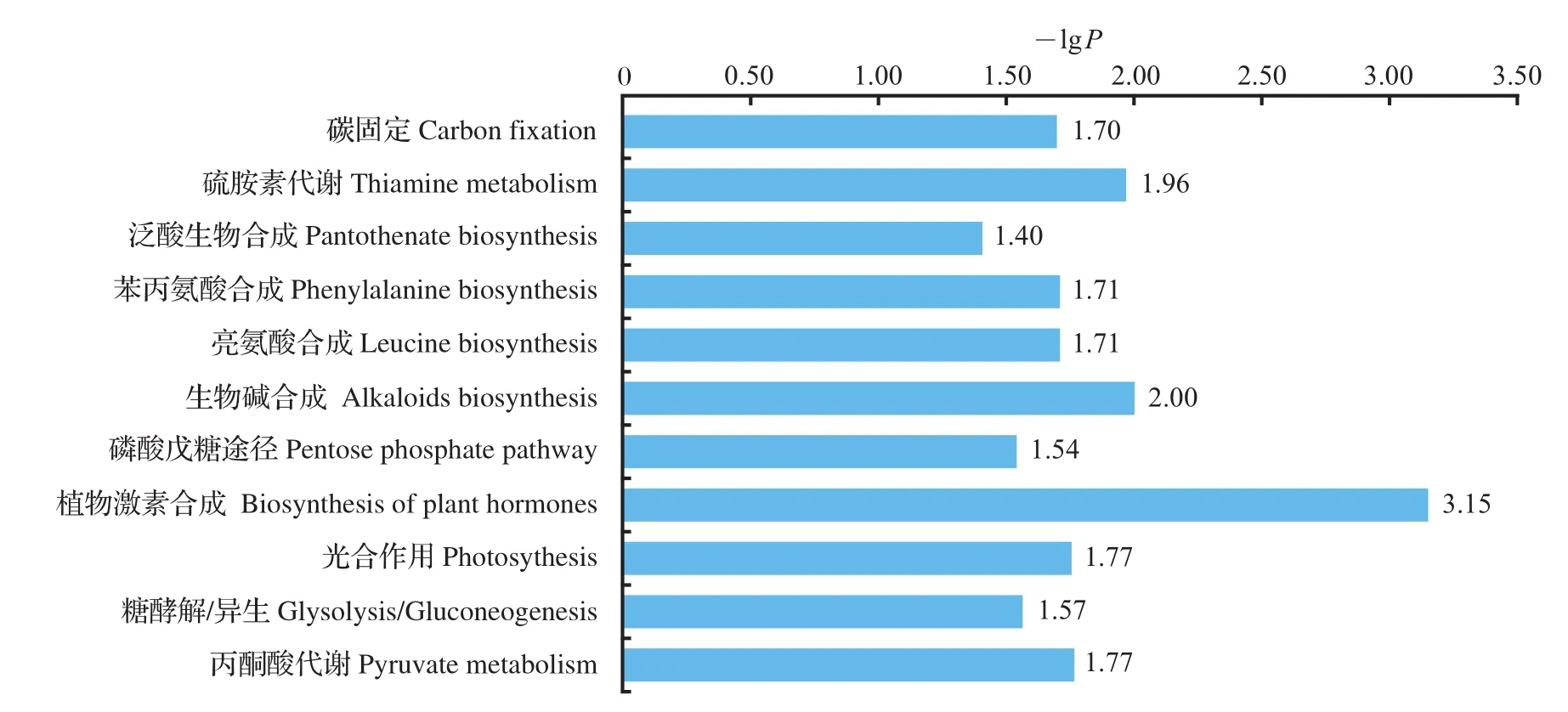
图5 差异代谢物参与的KEGG代谢通路富集分析Fig.5 KEGG enrichment analysis of differentially expressed metabolites
2.7 差异蛋白质组与代谢组数据的整合分析
本研究对蛋白质组与代谢组数据进行了联合分析,将各组学结果富集得到的P值转换为-lgP,发现灰葡萄孢菌侵染从蛋白组和代谢组水平上主要共同改变了葡萄叶片组织内以下几条代谢路径:光合作用过程、丙酮酸代谢、糖酵解/糖异生和次生代谢物的生物合成等。然而在蛋白和代谢物水平上发生共同变化的所有代谢通路中,激素水杨酸的生物合成与抗病信号转导途径改变尤为显著(图6)。在这条通路中,灰葡萄孢菌的侵染诱使异分支酸丙酮酸裂解酶pchB、转录因子TGA和病程相关蛋白PR-1分别上调5.12、2.09和3.33倍(表1);相应地,定量代谢组学检测出水杨酸和分支酸含量也分别增加了3.84和2.92倍(表2)。本研究结果可以揭示出,高抗葡萄品种‘申丰’采取了一条积极的水杨酸信号通路上调策略来颇为有效地抵御了灰葡萄孢菌的侵染。
3 讨论
3.1 受灰葡萄孢菌侵染影响最大的蛋白群体集中于叶绿体
在差异蛋白质组学研究中,GO二级注释结果显示响应病菌的差异应答蛋白质在叶绿体中显著富集。
很多研究已经表明,病菌侵染会使植物的光合速率明显下降,叶绿体受到破坏,叶绿素含量降低,光合作用减弱[18-20]。本研究结果显示,叶绿体基质蛋白和叶绿体被膜蛋白的表达水平都发生了下调。其中,果糖-1,6-二磷酸醛缩酶、促氧增强结合蛋白和捕光叶绿素a/b结合蛋白表达分别下调了3.85、1.59和1.69倍。果糖-1,6-二磷酸醛缩酶负责催化果糖-1,6-二磷酸和景天庚酮糖-1,7-二磷酸的合成反应,是卡尔文循环中的重要限速步骤。促氧增强结合蛋白是光合系统Ⅱ的重要组成部分,在电子传递中发挥重要作用。捕光叶绿素a/b结合蛋白可与叶绿素和类胡萝卜素结合形成捕光叶绿素蛋白复合体,从而能吸收光能并将其迅速转化为化学能存储在植物体内[21]。这3类重要的光合作用相关蛋白的下调表达,很有可能与灰霉菌的侵染在一定程度上影响了叶绿体的正常生理功能有关。在其他逆境胁迫中,研究人员也观察到这些酶下调表达的现象,如SARRY等通过双向电泳结合质谱的研究手段发现重金属处理会使拟南芥体内的果糖-1,6-二磷酸醛缩酶蛋白表达明显下调[22]。

长方形代表酶,椭圆形代表小分子代谢物,红色箭头表示表达上调,数字表示上调倍数。The rectangles represent enzymes,and the ellipses represent small molecule metabolites,and the red arrows and number indicate the expression up-regulation and multiple of up-regulation,respectively.
3.2 植物激素与生物碱合成途径改变明显
植物在生长过程中会受到各种生物和非生物胁迫,代谢组学技术可以系统地鉴定出植物应答胁迫产生的各种抗性小分子及抵御病原物入侵的小分子前体,不仅可以了解植物的整体防御状态,也可以鉴定植物在病菌侵染情况下产生的标志性分子[23-24]。本代谢组学研究结果显示:差异代谢物涉及嘌呤源生物碱和烟酸生物碱、莽草酸途径生物碱、萜和聚酮体生物碱、苯丙素、植物激素和萜与类固醇的生物合成等各个方面。在植物与病原菌的互作过程中,植物会产生一系列的抗病反应,其中最重要的一类初级反应便是能调控次级代谢通路上相关基因/酶的表达变化,从而进一步指导调控次级代谢物的合成。包括烟酸、萜、非蛋白氨基酸和苯丙素等在内的小分子代谢物不但可以作为抗体抵御病菌侵染,而且还可以作为信号物质参与植物的防卫反应[25]。如HUFFAKER等发现,催化合成半倍萜的2个基因TPS6和TPS11都发生了明显的表达上调[26]。本试验结果和已有的研究发现都表明,次生代谢物的明显变化是植物体防御病菌侵染的积极响应。
3.3 水杨酸介导的抗病信号通路全面激活
水杨酸已被广泛证实是植物产生系统获得性抗性的重要小分子信号物质。植物中水杨酸可以由分支酸经异分支酸合酶pchA催化形成异分支酸,然后再由异分支酸丙酮酸裂解酶pchB催化转变为水杨酸[27]。水杨酸可以继续与细胞内受体NPR1互作,然后NPR1作为转录辅助因子与转录因子TGA结合,再进一步启动抗性基因PR-1的表达[28]。
在本研究中,差异代谢组学鉴定到激素合成路径中的中间产物分支酸和终产物水杨酸的含量都呈现大幅度的增加,而且异分支酸丙酮酸裂解酶pchB也出现明显表达上调。在水杨酸后续诱导的抗病信号路径中,蛋白组学鉴定到的转录因子TGA和病程蛋白PR-1表达水平也急剧上升。本多组学综合研究的结果表明,水杨酸合成与抗病信号通路的全面激活,可能是高抗葡萄品种‘申丰’有效抵御灰葡萄孢菌侵染的重要手段。
4 结论
综上所述,本研究利用基于液质联用的定量蛋白质组和代谢组学技术综合分析了灰霉病高抗葡萄品种‘申丰’在病菌侵染前后的组学变化。一共鉴定到了差异变化值在1.5倍以上的1 374个蛋白和33种代谢物。系列生物信息学分析表明,叶绿体蛋白表达丰度受病菌侵染影响最大,植病互作、植物激素与生物碱合成3条途径改变最为明显,其中水杨酸介导的抗病信号通路的全面激活可能是葡萄叶片有效抵御灰葡萄孢菌侵染的重要策略。
