MicroRNA-126在动脉粥样硬化性脑梗死患者血清中的表达变化及其机制研究
2019-07-06张翠司君增郑立峰
张翠,司君增,郑立峰
(莱芜市人民医院 神经内科,山东 莱芜 271100)
脑梗死又称缺血性脑卒中,其发病率逐年升高,动脉粥样硬化尤其是颈动脉粥样硬化(Atherosclerosis,AS)是脑梗死的主要病因和危险因素[1]。MicroRNA(miRNA)在动脉粥样硬化性脑梗死(atherosclerosis cerebral infarction,ACI)调控中发挥着重要作用[2]。研究显示,MicroRNA-126(miR-126)在ApoE(-/-)小鼠颈动脉粥样硬化斑块中表达降低,推测其可能参与AS的形成过程[3],但作用机制尚不清楚。本研究旨在观察miR-126在ACI患者血清中的表达变化及其对血管平滑肌细胞增殖和迁移的影响,并探讨其可能的调控机制。
1 资料与方法
1.1 一般资料
选取2015年11月—2017年11月莱芜市人民医院发病7 d内就诊的150例急性脑梗死患者。纳入标准:①符合第四届全国脑血管病会议修订的诊断标准[4],经颅脑CT或MRI证实;②第1次发生急性脑梗死;③患者知情同意。排除标准:①既往有脑血管史;②合并有心、肝及肾功能不全和肿瘤、自身免疫性疾病等;③入院前6个月有服用降脂药物史。150例急性脑梗死患者依据新TOAST卒中分类标准,分为ACI组110例和非动脉粥样硬化性脑梗死(non atherosclerosis cerebral infarction,NACI)组患者40例。ACI组:男性60例,女性50例;年龄(66.47±7.99)岁。ACI组患者又根据颈动脉彩色多普勒超声结果分为稳定斑块患者74例和不稳定斑块患者36例。NACI组:男性23例,女性17例;年龄(65.99±8.24)岁。同时选择同期40例年龄、性别相匹配的健康志愿者作为对照组,对照组行彩色多普勒超声检查排除AS。对照组:男性22例,女性18例;年龄(66.11±7.14)岁。所有受试者采集空腹外周静脉血10 ml,3 000 r/min离心10 min分离血清,-80℃保存待检。3组性别、年龄、舒张压(DBP)、空腹血糖(FPG)及高密度脂蛋白胆固醇(HDL-C)等一般资料比较,差异无统计学意义(P>0.05),而收缩压(SBP)、总胆固醇(TC)、甘油三酯(TG)及低密度脂蛋白胆固醇(LDL-C)比较,差异有统计学意义(P<0.05)。本研究通过医院伦理委员会批准,患者签署知情同意书。见表1。
1.2 主要试剂和细胞系
血清miRNA提取试剂盒(美国Ambion公司),miR-126模拟物、模拟物阴性对照、miR-126抑制物及抑制物阴性对照均购自广州锐博生物公司,Trizol试剂及LipofectamineTM2000购自美国Invitrogen公司,RNA逆转录试剂盒、实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒购自大连宝生生物工程公司,miR-126、U6引物购自上海吉玛制药公司,CCK-8试剂盒(上海碧云天生物技术有限公司),Transwell小室(美国Corning公司),一抗基质金属蛋白酶13(matrix metalloprotein,MMP-13)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)及二抗均购自美国Santa Cruz公司。人血管平滑肌细胞系HA-VSMC(美国ATCC细胞库)。在DMEM培养基中培养,置于37℃、5%二氧化碳CO2的饱和湿度恒温箱培养箱中常规传代培养,取生长状态良好的对数生长期细胞进行后续实验。
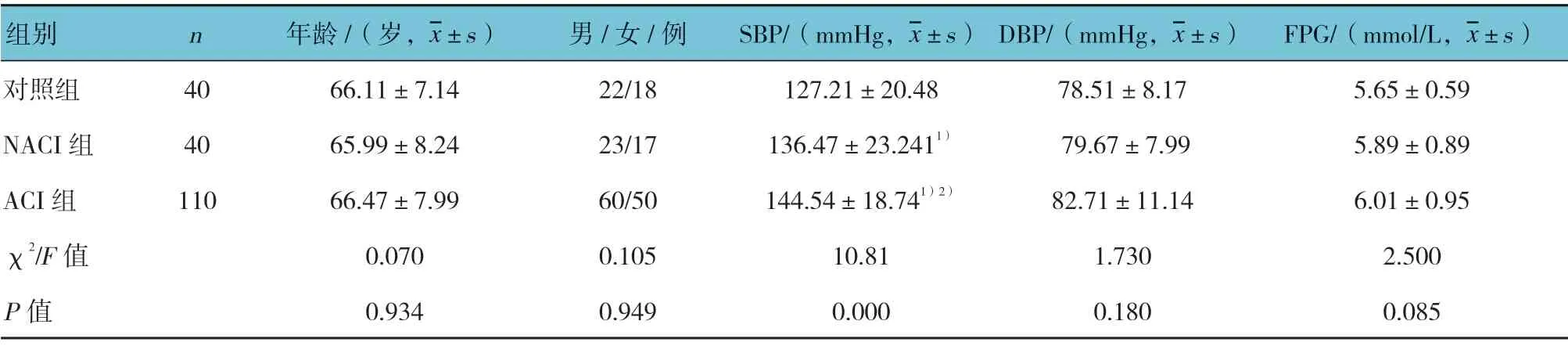
表1 3组患者一般资料比较
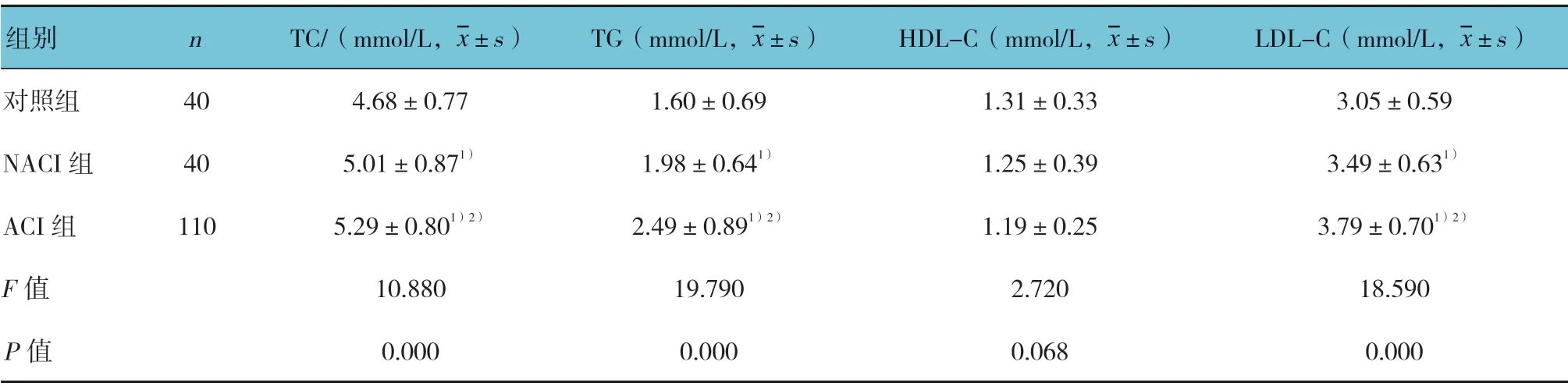
续表1
1.3 方法
1.3.1 qRT-PCR应用Trizol试剂提取细胞总RNA,用miRNA提取试剂盒提取血清中的miRNA,鉴定纯度和含量后,参照逆转录试剂盒说明书操作,采用miR-126特异性逆转录引物合成cDNA。以cDNA为模板,按照qRT-PCR试剂盒说明书配置反应体系进行PCR反应。miR-126引物序列,正向引物:5'-GGCTTCGTACCGTGAGTAAT-3',反向引物:5'-GTGCAGGGTCCGAGGT-3'。PCR反应条件:95℃预 变性30 s,95℃变性5 s,60℃退火20 s,72℃延伸1 min,共40个循环。以U6作为内参基因,采用2-△△Ct法计算miR-126相对表达水平。
1.3.2 细胞转染取对数生长期HA-VSMC细胞,接种于6孔细胞板,常规培养24 h,待细胞增长至50%~60%密度时,即可进行细胞转染。采用LipofectamineTM2000说明书操作,分别将miR-126模拟物、模拟物阴性对照、miR-126抑制物及抑制物阴性对照转染至HA-VSMC细胞,转染后HA-VSMC细胞分为miR-126模拟物组、模拟物阴性对照组、miR-126抑制物组及抑制物阴性对照组。转染后24 h,采用qRT-PCR检测各组细胞miR-126的表达水平,评估转染效率。
1.3.3 CCK-8法收集转染后48 h的4组HAVSMC细胞,以5 000个/孔的密度接种于96孔细胞板,每组设5个复孔,参照CCK-8试剂盒说明书在避光条件下加入10μl CCK-8反应液后,置入细胞孵育箱中37℃继续孵育4 h后,在酶标仪上设定波长450 nm,检测各孔的光密度(optical density,OD)值,以OD值表示细胞的增殖活性。
1.3.4 Transwell迁移实验收集转染后48 h的各组HA-VSMC细胞,以无血清培养基重悬制备单细胞悬液,取0.1 ml单细胞悬液(含1×105个细胞)加入Transwell小室的上室,下室加入0.5 ml含10%胎牛血清的DMEM培养基,放入细胞孵育箱中继续孵育24 h后取出小室,棉签轻轻擦弃小室上室的细胞,小室膜上的细胞以95%乙醇溶液固定,染色后显微镜下观察,并随机取10个高倍视野计算迁移细胞数,以穿膜细胞数表示细胞的迁移能力。
1.3.5 Western blotting收集转染后48 h的4组HA-VSMC细胞,加入细胞裂解液和蛋白酶/磷酸酶抑制剂提取细胞总蛋白质,BCA法定量蛋白质浓度。取200μl样品上样,聚丙烯酰胺凝胶电泳电泳分离,将电泳产物转聚偏二氟乙烯膜,室温条件下脱脂奶粉封闭2 h后,缓冲液漂洗3遍,分别加入一抗MMP-13和GAPDH,4℃过夜,缓冲液漂洗3遍,加入相应的二抗,室温孵育1 h,洗膜后ECL显影液显影,采集图片,Image Lab软件分析条带灰度。
1.4 统计学方法
数据分析采用SPSS 21.0统计软件。计量资料以均数±标准差(x±s)表示,比较用t检验或方差分析,进一步的两两比较用SNK-q检验;计数资料以构成比表示,比较用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组血清中miR-126表达比较
qRT-PCR结果显示,对照组、ACI组和NACI组血清中miR-126的表达水平分别为(1.01±0.04)、(0.97±0.08)和(0.60±0.14),3组血清中miR-126表达比较,差异有统计学意义(F=270.240,P=0.000);ACI组血清中miR-126的表达水平低于NACI组和对照组(P<0.05),NACI组和对照组血清中miR-126表达比较,差异无统计学意义(P>0.05)。见图1。
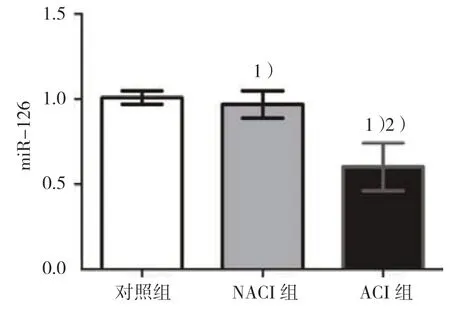
图1 3组血清miR-126表达水平比较 (±s)
ACI组中不稳定斑块和稳定斑块患者血清中miR-126表达水平分别为(0.42±0.08)和(0.69±0.17)。ACI组中不稳定斑块患者血清中miR-126表达水平低于稳定斑块患者(t=9.039,P=0.000)。见图2。
2.2 各组HA-VSMC细胞miR-126表达水平比较
qRT-PCR结果显示,miR-126模拟物组、模拟物阴性对照组、miR-126抑制物组和抑制物阴性对照组miR-126表达水平分别为(7.10±0.30)、(1.02±0.04)、(0.35±0.10)和(1.00±0.05)。4组miR-126表达水平比较,差异有统计学意义(F=1158.600,P=0.000);miR-126模拟物组miR-126表达水平高于模拟物阴性对照组(P<0.05),miR-126抑制物组miR-126的表达水平低于抑制物阴性对照组(P<0.05),说明转染效率较高。见图3。
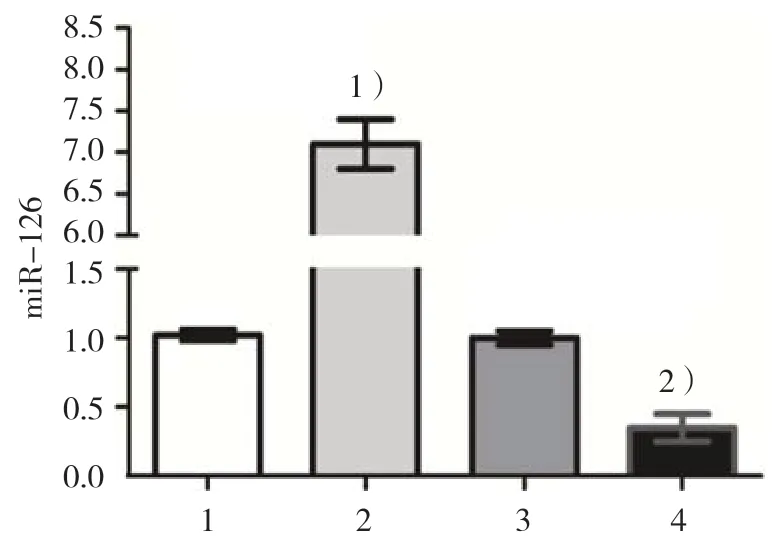
图3 各组miR-126表达水平比较 (±s)
2.3 各组HA-VSMC 细胞增殖活性比较
CCK-8法结果显示,miR-126模拟物组、模拟物阴性对照组、miR-126抑制物组和抑制物阴性对照组细胞OD值分别为(1.45±0.12)、(2.10±0.10)、(2.62±0.18)和(2.05±0.13)。4组OD值比较,差异有统计学意义(F=37.300,P=0.000);miR-126模拟物组细胞的OD值低于模拟物阴性对照组(P<0.05),miR-126抑制物组细胞的OD值高于抑制物阴性对照组(P<0.05)。说明上调HA-VSMC细胞miR-126表达能抑制细胞增殖活性,而下调HAVSMC细胞miR-126表达却能增强细胞增殖活性。见图4。
2.4 各组HA-VSMC细胞的迁移能力比较
Transwell迁移实验结果显示,miR-126模拟物组、模拟物阴性对照组、miR-126抑制物组和抑制物阴性对照组迁移细胞数分别为(19.20±5.00)、(28.10±3.00)、(28.00±5.00)和(40.50±6.00)个。4组迁移细胞数比较,差异有统计学意义(F=9.690,P=0.005);miR-126模拟物组迁移细胞数低于模拟物阴性对照组(P<0.05),miR-126抑制物组迁移细胞数低于抑制物阴性对照组(P<0.05)。说明上调HAVSMC细胞miR-126表达能抑制细胞迁移能力,而下调HA-VSMC细胞miR-126表达却能提高细胞迁移能力。见图5、6。
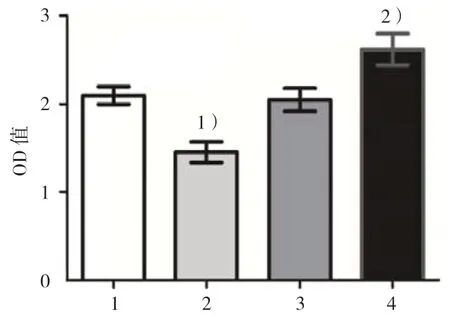
图4 4组细胞增殖活性比较 (±s)
2.5 miR-126靶基因的预测
查阅TargetScan(http://www.targetscan.org)和miRanda(www.microrna.org)生物信息学数据库发现,miR-126与MMP-13的3’UTR区存在种子序列互补的结合位点。结合相关文献[5],推测MMP-13可能是miR-126的作用靶基因。见图7。
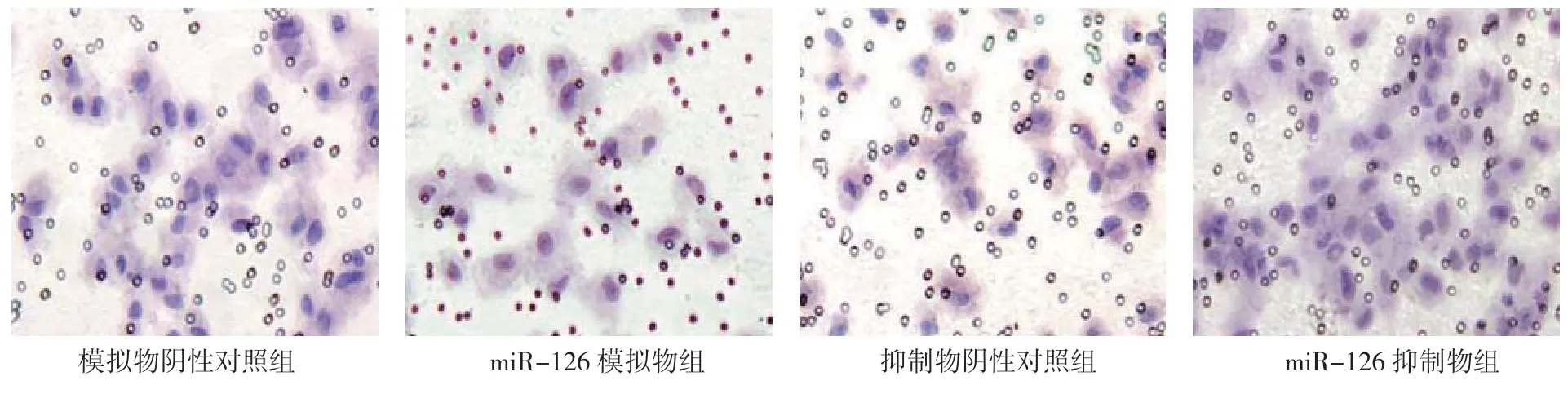
图5 各组细胞迁移能力 (×200)
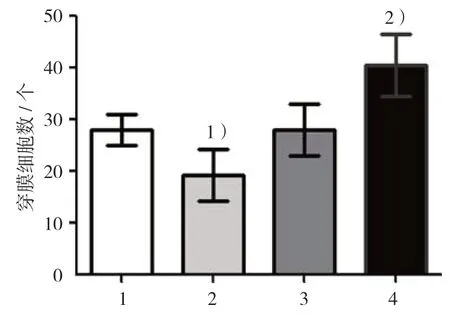
图6 各组细胞迁移能力比较 (±s)
2.6 各组HA-VSMC细胞MMP-13蛋白表达比较
Western blotting结果显示,miR-126模拟物组、模拟物阴性对照组、miR-126抑制物组和抑制物阴性对照组MMP-13蛋白表达水平分别为(0.32±0.13)、(0.95±0.15)、(1.69±0.23)、(0.88±0.19)μg/L。4组MMP-13蛋白表达水平比较,差异有统计学意义(F=29.560,P=0.000);miR-126模拟物组MMP-13蛋白表达水平低于模拟物阴性对照组(P<0.05),miR-126抑制物组MMP-13蛋白表达水平高于抑制物阴性对照组(P<0.05)。说明上调HA-VSMC细胞miR-126表达能抑制细胞MMP-13蛋白表达,而下调HA-VSMC细胞miR-126表达却能提高细胞MMP-13蛋白表达。见图8。
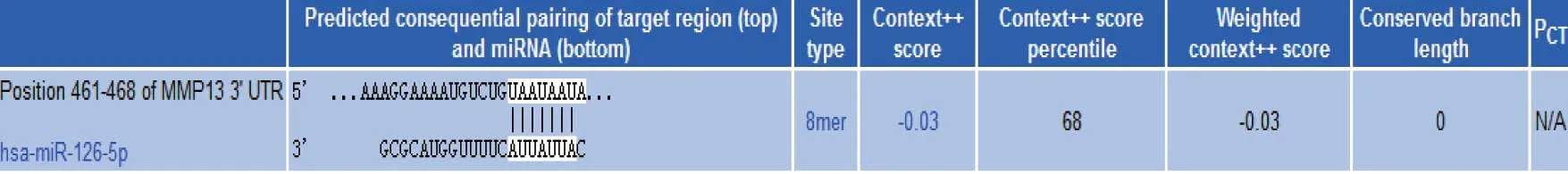
图7 miR-126和MMP-13的3’UTR区结合序列
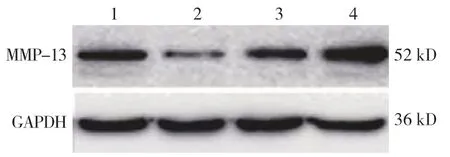
图8 4组MMP-13蛋白的表达
3 讨论
AS是多种缺血性心脑血管疾病的基础,血管内皮细胞损伤和炎症激活、平滑肌细胞增殖和迁移、单核巨噬细胞活化释放炎症介质是AS发生、发展的重要过程,也是ACI发生的病理基础[6]。目前研究证实,血管平滑肌的异常增殖及迁移在促进AS及ACI的发生、发展中发挥着重要的作用[7]。
近年来研究显示,miRNA在转录后水平调控靶基因的表达,广泛参与AS发病机制的多个环节[2]。miR-126是近年来发现与肿瘤、炎症反应及细胞增殖分化等密切相关miRNA家族成员之一,其编码基因定位于染色体9q34.3,表皮生长因子样结构域1基因的第7个内含子中[8-9]。miR-126与AS的关系引起学者关注。WANG等[10]研究中发现,miR-126在冠状动脉粥样硬化性心脏病患者血清中表达水平降低,且在不稳定型心绞痛和急性心肌梗死患者血清中表达水平更低,推测miR-126与AS有关。王婷等[3]研究中发现,miR-126在ApoE(-/-)小鼠颈AS斑块中的表达降低,认为miR-126参与颈AS的形成和发展过程。但目前有关miR-126在ACI患者血清中表达情况及作用机制的研究尚未见报道。本研究中,笔者通过qRT-PCR检测发现,ACI患者血清中miR-126的表达水平低于NACI患者和对照组,而NACI患者和健康对照组比较无差异;进一步统计分析发现,ACI组中不稳定斑块患者血清中miR-126的表达水平低于稳定斑块患者,提示miR-126在ACI的发生、发展中发挥着重要的作用。
研究发现,血管平滑肌细胞的异常增殖和迁移在AS的发生、发展中发挥着重要的作用[7]。miRNA能通过调控血管平滑肌细胞的增殖、凋亡及迁移参与AS的发生、发展。李晓丽等[11]研究发现,miR-181b在颈AS患者血清中表达降低,其可能通过抑制血管平滑肌细胞的增殖和迁移起到抗AS的作用。XIE等[12]报道,上调血管平滑肌细胞中miR-599的表达能抑制血管平滑肌细胞的增殖和迁移能力,从而干预AS的进展。为研究miR-126是否也能通过影响血管平滑肌细胞增殖和迁移参与ACI的发生、发展,笔者通过脂质体转染法将miR-126模拟物和抑制物分别转染入人血管平滑肌细胞HA-VSMC中,上调或下调细胞中miR-126的表达水平。CCK-8实验和Transwell实验显示,上调HA-VSMC细胞中miR-126水平能抑制细胞的增殖和迁移能力,而下调miR-126水平却能提高细胞的增殖和迁移能力。证实miR-126能通过抑制血管平滑肌细胞的增殖和迁移能力,起到抗AS的作用。
miR-126抑制血管平滑肌细胞的增殖和迁移能力的下游通路尚不明确。笔者通过生物学信息网站预测MMP-13可能是miR-126的作用靶基因,近期WU等[5]在研究中也发现,miR-126通过靶向调控MMP-13,从而调控骨巨细胞瘤的分化。MMP-13是基质金属蛋白酶家族重要成员之一。研究证实,MMP-13与血管平滑肌细胞的增殖、凋亡、迁移、血管收缩及血栓形成等AS病变过程有关[13]。抑制MMP-13能减少胶原在颈动脉斑块中的聚集,甚至增加已形成的斑块的稳定性[14]。为研究miR-126在血管平滑肌细胞中能否也可通过调控MMP-13影响细胞的增殖和迁移能力。笔者通过Western blotting检测发现,上调HA-VSMC细胞中miR-126水平能下调细胞中MMP-13表达水平,而下调miR-126水平却能升高细胞中MMP-13表达水平,提示miR-126可能通过调控MMP-13表达调控血管平滑肌细胞的增殖和迁移。
综上所述,miR-126在ACI患者血清中表达降低,miR-126能通过抑制血管平滑肌细胞的增殖和迁移,起到抗AS的作用,其机制可能与下调MMP-13的表达有关。
