肺细胞外基质水凝胶治疗大鼠放射性肺损伤的实验研究*
2019-07-06吴鹏飞施光清范贤明肖贞良周菁
吴鹏飞,施光清,范贤明,肖贞良,周菁
(1.西南医科大学附属医院 呼吸科,四川 泸州 646000;2.中国人民解放军西部战区总医院 呼吸科,四川 成都 610083)
放射性肺损伤是肿瘤放疗中常见的并发症,目前无有效治疗手段[1-2]。其发生包括早期炎症浸润及后期纤维化,抑制炎症反应是治疗的关键[3]。
细胞外基质(extracellular matrix,ECM)是组织再生领域的一种新型材料,是离体器官经过洗脱细胞、裂解脂膜后残余的结构和功能蛋白复合体,含有天然的胞外微环境,对细胞的增殖、调亡及免疫等生物学行为具有调节作用[4-7]。通过冻干、酶消化等将ECM制成温敏性水凝胶,即室温下为液体,37℃凝固为胶冻样,可黏附于局部组织并持续发挥作用[6]。该特性使ECM可能成为一种治疗药物,目前关于ECM水凝胶治疗肺部疾病的研究报道很少。因此,本实验通过气管内注射肺ECM水凝胶治疗大鼠放射性肺损伤研究,初步探讨其可行性及有效性。
1 材料与方法
1.1 动物及材料
1.1.1 实验动物SPF级雄性SD大鼠(成都达硕实验动物公司)42只,6周龄,体重(220±20)g,24只用于气管内注射肺ECM水凝胶的安全性评估,18只用于观察肺ECM水凝胶疗效,常规饲养,12 h昼夜交替。动物实验的设计、实施过程操作符合动物伦理。
1.1.2 仪器与材料直线加速器(美国Varian公司),冷冻切片机(英国珊顿公司),倒置相差荧光显微镜(日本Olympus公司),冷冻干燥机(北京盛超科创生物科技有效公司),冷冻研磨仪(上海净信实业发展有限公司)。苏木精及伊红染液(北京索拉宝科技有限公司),生物素(美国Thermo公司),亲和素(武汉博士德生物公司),大鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(Interleukin-6,IL-6)ELISA试剂盒(上海将来实业股份有限公司)。
1.2 方法
1.2.1 肺ECM的制备根据SONG等[7]的肺ECM制备过程,以10%水合氯醛麻醉大鼠,12 500 u肝素+250 ml生理盐水全身灌流肝素化,18 G针行肺动脉插管,结扎、固定,紧贴脊柱完整分离肺组织,依次予以0.1 % SDS(2 h)、纯水(15 min)、1% Triton-X-100(30 min)及PBS(72 h)灌流。将所获的肺ECM制成冻干粉剂,环氧乙烷消毒后,-80℃长期保存。
1.2.2 肺ECM水凝胶的制备将10 mg/ml肺ECM粉末混入0.1 mol/L盐酸-胃蛋白酶液(1 mg/ml)中,室温搅拌消化48 h,用0.1 mol/L氢氧化钠NaOH滴定至pH 7.4,10倍PBS稀释至1倍,经体外验证,该水凝胶在常温下为液态,在37℃、30 min左右可凝结成胶冻状[8]。
1.2.3 放射性肺损伤动物模型的复制36只大鼠以10%水合氯醛麻醉后,仰卧位固定于木板上,充分暴露胸部。照射野上界为两侧腋窝中点的连线、下界为剑突下缘平面,其余部位用5 cm厚铅板遮挡,予以6MV-X线直线加速器单次照射,剂量20 Gy,剂量率3.5 Gy/min,源皮距100 cm[9]。
1.2.4 动物分组实验一:根据气管内注射剂量的不同(0、300、500及800μl),24只放射性肺损伤大鼠随机分为0μl组、300μl组、500μl组及800μl组,每组6只。实验二:18只大鼠(12只放射性肺损伤大鼠+6只正常大鼠)随机分为照射组(照射+气道内注射生理盐水500μl)、ECM组(照射+气道内注射肺ECM水凝胶500μl)及对照组,每组6只。
1.2.5 肺ECM水凝胶治疗将肺ECM水凝胶与事先配好的1 mg∶180μl纯水稀释的生物素按照93∶7的浓度混匀。照射30 min后,实验一的大鼠麻醉后固定于木板上,取仰卧位,头抬高60°,颈部皮肤竖切口0.5 cm,逐层分离暴露气管,环甲膜穿刺,用1 ml注射器分别缓慢注入300、500及800μl生物素标记的肺ECM水凝胶;实验二大鼠注入500μl肺ECM水凝胶或等量生理盐水。
1.2.6 动脉血氧分压(arterial partial pressure of oxygen,PaO2)检测在预实验中,本课题组观察到肺ECM水凝胶在体内约30 min成胶,因此在照射1 h后,实验一各组大鼠麻醉后腹主动脉取血,检测PaO2变化。
1.2.7 肺组织病理学检测实验二各组大鼠在照射7 d后取左肺,4%多聚甲醛固定24 h后,常规脱水、石蜡包埋及切片,苏木精-伊红(HE)染色,镜下观察肺组织病理改变。参考MIKAWA等[10]的评分方法评价肺损伤程度,包括:①肺泡充血;②肺泡水肿;③肺泡壁中性粒细胞浸润;④肺泡壁增厚。根据损伤程度分为:无损伤0分,每高倍镜视野下损伤范围<25%计1分,25%~<50%计2分,50%~<75%计3分,≥75%计4分,每项最高4分,总分最高16分。
1.2.8 免疫荧光染色检测实验一300、500及800μl组大鼠照射1 h后取左肺,OCT冷冻切片包埋剂包埋后冷冻切片,PBS清洗3次,3 min/次、5%牛血清清蛋白封闭30 min,PBS清洗3次,3 min/次、亲和素反应30 min,PBS清洗3次,3 min/次,DAPI染色3 min,PBS清洗3次,3 min/次,抗荧光淬灭剂封片后观察。
1.2.9 血清TNF-α、IL-6浓度检测照射7 d后,实验二各组大鼠腹主动脉取血3 ml,常温静置1 h,3 500 r/min离心15 min,取上清0.5 ml。血清TNF-α、IL-6含量检测按照ELISA试剂盒说明书操作,酶标仪450 nm波长处测定吸光度值。
1.3 统计学方法
数据分析采用SPSS 16.0统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 肺ECM支架
离体肺组织颜色红润,脱细胞液灌流后的肺ECM,肉眼观察肺组织大体标本变透明,HE染色未见蓝染的细胞核成分,绝大多数已经洗脱肺组织有核细胞成分。见图1。

图1 肺ECM支架
2.2 各组大鼠PaO2比较
实验一大鼠气管注射肺ECM水凝胶后30 min内,800μl组大鼠死亡3只,存活率为50%,0、300及500μl组无死亡,存活率均为100%。注射30 min后,0、300、500及800μl组大鼠PaO2分别为(84.51±7.78)、(81.96±9.97)、(79.29±7.56)和(61.51±8.39)mmHg,经方差分析,差异有统计学意义(F=30.241,P=0.000);0μl组与300μl组大鼠PaO2比较,差异无统计学意义(t=0.951,P=0.345),0μl组与500μl组大鼠PaO2比较,差异无统计学意义(t=1.947,P=0.055),300μl组与500μl组大鼠PaO2比较,差异无统计学意义(t=0.996、P=0.323),300μl组与800μl组大鼠PaO2比较,差异有统计学意义(t=7.629,P=0.000)。说明气管注射肺ECM水凝胶300和500μl不会影响大鼠PaO2,而800μl则会影响大鼠PaO2。
2.3 各组大鼠肺泡内ECM水凝胶的分布
300、500及800μl组能在肺泡表面观察到绿色荧光。800μl组观察到部分水凝胶在气道内滞留,300和500μl组未见气道滞留,且前者比后者肺泡内绿色荧光分布更均匀、广泛。见图2。
2.4 各组大鼠肺组织病理学观察及评分比较
照射7 d后通过光镜观察,与对照组比较,照射组大鼠肺泡间隔充血水肿、增宽,细胞浸润增多,肺泡腔可见渗出,气管内注射肺ECM水凝胶后,上述病理改变减轻(见图3)。照射7 d后,对照组、照射组及ECM组的肺组织病理评分分别为(0.90±0.31)(5.50±1.95)和(3.50±0.85)分,经方差分析,差异有统计学意义(F=34.282、P=0.000);照射组与对照组肺组织病理评分比较,差异有统计学意义(t=-7.336,P=0.000),ECM组与照射组肺组织病理评分比较,差异有统计学意义(t=2.437,P=0.033)。说明气管内注射肺ECM水凝胶能减轻放射性肺损伤早期的病理改变。

图2 大鼠肺泡中肺ECM水凝胶的分布情况 (免疫荧光染色×400)
2.5 各组大鼠血清TNF-α、IL-6水平变化
对照组、照射组和ECM组大鼠血清TNF-α分别为(57.11±9.11)、(98.79±12.12)和(74.49±20.17)pg/ml,对照组、照射组和ECM组大鼠血清IL-6分别为(35.14±4.25)、(75.67±9.22)和(53.49±8.40)pg/ml,各组大鼠血清TNF-α、IL-6比较,差异有统计学意义(F=25.088和71.172,均P=0.000),照射组及ECM组大鼠血清TNF-α、IL-6水平较对照组升高(P<0.05),ECM组大鼠血清TNF-α、IL-6水平较照射组降低(P<0.05)。见图4。

图3 肺组织病理学观察 (HE染色×200)
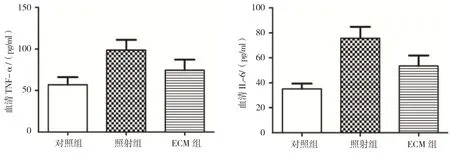
图4 各组大鼠血清TNF-α、IL-6水平比较 (n =6,±s)
3 讨论
ECM材料是近年来组织再生领域研究的热点之一,其免疫源性低,含有最天然的细胞外微环境,是种子细胞生长的理想材料[11]。同时,含有大量活性因子,体外研究表明ECM对组织细胞的行为具有多项调节作用,因此可能在组织局部发挥抗炎、免疫调节、抗纤维化及改善血管形成等多种生理作用[5,12]。近年来研究报道,将ECM制备成可注射的ECM水凝胶,局部注射后直接作用于受损组织表面,对受损脑、心肌及皮肤等有治疗作用[4,12]。GHUMAN等[13]将猪膀胱ECM水凝胶注射到大鼠脑梗死区域,当水凝胶浓度为8 mg/ml时,损伤区域宿主细胞浸润明显,其中60%为脑源性细胞,能显著发挥内源性修复作用。SUN等[14]发现碳纳米管复合水凝胶能促进心肌细胞闰盘形成,增强其与周围心肌细胞的黏附作用。目前,ECM水凝胶应用于肺损伤等相关疾病的研究很少。放射性肺损伤多发生在胸部肿瘤放疗后或核辐射暴露后,是临床治疗的难点之一。如何减少细胞坏死,减轻炎症反应,成为其早期治疗的关键[3]。既往研究表明,肺组织受照射后1 h内即启动早期炎症反应[15]。本实验研究提示ECM水凝胶有抗炎作用,早期给药减轻局部炎症反应,对放射性肺损伤产生治疗作用。
本研究首先利用脱细胞方法[7]制备肺ECM支架,HE染色证实脱细胞效果满意,然后按照WOLF等[8]和PRICE等[16]报道的方法将ECM支架制成温敏性水凝胶。在预实验中,将材料注射到大鼠皮下,观察周围炎症反应,HE染色未见局部出血或细胞渗出增多,组织相容性好。
实验时ECM水凝胶给药量和给药方式至关重要。一方面大鼠气管直径小,注射量过大存在窒息风险,肺ECM水凝胶在终末气道分布过多,会影响肺组织气体交换。另一方面,为确保给药效果,应使水凝胶充分、均匀地附着在肺泡表面。本研究采用环甲膜穿刺、气管内注射的精确给药方式,结果显示注射500μl肺ECM水凝胶后,水凝胶在肺泡表面均匀、充分分布,且不会造成大鼠死亡率上升,确定给药方式和剂量安全有效。杨文等[17]在检测KM小鼠气管注射耐受量时发现,32 g左右的KM小鼠,气管内注射生理盐水的剂量为3.814~4.768 ml/kg时,小鼠死亡率为40%~50%,比本实验结果稍低,可能是由于ECM凝结成胶后较生理盐水对通气及换气功能的影响更大。血清TNF-α、IL-6水平在放射性肺损伤早期就显著升高,且与局部肺组织损伤程度相关[18]。本实验观察到,早期气管内注射肺ECM水凝胶抑制血清TNF-α、IL-6的表达,降低大鼠局部肺组织损伤病理评分,初步显示ECM水凝胶局部给药有一定的疗效和研究价值。
本实验成功获取了肺ECM水凝胶,复制气管内注射肺ECM水凝胶治疗大鼠放射性肺损伤模型,并初步验证其对放射性肺损伤的疗效。肺ECM水凝胶对放射性肺损伤的保护作用和机制仍有待进一步研究,以明确其对肺水肿、肺组织细胞凋亡和肺部炎症反应等的干预作用。
