腹腔镜下D2淋巴结清扫胃癌根治术后出血的危险因素分析
2019-07-05代晓强
代晓强,马 宁
(1.咸阳市中心医院,陕西 咸阳,712000;2.咸阳市第一人民医院)
近几十年,虽然原发性胃癌(primary gastric cancer,PGC)的发病率与死亡率有所下降,但其仍是全球第二大癌症相关性死亡的主要原因[1]。手术仍是PGC最重要的干预措施,腹腔镜D2淋巴结清扫根治性胃切除术越来越多地应用于临床[2]。即使外科技术的发展日新月异,但术后并发症仍是难以避免的[3]。与术后吻合口狭窄、乳糜瘘、胃瘫等并发症相比,术后出血(postoperative hemorrhage,PH)较为严重,常会危及患者生命[4]。如果我们能识别胃癌后PH的危险因素即可进行风险评估,并制定适当的围手术期干预措施,有助于降低腹腔镜下D2淋巴结清扫胃癌根治术(laparoscopic radical gastrectomy,LRG)PH死亡率。目前LRG D2淋巴结清扫术后PH的研究非常有限,因此,本研究分析了LRG患者D2淋巴结清扫术后PH发生的危险因素,以期为临床提供参考。
1 资料与方法
1.1 临床资料 回顾分析2013年7月至2018年7月为362例患者行LRG的临床资料,临床及病理资料均记录在手术临床数据系统中。根据国际癌症联盟2016年第8版肿瘤TNM分类、淋巴结转移及远处转移情况确定肿瘤分期[5]。排除标准:(1)术中肿瘤已播散;(2)邻近器官受侵;(3)有凝血障碍;(4)中转开腹;(5)临床或病理资料不全。患者自愿选择腹腔镜手术,并签署知情同意书,由主刀医生向患者家属进行手术与肿瘤学风险的告知与谈话。根据第四版日本《胃癌治疗指南》选择手术切除类型、淋巴结切除范围[6]。均由同一组外科医生施术。
1.2 变量与定义 根据文献,PH的定义为:手术部位的出血量导致患者24 h内血红蛋白下降超过2 g/dL,并且需要至少输注2U红细胞悬液[7]。PH的诊断方式包括临床表现、血常规检查、血压监测、床边超声检查、腹腔穿刺或血管造影等。从知网、万方数据库中提取到D2淋巴结清扫胃癌根治术潜在PH的危险因素作为变量,包括性别、年龄、体重指数(body mass index,BMI)、腹部手术史、TNM 分期、手术切除类型、切除淋巴结数量、消化道瘘、腹腔内感染、乳糜瘘。
1.3 统计学处理 采用SPSS 20.0软件进行数据分析。选取可能引起LRG PH的危险因素,先行单因素分析,计数资料采用χ2检验,将差异有统计学意义的因素进行logistic多因素回归分析。P<0.05为差异有统计学意义。
2 结 果
362例PGC患者行LRG D2淋巴结清扫术。其中19例患者出现PH,男12例,女7例,平均(57.56±21.14)岁,BMI平均(22.18±2.96)kg/m2。 单因素分析显示,LRG D2淋巴结清扫术PH的发生与腹部手术史、BMI>24 kg/m2、肿瘤TNM Ⅲ 期、淋巴结切除超过40枚、腹腔内感染及术后消化道瘘相关(P<0.05),见表1。Logistic多因素分析结果显示,肿瘤TNMⅢ期、淋巴结切除超过40枚、术后消化道瘘及腹腔内感染为其独立危险因素,见表2。
19例患者中,5例为消化道出血,出血时间为术后(1.4±0.6)d,自胃管内抽出大量鲜血,经内镜证实为吻合口出血,内镜下通过喷洒止血剂、局部注射(无水乙醇、硬化剂/组织粘合剂等)、止血夹、氩离子凝固等方式止血成功,无再次手术或死亡病例。14例为腹腔内出血,自腹腔引流管内流出大量鲜血,出血时间为术后(5.1±3.2)d,其中6例通过静脉应用止血药物、输血等对症治疗后保守治愈;2例患者因出血量较大,1例送至手术室前已死亡,1例再次手术探查止血后送至ICU,因肺部真菌感染死亡;6例经再次手术探查后发现系吻合口出血,清扫淋巴结的创面渗血,网膜血管集束结扎后结扎线脱落导致出血,经过再次手术止血后治愈。
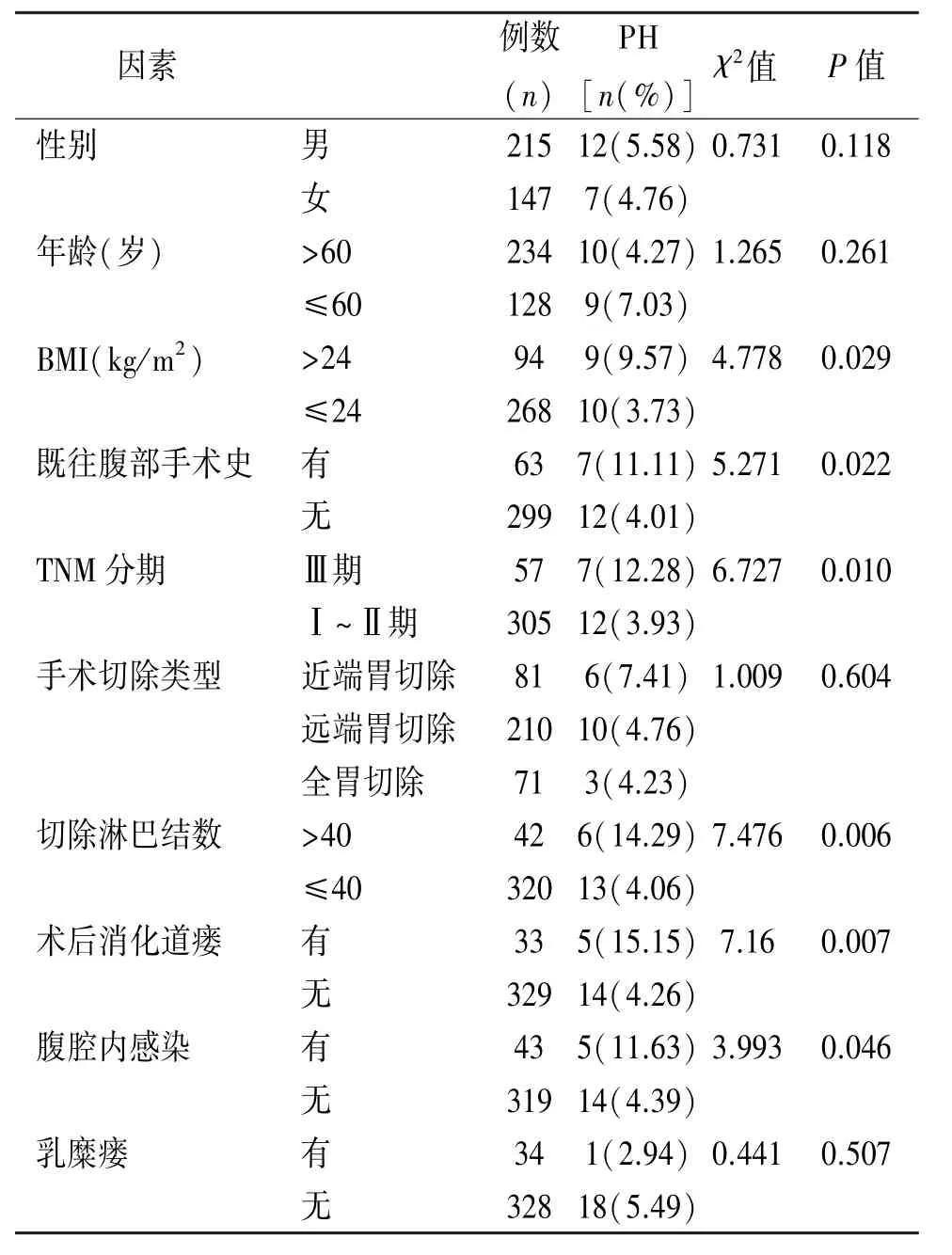
表1 LRG D2淋巴结清扫术后出血相关危险因素的单因素回归分析
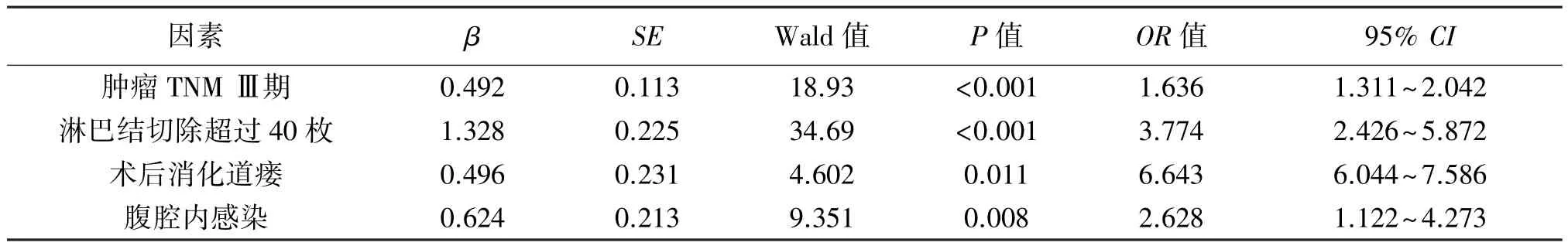
表2 LRG D2淋巴结清扫术后出血相关危险因素logistic多因素分析
3 讨 论
胃癌是最常见的消化道恶性肿瘤之一,其相关疾病的死亡率仅次于肺癌[8]。迄今为止,手术切除是胃癌最主要的治疗手段。随着腹腔镜技术的进步,腹腔镜手术已成为常用的外科手术方式。LRG在各级医院的应用数量也呈现逐年增加的趋势。虽然LRG治疗的R0切除率越来越高,但术后并发症仍是难以解决的。有学者报道,LRG术后并发症发生率为11.6%~18.7%,在一些基层医院甚至高达24.9%~42.6%[1]。PH是最为严重的并发症之一。文献报道[9],LRG术后 PH的发生率为0.6%~5.3%,死亡率较高。本研究中,PH发生率为5.25%。PH往往导致更长的住院时间、高昂的治疗费用、显著增加的死亡风险,因此有效预防胃癌根治性切除术后PH显得尤为重要。
胃癌根治性切除术后PH的危险因素仍存有争议。研究认为,广泛的淋巴结切除、肿瘤分期较晚是PH的独立危险因素[10]。Jeong等[11]回顾分析了5 739例PGC患者的临床资料,结果显示,42%的PH患者术后早期发生腹腔感染,另有62%的PH患者合并吻合口漏或胰瘘,并且男性、既往腹部手术史与胃切除术后PH相关,而与新辅助化疗无关。还有报道称,BMI与PGC胃切除术后PH相关[12]。本研究表明,切除超过40枚淋巴结、肿瘤TNM分期较晚(Ⅲ期)、腹腔内感染、术后消化道瘘的患者,发生PH的风险显著升高。为达到根治目的,外科医生必须尽可能完整切除D2淋巴结,以降低术后肿瘤复发、转移的发生率。研究证明[13],LRG D2淋巴结清扫超过40枚会使PGC预后更佳。但这些淋巴结多位于大动脉及其分支附近,切除淋巴结时,超声刀的高温可能损伤淋巴结附近血管及邻近组织,导致血管损伤、动脉瘤形成,这可能是导致PH的主要原因之一。此外,腹腔内感染常导致创面、吻合口严重的炎症反应,引起创面水肿、渗血。腹腔内感染多可导致坏死组织脱落,脱落面出血的风险大大增加,因此更容易发生PH。本研究结果还表明,术后胃肠道瘘的患者发生PH的危险性很高。这些患者发生PH的危险性是无胃肠瘘患者发生PH的6.643倍(95%可信区间:6.044~7.586,P=0.011)。 我们认为,出现此结果的主要原因是术后患者出现胃肠瘘时,消化液渗入腹腔或切口并腐蚀血管,导致动脉破裂或动脉瘤形成、破裂。根据日本第14版的《胃癌治疗法规》,进展期PGC患者常需扩大切除[14]。外科医生必要时也会尽可能多地切除周围组织,以期达到R0切除,保证预后。因此,TNM分期较晚的患者通常是PH高发人群。一旦发现LRG患者出现上述独立危险因素时,外科医生应为随后可能发生的PH做好准备,并采取严格的预防措施、适当的围手术期干预措施,以期减少出血的风险。
当独立危险因素的预测应用于临床管理时,外科医生应动态观察患者围手术期一般情况,同时根据出血的危险因素预测PH。如果患者术前评估为TNMⅢ期、术中D2淋巴结切除可能超过40枚、术后腹腔内感染或术后出现消化道瘘,应归为高危人群,尤其具有多个独立危险因素的患者,应更加严密地监测一般情况及生命体征,做好预防PH的准备,采取适当措施,如保持引流管畅通、应用生长抑素抑制消化液分泌等,这些措施会降低PH的风险。本研究以单中心资料为基础,预测LRG联合D2淋巴结清扫术后PH发生的高危因素,可帮助术者选择出血风险低的患者施行LRG联合D2淋巴结清扫,快速平稳地完成LRG学习曲线,促进LRG的发展与普及。
本研究也具有一定的局限性。首先,这是一项回顾性研究,研究对象是单一机构中的少数患者,我们希望下一步能进行更大样本量的前瞻性研究,以验证本研究的结果。第二,虽然研究结果表明LRG联合D2淋巴结清扫PH与上述因素密切相关,但如何快速准确地预测PH的危险性,缺少基于相关风险因素的评分系统,尚待多中心、大样本、前瞻性研究进一步指导评分系统的建立。
总之,进一步明确PGC患者行LRG D2淋巴结清扫术的PH独立危险因素可有效预防PH的发生,提高术者预防PH发生的风险意识。
