姜黄醇提物化学成分及其抗氧化活性分析
2019-07-05李小翠蒙春旺
刘 宇,熊 亮,彭 成,李小翠,蒙春旺,刘 菲,*,郭 力,*
(1.成都中医药大学药学院,中药材标准化教育部重点实验室,中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川 成都 611137;2.成都中医药大学,西南特色药材创新药物成分研究所,四川 成都 611137)
氧化应激反应是人类身体衰老和健康问题的最大敌人之一,人体内外多种因素诱导产生的过量自由基,可以引发氧化胁迫反应,不仅导致细胞结构损伤和功能缺失,促使机体衰老,而且会加剧阿尔茨海默病、心血管疾病、恶性肿瘤等相关疾病的发展[1-2],因此应用抗氧化剂保持人体健康和预防疾病在现代社会具有广泛的需求[3],抗氧化剂研究和开发越来越受到国内外学者的关注[4-6]。由于合成抗氧化剂具有潜在的身体危害[7-8],所以从植物中寻找高效、低毒、廉价的天然抗氧化剂成为目前抗氧化剂开发的必然趋势[9-10],目前从植物中提取分离得到的天然抗氧化剂种类繁多,其化学成分类型包括多酚类、类胡萝卜素、迷迭香等[11]。其中,酚类成分的抗氧化活性在纷繁复杂的天然产物中得到的广泛的肯定和认可[12]。
姜黄来源于姜科植物姜黄(Curcuma longa L.)的干燥根茎,富含酚类成分。研究表明姜黄具有良好的抗氧化活性[13]。赵革平等[14]研究发现姜黄醇提物是有效的抗氧化剂,但是研究限于粗提物,并未深入到具体的单体化合物水平,为进一步阐明姜黄醇提物的抗氧化活性物质基础,本实验对其醇提物中的酚类成分进行分离鉴定,并对获得的单体化合物进行了抗氧化活性筛选。
1 材料与方法
1.1 材料与试剂
姜黄饮片购于四川新荷花中药饮片有限公司,经成都中医药大学药用植物研究室龙飞教授鉴定为姜黄的干燥根茎。
甲醇(色谱纯) 美国Sigma公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2 -picrylhydrazyl,DPPH)美国Sigma公司;2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS) 南京都莱生物技术有限公司;石油醚、乙酸乙酯、二氯甲烷、甲醇、乙醇、浓硫酸、VC(均为分析纯) 成都市科隆化学品有限公司;十八烷基硅烷键合硅胶(RPC18,40~60 μmol/L) 月旭科技(上海)股份公司。
1.2 仪器与设备
Bruker-500核磁共振波谱仪 德国Bruker公司;Synapt G2 高分辨质谱仪 美国Waters公司;1220型高效液相色谱仪 美国Agilent公司;Varioska多功能酶标仪 美国Thermo Scientific公司;Sephadex LH-20葡聚糖凝胶 瑞典Amershan Pharmacia公司;Gradient Former B-687中压液相色谱仪 瑞士Büchi公司;ZF-90多功能暗箱式紫外透射仪 上海宝山顾村电光仪器厂;Milli-Q Reference超纯水仪 德国默克集团;柱色谱硅胶H和薄层色谱硅胶GF254 青岛海洋化工厂;GF254硅胶制备薄层板 烟台江友硅胶开发有限公司;Coring Costar 96孔酶标板 美国康宁公司。
1.3 方法
1.3.1 提取与分离
将姜黄饮片50 kg,加95%乙醇溶液浸泡过夜,回流提取2 次,第1次2 h,第2次1.5 h,合并提取液,50 ℃减压浓缩得干燥浸膏7 kg。浸膏加水适量成为混悬液,依次用石油醚、乙酸乙酯反复萃取,将萃取液于50 ℃减压浓缩,得石油醚萃取物1.6 kg,乙酸乙酯萃取物3 kg。
取乙酸乙酯萃取物经硅胶柱色谱(150 cm×22 cm),分别用石油醚-乙酸乙酯溶液(1∶0、7∶3、4∶6、0∶1,V/V)和乙酸乙酯-甲醇溶液(1∶1、0∶1,V/V)洗脱,每种梯度的洗脱液收集在一起,并依次编号为Fr. 1~Fr. 6,Fr. 1~Fr. 6洗脱液经50 ℃减压浓缩至浸膏状,选择Fr. 2(500 g)经硅胶柱色谱(150 cm×22 cm),用二氯甲烷-乙酸乙酯溶液(100∶1~0∶1,V/V)梯度洗脱,洗脱液每500 mL收集一份,以薄层色谱(10 cm×20 cm)检视,合并相似洗脱馏分并减压浓缩,共分得17 个馏分,依次编号为JHA~JHQ;其中,JHI组分经中压液相色谱(30 cm×4 cm),以甲醇溶液(30%~100%)梯度洗脱,洗脱液每50 mL收集一份,以薄层色谱(10 cm×20 cm)检视,合并相似馏分并减压浓缩,最后得到15 个馏分(JHI-1~JHI-15),其中JHI-2经过葡聚糖凝胶SephadexLH-20柱色谱、硅胶制备薄层色谱(20 cm×20 cm)、高效液相色谱分离得到化合物1~5,JHI-2经过葡聚糖凝胶SephadexLH-20柱色谱、硅胶制备薄层色谱反复制备得到化合物6和化合物7。
1.3.2 抗氧化活性测定
由于化合物7(香草醛)为植物常见化学成分,在植物姜黄中不属于具有代表性的成分,因此本实验选择化合物1~6进行抗氧化活性筛选。
1.3.2.1 ABTS阳离子自由基清除测定
参照曾维才等[15]的方法,稍有改变。用超纯水配制40 mL含ABTS(7 mmol/L)与过硫酸钾(2.45 mmol/L)的混合溶液,使其在23 ℃的暗处避光反应16 h,制备得到ABTS基液。然后取2 mL基液用超纯水稀释,制得在734 nm波长处吸光度为0.70±0.02的ABTS工作液。取80 μL不同浓度化合物的95%乙醇溶液与400 μL的ABTS工作液混匀,23 ℃孵育6 min,孵育液置于96 孔板中用酶标仪测定[16-17],不同浓度的孵育液分别设置3 个孔,每孔150 μL,测量反应混合物在734 nm波长处的吸光度,吸光度取平均值,以VC作阳性对照,95%乙醇溶液作空白对照。ABTS阳离子自由基清除率按公式(1)计算:
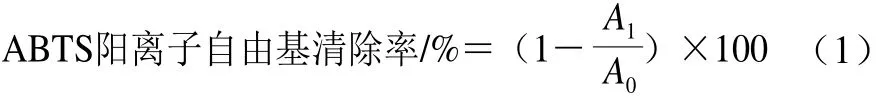
式中:A1为化合物孵育液吸光度;A0为空白对照组孵育液吸光度。
1.3.2.2 DPPH自由基清除率测定
参考曾维才等[15]的方法,稍有改变。以95%乙醇溶液为溶剂配制浓度为0.1 mmol/L的DPPH溶液,此溶液需现配现用。取250 μL不同浓度的受试物溶液同250 μL DPPH溶液混合,25 ℃避光孵育30 min,孵育液置于96 孔板中测定,不同浓度的孵育液分别设置3 个孔,每孔150 μL,测量反应混合物在517 nm波长处的吸光度,吸光度取平均值,以VC作阳性对照,95%乙醇溶液作空白对照。DPPH自由基清除率按公式(2)计算:
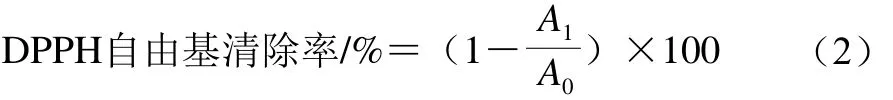
式中:A1为化合物孵育液吸光度;A0为空白对照组孵育液吸光度。
1.3.2.3 还原力测定
参考曾维才等[15]的方法,稍有改变。取100 μL不同浓度的受试物溶液,与100 μL磷酸缓冲液(0.2 mmol/L,pH 6.6)和100 μL质量分数l%铁氰化钾溶液混匀,50 ℃孵育20 min,迅速冷却,加入100 μL质量分数10%三氯乙酸溶液,混合后,加入100 μL超纯水和20 μL 0.1%三氯化铁溶液,混匀,混合液置于96 孔板中测定,不同浓度的混合液分别设置3 个孔,每孔150 μL,测量反应混合物在700 nm波长处的吸光度,吸光度取平均值,以VC为阳性对照,95%乙醇溶液为空白对照。
1.4 数据统计
ABTS阳离子自由基清除实验和DPPH自由基清除率测定实验的半抑制浓度IC50值用SPSS 18.0的Probit Regression计算;还原力测定实验吸光度与给药浓度之间的关系以GraphPad Prism 5绘制折线图表示。
2 结果与分析
2.1 化合物结构鉴定
本实验共分离鉴定得到7 个化合物,依次编号为化合物1~7,采用Bruker-500核磁共振波谱仪,以氘代丙酮(CD3COCD3)为溶剂,对化合物1~7进行核磁共振氢谱分析,以Waters Synapt G2高分辨质谱仪对化合物1~7进行分子式、分子质量分析,将化合物1~7以硅胶GF254为载体进行薄层展开,以多功能暗箱式紫外透射仪、10%硫酸乙醇试剂对化合物进行检视,研究其理化性质,以FeCl3试剂进行酚羟基反应验证其化学结构中酚羟基的有无。结果发现,化合物4为新天然产物,化合物1、2、3和6为姜黄属首次发现,化合物7为香草醛(略去),结构鉴定如图1所示。
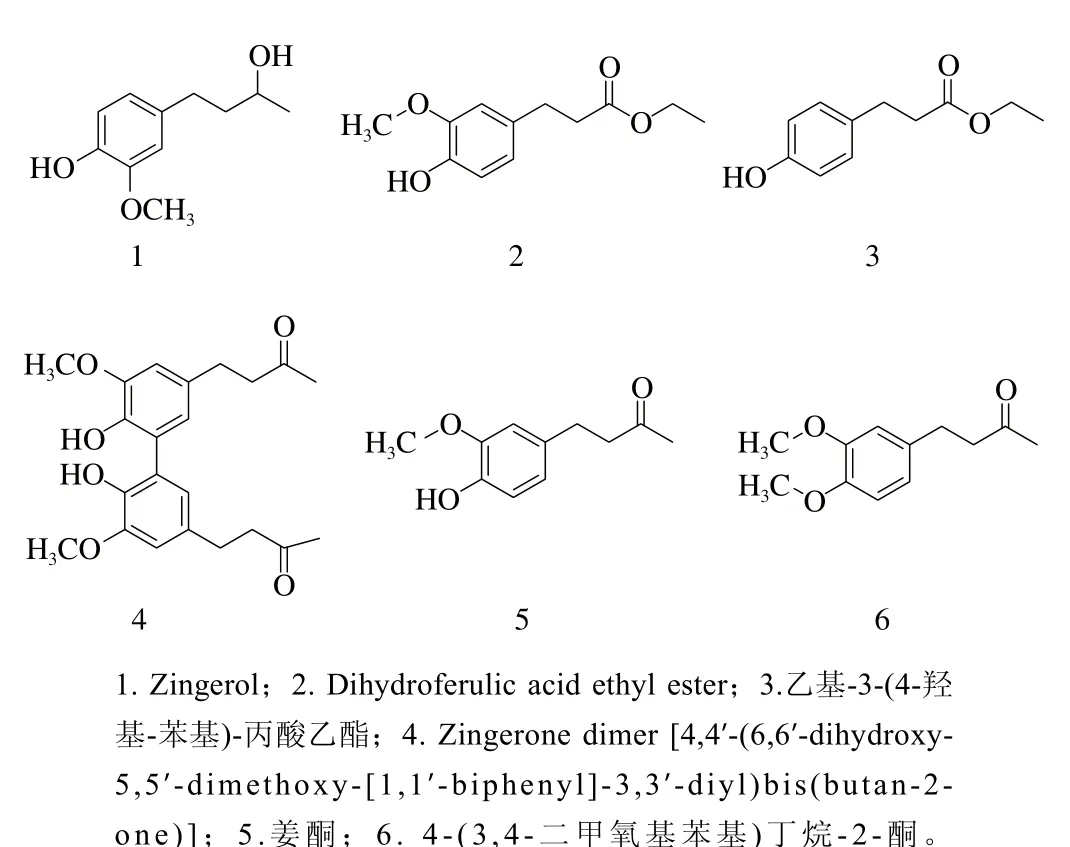
图1 化合物1~6化学结构式Fig. 1 Chemical structures of compounds 1 to 6
化合物1:无色油状物,[α]D25=+9.76(c 0.27,EtOH),以多功能暗箱式紫外透射仪进行薄层检视,在254 nm波长处呈现明显的暗斑,硫酸乙醇显色为蓝紫色,与FeCl3反应呈阳性,HR-ESI-MS给出准分子离子峰m/z 219.089 6[M+Na]+,提示其分子式为C11H16O3(理论计算值C11H16O3Na,219.099 7),不饱和度为4。1H NMR(500 MHz,CD3COCD3)δ:7.23(1H,s,Ar-OH),6.81(1H,s,H-2’),6.72(1H,d,J = 8.0 Hz,H-5’),6.64(1H,d,J = 8.0 Hz,H-6’),3.82(3H,s,—OCH3),3.72(1H,m,H-2),3.47(1H,d,J = 5.0 Hz,—OH),2.66(1H,m,H-4a),2.56(1H,m,H-4b),1.67(2H,m,H-3a,H-3b),1.14(3H,d,J = 6.0 Hz,—CH3)。以上数据和文献[18]对照一致,鉴定为Zingerol,结构式见图1。
化合物2:无色油状物,以多功能暗箱式紫外透射仪进行薄层检视,在254 nm波长处呈现明显的暗斑,硫酸乙醇显色为蓝紫色,与FeCl3反应呈阳性,HR-ESI-MS给出准分子离子峰m/z 247.095 3[M+Na]+,提示其分子组成为C12H16O4(理论计算值C12H16O4Na,247.084 1),不饱和度为5。1H NMR(500 MHz,CD3COCD3)δ:7.33(1H,br s,Ar-OH),6.85(1H,d,J = 2.0 Hz,H-2’),6.73(1H,d,J = 8.0 Hz,H-5’),6.67(1H,dd,J = 8.0,2.0 Hz,H-6’),4.07(2H,q,J = 7.0 Hz,—CH2—),3.83(3H,s,—OCH3),2.82(2H,t,J = 7.5 Hz,H-3a,H-3b),2.56(2H,t,J = 7.5 Hz,H-2a,H-2b),1.19(3H,t,J = 7.0 Hz,—CH3)。以上数据和文献[19]对照一致,鉴定为Dihydroferulic acid ethyl ester,结构式见图1。
化合物3:无色油状物,以多功能暗箱式紫外透射仪进行薄层检视,在254 nm波长处呈现明显的暗斑,硫酸乙醇显色为蓝紫色,与FeCl3反应呈阳性,HR-ESI-MS给出准分子离子峰m/z 217.082 5[M+Na]+,推测其分子式为C11H14O3(理论计算值C11H14O3Na,217.084 1),不饱和度为5。1H NMR(500 MHz,CD3COCD3)δ:8.16(1H,br s,Ar-OH),7.05(2H,d,J = 8.5 Hz,H-2’,H-6’),6.74(2H,d,J = 8.5 Hz,H-3’,H-5’),4.06(2H,q,J = 7.0 Hz,—CH2—),2.81(2H,t,J = 7.5 Hz,H-3a,H-3b),2.53(2H,t,J = 7.5 Hz,H-2a,H-2b),1.18(3H,t,J = 7.0 Hz,—CH3)。以上数据和文献[20]对照一致,鉴定为乙基-3-(4-羟基-苯基)-丙酸乙酯,结构式见图1。
化合物4:无色油状物,以多功能暗箱式紫外透射仪进行薄层检视,在254 nm波长处呈现明显的暗斑,硫酸乙醇显色为蓝紫色,与FeCl3反应呈阳性,HR-ESI-MS给出准分子离子峰m/z 409.163 4[M+Na]+,提示其分子式为C22H26O6(理论计算值C22H26O6Na,409.162 7),不饱和度为10。1H NMR(500 MHz,CD3COCD3)δ:6.84(2H,d,J = 2.0 Hz,H-2,H-2’),6.71(2H,d,J = 2.0 Hz,H-4,H-4’),3.86(6H,s,—OCH3×2),2.79(8H,s,H-1a,H-1b,H-1a’,H-1b’,H-2a,H-2b,H-2a’,H-2b’),2.10(6H,s,—CH3×2)。以上数据和文献[21]对照,鉴定为化合物Zingerone dimer [4,4’-(6,6’-dihydroxy-5,5’-dimethoxy-[1,1’-biphenyl]-3,3’-diyl)bis(butan-2-one)],该化合物为首次从植物中分离鉴定,为新颖的天然产物,且为化合物5的二聚体,结构式见图1。
化合物5:无色油状物,以多功能暗箱式紫外透射仪进行薄层检视,在254 nm波长处呈现明显的暗斑,硫酸乙醇显色为蓝紫色,与FeCl3反应呈阳性,HR-ESI-MS给出准分子离子峰m/z 217.083 8[M+Na]+,提示其分子式为C11H14O3(理论计算值C11H14O3Na,217.084 1),不饱和度为5。1H NMR(500 MHz,CD3COCD3)δ:7.28(1H,s,Ar-OH),6.82(1H,d,J = 2.0 Hz,H-2’),6.71(1H,d,J = 8.0 Hz,H-5’),6.64(1H,dd,J = 8.0,2.0 Hz,H-6’),3.82(3H,s,—OCH3),2.74(4H,s,H-3a,H-3b,H-4a,H-4b),2.08(3H,s,—CH3)。以上数据和文献[22]对照一致,鉴定为姜酮,结构式见图1。
化合物6:无色油状物,以多功能暗箱式紫外透射仪进行薄层检视,在254 nm波长处呈现明显的暗斑,硫酸乙醇显色为蓝紫色,与FeCl3反应呈阴性,HR-ESI-MS给出准分子离子峰m/z 231.099 6[M+Na]+,提示其分子式为C12H16O3(理论计算值C12H16O3Na,231.099 7),不饱和度为5。1H NMR(500 MHz,CD3COCD3)δ:6.83(1H,s,H-2’),6.82(1H,d,J = 8.0 Hz,H-5’),6.72(1H,dd,J = 8.0,2.0 Hz,H-6’),3.78(3H,s,—OCH3at C4’),3.76(3H,s,—OCH3at C3’),2.76(4H,s,H-3a,H-3b,H-4a,H-4b),2.08(3H,s,—CH3)。以上数据和文献[23]对照,鉴定为化合物4-(3,4-二甲氧基苯基)丁烷-2-酮,结构式见图1。
化合物7:无色油状物,有特殊香味,以多功能暗箱式紫外透射仪进行薄层检视,在254 nm波长处呈现明显的暗斑,硫酸乙醇显色为蓝紫色,与FeCl3反应呈阳性,HR-ESI-MS给出准分子离子峰m/z 175.031 4[M+Na]+,提示其分子式为C8H8O3(理论计算值C8H8O3Na,175.037 1),不饱和度为6。1H NMR(500 MHz,CD3COCD3)δ:9.82(1H,s,—CHO),7.45(1H,d,J = 8.0 Hz,H-6),7.44(1H,s,H-2),7.00(1H,d,J = 8.0 Hz,H-5),3.93(3H,s,—OCH3)。以上数据和文献[24]对照,鉴定为香草醛。
2.2 化合物的抗氧化活性
2.2.1 ABTS阳离子自由基的清除

表1 化合物1~6对ABTS阳离子自由基、DPPH自由基的IC50Table 1 Half maximal inhibitory concentration (IC50) of compounds 1 to 6 against ABTS radical cations and DPPH radicals
根据不同浓度受试物对ABTS溶液吸光度的影响测定天然产物对ABTS阳离子自由基的清除能力,该方法最早由Miller等提出[25]。如表1所示,阳性对照VC的IC50为(13±1.1)μmol/L,化合物1~6中,化合物1对ABTS阳离子自由基的清除效果最好,IC50为(3±0.2)μmol/L,效果远强于阳性对照,化合物2效果和VC效果相当,化合物3效果为VC的1/2,化合物4对ABTS阳离子自由基有一定的清除效果,化合物5对ABTS阳离子自由基清除作用较弱,化合物6与阳性对照对比清除作用非常弱,几乎无效。
2.2.2 DPPH自由基的清除
DPPH自由基清除实验中,受试物给出的氢原子与DPPH自由基结合,使反应溶液的吸光度发生变化,通过比较实验组与空白组溶液吸光度的变化评价受试物的抗氧化活性结果[26]。如表1所示,阳性对照VC对DPPH自由基清除率的IC50为(7±0.3)μmol/L,效果最好的是2号化合物,IC50为(16±1.2)μmol/L,清除效果约为阳性对照的1/2,另外化合物1清除DPPH自由基的效果也较好,IC50为(65±4.4)μmol/L,化合物4、5对DPPH自由基有一定的清除效果,化合物6对DPPH几乎无清除作用。
2.2.3 还原力
研究表明,还原能力是表征物质在氧化还原反应中给出电子自身发生氧化的能力,既是物质抗氧化活性的重要表现,又是对其抗氧化能力的合理解释[27],研究中通常采用三价铁离子还原法观察物质的还原能力,吸光度越高,还原能力越强[28],化合物1、2、4及VC还原能力筛选时选择的浓度分别为0.250、0.125、0.063、0.032、0.016 μmol/mL,结果如图2所示。化合物1还原能力最强,其5 个浓度梯度的吸光度均高于VC,化合物2在浓度低于0.125 μmol/mL时还原能力强于VC,超出0.125 μmol/mL时还原力与VC逐渐接近,在筛选浓度范围内,化合物4具有一定的还原能力,但是比VC更弱。化合物3、5、6还原能力筛选时,选择的浓度为1.000、0.500、0.250、0.125、0.063 μmol/mL,如图2所示,其还原能力远弱于VC,因此其抗氧化能力很弱。
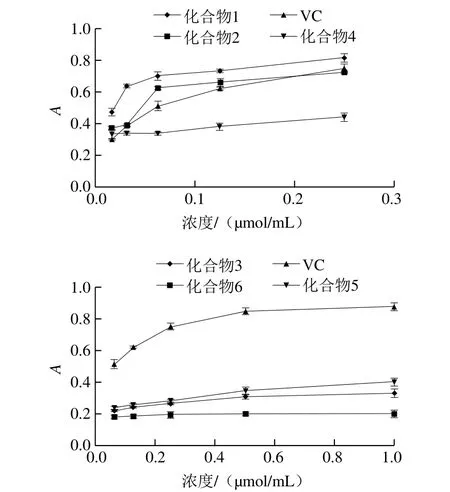
图2 化合物1~6还原力Fig. 2 Reducing power of compounds 1-6
3 讨 论
本实验对姜黄醇提物乙酸乙酯部位的化学成分进行了分离,共分离得到了7 个单体化合物,分别为Zingerol(1)、Dihydroferulic acid ethyl ester(2)、乙基-3-(4-羟基-苯基)-丙酸乙酯(3)、Zingerone dimer[4,4’-(6,6’-dihydroxy-5,5’-dimethoxy-[1,1’-biphenyl]-3,3’-diyl)bis(butan-2-one)](4)、姜酮(5)、4-(3,4-二甲氧基苯基)丁烷-2-酮(6)、香草醛(7)。从生源途径看,姜黄中含有大量的姜黄素,其母核为二苯庚烷,骨架可通过化合物1、化合物5、化合物6脂肪链上C-1位聚合一个相同母核的化合物而形成,化合物2、3为化合物1、5、6类似物,由此可见本实验分离得到的一系列化合物不是姜黄素,而是姜黄素的前体化合物;不同的是,化合物4为化合物5为通过C-5’位自身聚合而形成的二聚体,这种聚合方式在姜黄及姜黄属植物化学成分的形成途径中非常罕见新颖,通过美国化学学会SciFinder数据库检索发现,虽然化合物4已有化学合成产物,但却是首次从自然界中发现的新天然产物,这对于将来姜黄属植物化学成分及其生物合成途径研究具有重要的指导意义。
本实验采用ABTS阳离子自由基清除实验、DPPH自由基清除实验、还原力实验对分离得到的化合物1~6进行了抗氧化能力评价,综合3 种实验结果可以看出,化合物1的抗氧化能力最强,且活性总体强于阳性对照VC,另外化合物2的抗氧化能力也较强,稍微弱于阳性对照VC,除化合物6以外,其余化合物均有一定的抗氧化能力,不同方法活性略有不同。6 种化合物中,只有化合物1脂肪链的2位被羟基取代,其余均为羰基,根据文献报道,化合物羟基取代的有无及位置对其抗氧化活性具有影响[29],因此本实验推测化合物1抗氧化能力最强的原因可能是由于其脂肪链上有羟基取代,脂肪链2位上的羟基有无对其抗氧化活性具有重要影响。在此研究基础上,结合化合物6在3 种抗氧化实验中抗氧化能力都极其微弱,其结构式中羟基全部甲基化,而另外5 个化合物具有一定的抗氧化活性,其结构式中只有部分羟基甲基化,均具有1~2 个羟基,张华等[30]报道过酚羟基的甲基化会降低一些酚类物质的自由基清除能力,酚羟基数目越多,抗氧化活性越强,本研究也印证了其观点。同时,本次分离得到的酚类化合物均显示了一定程度的抗氧化活性,表明姜黄醇提物中的酚类成分是姜黄抗氧化活性的物质基础之一。
