基于Caspase信号通路研究血府逐瘀汤抑制心肌梗死凋亡的作用和机制*
2019-07-05孙国兴杨洪庆贾秀凤吕增禄黄海潮郑公铭
孙国兴 ,杨洪庆 ,贾秀凤 ,吕增禄 △,黄海潮 ,郑公铭
(1.河北省沧州市人民医院,河北 沧州 061000; 2.广东食品药品职业学院,广东 广州 510520)
传统中医理论认为,心肌梗死的症候群主要为心脉瘀阻、气虚血滞,故多使用活血通脉、行气化瘀的药物治疗[1]。血府逐瘀汤是清代医家王清任《医林改错》中的名方,由桃仁、当归、红花、枳壳等11味中药组方,广泛用于治疗多种淤血病证[2],对心血管疾病疗效确切且安全[3]。近年的研究发现,许多心血管疾病的发生、发展与细胞的程序性死亡(又称凋亡)密切相关,心肌细胞因缺血损伤而引发凋亡可能是心肌梗死发病机制的一个重要环节[4]。半胱天冬蛋白酶家族(Caspase)是诱导细胞凋亡的关键调控因子,根据起始激活的Caspase不同,凋亡途径可分为Caspase-8启动的外源性途径、Caspase-9启动的内源性途径、Caspase-12(鼠类)启动的内质网途径,3种途径分别涉及炎症病理、线粒体异常和钙离子超载等引起心肌损伤凋亡的关键因素[5]。目前,已有学者通过检测Caspase-3的活性研究血府逐瘀汤抑制心肌缺血和神经缺氧引起凋亡的作用[6-7]。但Caspase-3是细胞执行3种凋亡途径的汇合点,仅对Caspase-3的研究不能充分说明血府逐瘀汤是通过抑制哪一条途径发挥对缺血心肌的保护作用[8]。因此,本试验中拟通过建立大鼠心肌梗死模型,进一步研究血府逐瘀汤抑制缺血心肌凋亡的作用和机制[9]。
1 材料与方法
1.1 材料
动物:SPF级6周龄Wistar雄性大鼠50只,体质量(198±9.7)g,购于河北大学实验动物中心,许可证号为SCXK (冀)2003-1-003。
试药:桃仁Semen Persicae,红花Carthamus tinctoriusL.,当归Angelica sinensis,生地黄Rehmannia glutinosaLibosch.,川芎Ligusticum chuanxiongHort.,赤芍PaeonialactifloraPall.,牛 膝Achyranthes bidentata Blume,桔梗Platycodon Grandiflorum,柴胡Radix Bupleuri,枳壳Citrus aurantiumL.,甘草Glycyrrhiza uralensisFisch.,均购于石家庄以岭药业股份有限公司,经沧州市人民医院主管中药师吕增禄通过显微镜观察、薄层色谱、高效液相色谱(HPLC)指纹图谱等方法鉴定,均符合现行《中国药典》标准。血清标志物检测试剂均购于碧云天生物技术研究所,相关蛋白含量测定试剂盒购于生工生物工程(上海)股份有限公司,活性测定试剂盒均购于美国Biovision公司,硫化钠(Na2S)、水合氯醛、苏木素、伊红溶液均购于上海阿拉丁生化技术有限公司。
仪器:DK-200BS型全自动酶标仪(美国Diatek公司);AU5800型生化分析仪(美国 Beckma公司);Elecsys2010型免疫分析仪(罗氏诊断产品<上海>有限公司);VCX750型超声匀浆器(美国Cole-Parmer公司);SorvallST40型台式离心机(美国ThermoScientific公司)。
1.2 血府逐瘀汤制备
按组方比例,称取桃仁120 g,红花、当归、生地黄、牛膝各90 g,川芎、桔梗各45 g,赤芍、枳壳、甘草各60 g,柴胡30 g,加入生药材20倍量纯化水,浸泡1 h,加热保持微沸状态煎煮60 min,待煎液冷却后过滤渣粒,用旋转蒸发仪将药液浓缩至含生药1 g/mL,4℃冷藏备用。试验时提前取出,水浴加热至37℃。
1.3 动物分组及处理
将50只大鼠随机分为模型组、假手术组和低、中、高剂量(10,20,30 g/kg)药物组,各 10 只。药物组大鼠加入纯化水稀释至10 mL后灌胃,每日2次;模型组和假手术组予10 mL生理盐水灌胃,每日2次。
1.4 大鼠心肌梗死模型建立
各组大鼠经腹腔内注射水合氯醛(每100 g体质量0.3 mL)麻醉,仰卧固定于操作台上,用Na2S溶液脱去胸前杂毛,记录正常Ⅱ导联心电图,消毒后剪开胸骨,以10号线荷包缝合;剥离肋间肌肉,于第3~4肋间钝性开胸,充分暴露心脏;在左心耳和肺动脉圆锥间找到与左冠状动脉伴行的冠状静脉,于左心耳下2~3 mm处用6~0号无损伤缝合线结扎,宽度为0.2~0.3 cm;将心脏沿肋间间隙放回胸腔,迅速挤出胸腔内气体拉紧荷包缝合线缝合切口;假手术组只穿线不结扎。手术后测Ⅱ导联心电图,以心电图S-T段明显抬高为模型制备成功的标志,术后肌肉注射青霉素预防感染[10]。
1.5 观察指标与检测
心电图监测:各组大鼠腹腔注射水合氯醛(每100 g体质量0.3 mL)麻醉,仰卧固定于操作台上,记录手术前、手术后及给药7 d的Ⅱ导联心电图S-T段变化。
心肌损伤血清标志物:固定好已麻醉的大鼠,清洁尾部污垢,剪去尾尖2~3 mm,用手从尾根向下轻轻挤压,将血液收集于离心管中至1.0 mL,静置30 min,3 000 r/min离心,吸取500 μL血清,按常规操作流程测定乳酸脱氢酶(LDH)、肌酸激酶同工酶(CK-MB)、心肌肌钙蛋白 I(cTnI)及 N末端脑利钠肽原(NT-pro BNP)、肿瘤坏死因子 -α(TNF-α)。
HE染色观察心肌组织形态及凋亡途径:将麻醉好的大鼠仰卧固定于操作台上,沿剑突开始剪开胸骨,充分暴露胸腔,剪断各条血管连通心脏的血管,迅速取出心脏,清除腔内血液后,剪成两部分,一部分置10%多聚甲醛溶液中固定1周,常规梯度脱水、石蜡包埋,切片,厚度为5 μm,以苏木素与伊红进行染色,于显微镜下观察各组大鼠心肌组织形态。另一部分置4℃预冷冰袋的培养皿内剪碎,称取约100 mg,在冰浴条件下用超声匀浆器制成匀浆,4℃条件下3 000 r/min离心10 min,吸取上清液以微孔滤膜过滤,二喹啉甲酸(BCA)法测定各样品的总蛋白含量,作为参考调整后续试验的上样量。检测按照各试剂盒说明书严格进行操作测定。钙蛋白酶(Calpain)的活性以相对荧光强度(RFI)表示。
氧化应激指标:称取心肌组织100 mg,按凋亡途径,冰浴条件下制成匀浆,4℃条件下3 000 r/min离心10 min。吸取上清液,按相应检测试剂盒说明书操作,以酶标仪采用比色法检测并计算超氧化物歧化酶(SOD)的活性和丙二醛(MDA)含量。
1.6 统计学处理
采用SPSS18.0统计学软件分析。试验数据以表示,假手术组与模型组比较采用t检验,模型组与药物组比较采用单因素方差分析(One-way ANOVA)。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠心电图S-T段变化
与假手术组比较,造模后大鼠的心电图S-T段均明显抬高(P<0.01),表明造模成功;与模型组比较,各药物组S-T段均随时间的延长而逐渐下降,剂量越高下降趋势越大,给药第5天各组S-T段的下降水平开始有统计学意义(P<0.05),第6天和第7天下降程度更显著(P<0.01)。说明血府逐瘀汤对模型大鼠的心肌梗死状况具有剂量依赖性改善作用。详见图1。
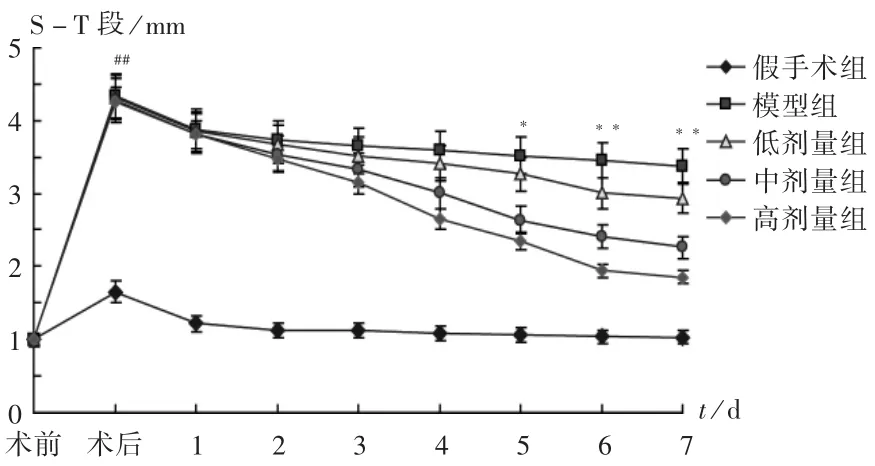
图1 各组大鼠心电图S-T段变化(± s,n=10)
2.2 血清标志物检测结果
与假手术组相比,模型组大鼠血清标志物各浓度均显著升高(P<0.01),表明其心肌组织出现缺血损伤坏死。与模型组比较,各药物组血清标志物浓度均显著下降(P<0.05),其中高剂量组下降水平更明显(P<0.01),表明各药物组大鼠的心肌损伤状况均得到不同程度缓解,且与药物剂量呈正相关。详见表1。
表1 大鼠血清标志物浓度检测结果(± s,n=10)

表1 大鼠血清标志物浓度检测结果(± s,n=10)
指标 假手术组 模型组CK-MB(U/L)LDH(U/L)cTnI(ng/mL)NT-pro BNP(ng/L)TNF-α(μg/mL)985.02±71.16 164.37±15.87 376.64±30.74 122.08±11.64 1.62±0.45 1 928.27±167.11##248.07±23.54##854.33±71.84##256.21±32.04##2.35±0.57#低剂量组1 709.74±138.20*227.35±13.42*708.47±45.18 223.17±19.30*2.01±0.60*药物组中剂量组1 523.35±121.19*198.21±15.75*550.47±36.85*198.50±14.35*1.80±0.52*高剂量组1 213.98±98.97**178.37±15.44**422.08±43.56**140.65±17.89**1.70±0.44**
2.3 心肌组织形态变化
HE染色结果见图2。可见,假手术组心肌组织未见明显病理形态改变,细胞排列紧密,横纹清晰;模型组大鼠心肌组织病理学改变较明显,细胞明显肿胀,部分心肌细胞变性、坏死,肌束排列不整齐,出现较大间隙,并有大量炎性细胞浸润;低剂量组细胞肿胀及肌束紊乱程度较模型组减轻;中剂量组有炎性细胞浸润,细胞肿胀轻度,肌束紊乱程度有所改善;高剂量组肌束排列较整齐,炎性细胞浸润中度,细胞溶解情况减少。

图2 HE染色观察心肌组织的形态变化(×200)
2.4 Caspase凋亡通路相关蛋白检测结果
与假手术组相比,模型组大鼠心肌组织中Bcl-2表达水平显著下调而Bax表达水平则显著增加(P<0.01),Bcl-2/Bax比值显著减少(P<0.05),Cyt C含量显著增加(P< 0.05),Calpain,Caspase-8,Caspase-9,Caspase-12,Caspase-3活性均增强(P<0.01),表明模型组缺血心肌细胞中凋亡相关蛋白已相继激活。与模型组比较,各药物组随着用药剂量的增加,Bcl-2/Bax比值逐渐增加(P<0.05),Cyt C 含量显著减少(P<0.05),Calpain,Caspase-8,Caspase-9,Caspase-12,Caspase-3活性均逐渐下降(P<0.05),初步表明血府逐瘀汤可从Caspase-8,Caspase-9,Caspase-12 这 3条凋亡途径抑制心肌细胞的凋亡。详见表2。
表2 Caspase凋亡通路相关蛋白检测结果(± s,n=10)
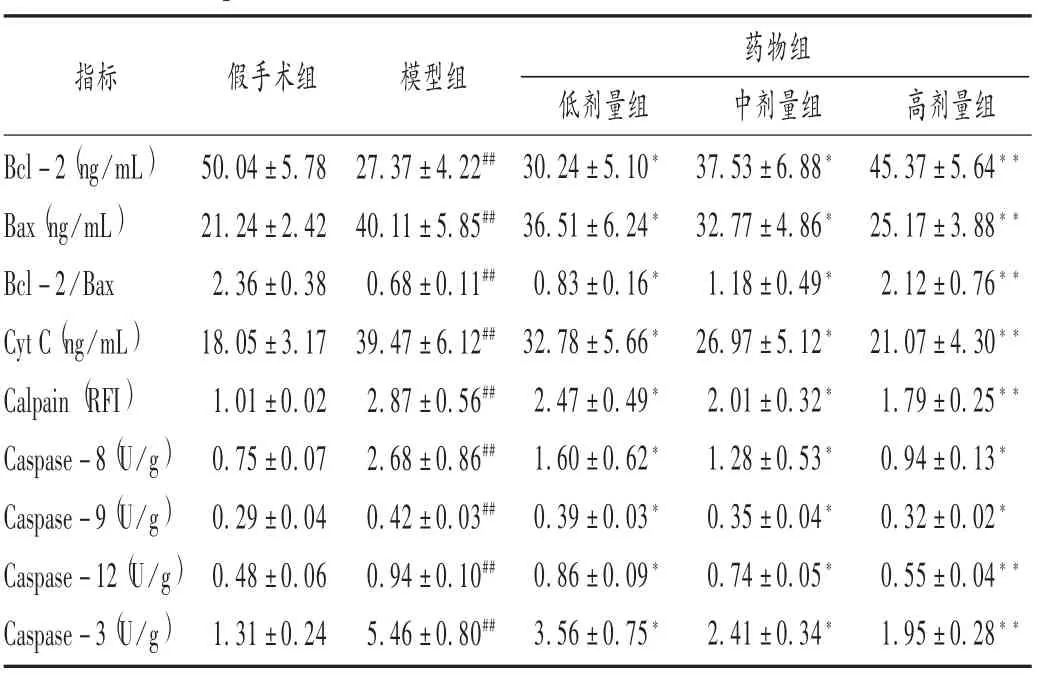
表2 Caspase凋亡通路相关蛋白检测结果(± s,n=10)
指标 假手术组 模型组Bcl-2(ng/mL)Bax(ng/mL)Bcl-2/Bax Cyt C(ng/mL)Calpain(RFI)Caspase-8(U/g)Caspase-9(U/g)Caspase-12(U/g)Caspase-3(U/g)50.04±5.78 21.24±2.42 2.36±0.38 18.05±3.17 1.01±0.02 0.75±0.07 0.29±0.04 0.48±0.06 1.31±0.24 27.37±4.22##40.11±5.85##0.68±0.11##39.47±6.12##2.87±0.56##2.68±0.86##0.42±0.03##0.94±0.10##5.46±0.80##低剂量组30.24±5.10*36.51±6.24*0.83±0.16*32.78±5.66*2.47±0.49*1.60±0.62*0.39±0.03*0.86±0.09*3.56±0.75*药物组中剂量组37.53±6.88*32.77±4.86*1.18±0.49*26.97±5.12*2.01±0.32*1.28±0.53*0.35±0.04*0.74±0.05*2.41±0.34*高剂量组45.37±5.64**25.17±3.88**2.12±0.76**21.07±4.30**1.79±0.25**0.94±0.13*0.32±0.02*0.55±0.04**1.95±0.28**
2.5 MDA含量和SOD活性检测结果
与假手术组相比,模型组大鼠心肌组织中的MDA含量显著升高,SOD活性显著下降(P<0.01),表明大鼠的心肌组织已出现氧化应激损伤,细胞脂质结构受到氧化破坏。与模型组相比,各药物组随着用药剂量的增加,MDA含量均逐渐降低(P<0.05),SOD活性均显著增加(P<0.05),其中高剂量组的作用最明显(P<0.01),表明血府逐瘀汤能抑制氧化应激反应对细胞造成的损伤。详见图3。
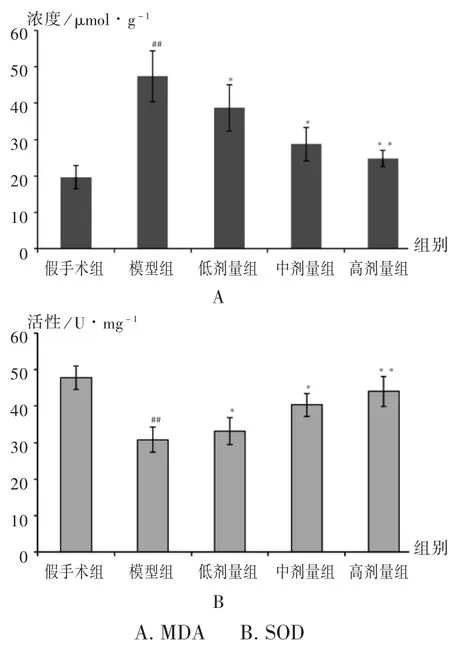
图3 心肌组织中MDA含量和SOD活性(± s,n=10)
3 讨论
Caspase是一类与凋亡密切相关的蛋白水解酶家族,其成员在氨基酸序列、结构及酶的特性上均相似,通常以无活性的酶原形式存在大多数动物细胞中[11]。Caspase酶原必须通过自身活化或相互激活,重新组装形成活性复合物,才能启动凋亡程序。目前,经典的细胞凋亡途径包括3条由不同Caspase成员启动的途径。Caspase-8启动的外源性途径,又称死亡受体途径;Caspase-9启动的内源性途径,又称线粒体途径及Caspase-12(鼠类)启动的内质网途径。由各条Caspase凋亡通路的信号传递阐明血府逐瘀汤抑制缺血心肌细胞凋亡的作用机制:1)外源性途径始于细胞表面死亡受体Fas、TNFR1(TNF Receptor-1)的激活,当 FasL(Fas Ligand)和TNF-α等凋亡信号分子作用于相应的受体,使凋亡复合物在胞内逐步形成。凋亡复合物的死亡效应区可与Caspase-8酶原结合而使其活化[12]。活化的Caspase-8激活下游的Caspase-3,最终导致细胞的凋亡。本试验对TNF-α和Caspase-8的检测结果表明,血府逐瘀汤可阻止TNF-α参与形成凋亡复合物,抑制Caspase-8活化,最终避免激活Caspase-3促进细胞凋亡。2)内源性细胞凋亡途径始于线粒体的异常或损伤,因此也称为线粒体途径。在梗死的心肌组织中,常出现缺血-再灌注的情况,从而导致胞内氧自由基发生累积[13],线粒体外膜受到氧化损伤[14],此时促进细胞存活的Bcl-2和促进细胞凋亡的Bax表达量发生逆转,导致线粒体膜通透性增大[15],大量Cyt C释放至细胞质中并激活Caspase-9酶原。活化后的Caspase-9可激活下游的Caspase-3而最终导致细胞凋亡[16]。本试验中对MDA和SOD的检测结果表明,血府逐瘀汤可降低心肌缺血-再灌注产生的氧自由基,通过上调Bcl-2和下调Bax表达量,进而抑制Cyt C释放入胞浆激活Caspase-9,发挥抗凋亡作用。3)内质网凋亡途径主要与内质网应激反应有关。心肌细胞的肌质网是肌纤维内特化的滑面内质网,其通过膜上的Ca2+-ATP泵将胞质中的Ca2+泵入肌质网中储存,当心肌组织发生缺血再灌注时,肌浆网大量Ca2+释放入胞质,造成Ca2+超载,以致激活钙依赖性蛋白酶Calpain,使Caspase-12活化,进而激活下游的Caspase-3,形成凋亡程序的联级反应[17]。本试验中对Calpain和Caspase-12的检测结果可从侧面反映,血府逐瘀汤可抑制心肌缺血-再灌注发生的Ca2+超载,从而阻止Caspase-12活化传递凋亡信号。
天然药物化学研究表明,组成血府逐瘀汤的多种药材中含有大量的黄酮、皂苷、香豆素等活性物质,其中黄酮因结构上含有多个酚羟基而能还原氧自由基和络合Ca2+[18],皂苷可抑制巨噬细胞释放TNF-α的抗炎活性[19],香豆素能抑制血栓形成,维持血流通畅。可见,血府逐瘀汤所含药效物质均可能参与调控Caspase-8,Caspase-9,Caspase-12这3条凋亡途径而发挥保护缺血心肌的作用。
