三七总皂苷对脑缺血再灌注大鼠神经血管单元的影响*
2019-07-05农立宇黄建敏李雪斌蒙兰青
林 军,梁 萍,黄 清,李 冲,农立宇,黄建敏,李雪斌,蒙兰青
(右江民族医学院,广西 百色 533000)
三七总皂苷(PNS)是我国名贵中药三七的有效活性成分,治疗脑梗死的临床疗效明显[1]。局灶性脑缺血时,神经血管单元(NVU)中的神经元、胶质细胞和微血管均受到损伤[2],因此缺血性脑损伤是多环节、多因素、多途径的损伤,寻求对脑缺血损伤后有整合作用的药物很有意义。本研究中建立了大鼠局灶性脑缺血再灌注模型,观察大鼠缺血灶周边脑组织NVU超微结构及相关的神经核抗原(NeuN)、胶质纤维酸性蛋白(GFAP)和层粘连蛋白(LN)在不同时间点的表达变化,以探讨PNS对脑缺血后NVU的影响,阐明PNS在脑缺血治疗中的整合作用机制。
1 材料与方法
1.1 材料
动物:SD雄性大鼠144只,SPF级,体质量250~300 g,由广西医科大学实验动物中心提供,许可证号为SCXK(桂)2014-0002,实验动物使用许可证号为SYXK(桂)2011-0010。饲养于SPF级动物实验室。
仪器与试药:H-7650型透射电子显微镜(日本日立公司);电转仪(美国Bio-Rad公司)。三七总皂苷[注射用血栓通(冻干),广西梧州制药(集团)股份有限公司,国药准字Z20025652,批号为15090707,规格为每支100 mg、150 mg、250 mg]。戊二醛固定液(电镜专用,2.5%),4%多聚甲醛(北京 Solarbio公司);RIPA裂解液,BCA蛋白定量(增强型)试剂均购于碧云天生物技术有限公司;兔抗NeuN抗体、兔抗GFAP抗体、兔抗betaActin抗体均购于武汉Proteintech公司;兔抗Anti-Laminin抗体(ab11575,美国 Abcam 公司)。
1.2 方法
分组与给药:将144只大鼠随机分为假手术组、模型组和治疗组,各48只;各组又分别按脑缺血再灌注后 24 h、72 h、7 d、3周分为 4个亚组,各 12只。治疗组大鼠在术后4 h神经功能评分后即给予三七总皂苷50 mg/kg腹腔注射,之后每日1次,直到相应的时间点;模型组和假手术组大鼠在相同时间点给予同体积0.9%氯化钠注射液腹腔注射。
局灶性大脑中动脉闭塞(MCAO)模型制作:模型组和治疗组大鼠参考文献[3]线栓法并加以改良,制作局灶性MCAO模型。假手术组栓线头插颈内动脉深度为8~10mm,未造成缺血。
神经功能评分:术后3~4 h大鼠基本苏醒,应用Longa评分标准评分[3],1~3分为制模成功。随之各组进行干预,分别在缺血再灌注后24 h、72 h、7 d、3周时对3组中各亚组12只模型大鼠再次进行评分。
蛋白免疫印迹法(WB)标本采集及检测:分别在缺血再灌注后24 h、72 h、7 d、3周4个时间点对3组大鼠神经功能评分,各组随机取6只大鼠,腹腔麻醉,断头取脑,于冰上剪取缺血灶周边相应位置脑组织,剪碎,置含蛋白酶抑制剂的RIPA裂解液中研磨匀浆,4℃下13 000 r/min离心5 min,取上清液,用BCA法检测蛋白浓度。各组取20 μg蛋白样品上样进行SDS-PAGE凝胶电泳,将电泳后的蛋白电转于PVDF膜上,封闭液封闭60 min,按适当比例将各个一抗与一抗稀释液稀释[NeuN抗体 1∶500~1∶5 000,GFAP抗体 1∶500~1∶5000,Anti-Laminin抗体(ab11575)1∶200~1∶1000,β-actin抗体 1∶1 000~1∶10 000],4℃孵育过夜,TBST洗膜后,将膜与HRP-山羊抗兔二抗(二抗用稀释液按照1∶5 000比例稀释)室温摇床孵育1.5 h,然后TBST洗涤,采用ECL化学发光法显影、定影,利用Image J软件分析条带的灰度值,计算目的蛋白(NeuN,GFAP,LN)与内参蛋白β-actin二者灰度值的比值。
电镜标本采集及检测:取3组剩余大鼠,腹腔麻醉,开胸,充分暴露心脏,从左心室向升主动脉插入灌注针,剪破右心耳,放静脉血,快速灌注100 mL生理盐水,大鼠肝脏变白,右心房流出液清亮时即可换预冷的4%多聚甲醛200 mL灌注,大鼠后肢绷直,尾巴竖起,表明固定成功。断头取脑,分别从右侧缺血灶周边脑组织相应部位各取组织块,切成约1 mm×1 mm×1 mm小块,放入2.5%戊二醛固定液,于4℃避光固定24 h。按常规电镜检测标本制备程序逐步进行,漂洗、脱水、浸透及环氧树脂包埋。超薄切片,片厚约50 nm,切片醋酸双氧铀和柠檬酸铅双染色,采用H-7650型透射电镜下观察脑组织超微结构变化并进行摄片。
1.3 统计学处理
采用SPSS13.0统计学软件处理。计量数据以表示;组间比较采用单因素方差分析,两两比较采用LSD法。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠神经功能评分
结果见表1。可见,干预前(即术后4 h)治疗组和模型组神经功能评分比较无明显差异(P>0.05);干预后治疗组大鼠神经功能评分逐渐改善,比同时间点模型组明显降低(P<0.05)。
表1 各组大鼠神经功能评分比较(± s,分,n=12)
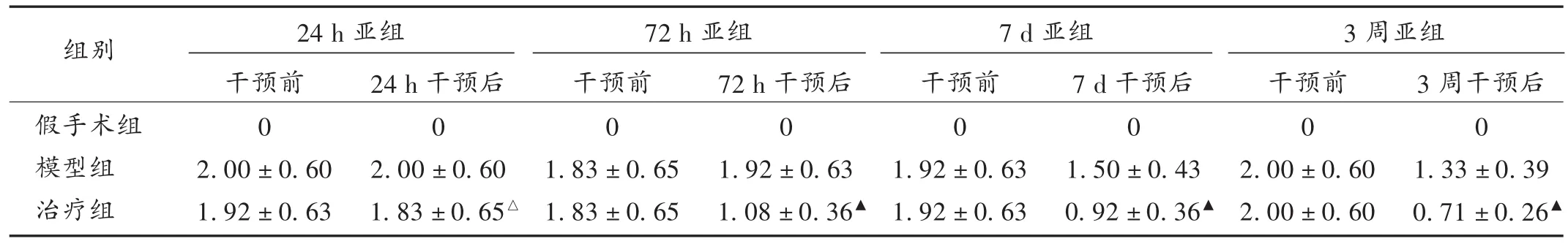
表1 各组大鼠神经功能评分比较(± s,分,n=12)
注:与模型组24 h亚组比较,△P>0.05;与同时间点模型组比较,▲P<0.05。
组别24 h亚组 72 h亚组 7 d亚组 3周亚组假手术组模型组治疗组干预前0 2.00±0.60 1.92±0.63 24 h干预后0 2.00±0.60 1.83±0.65△干预前0 1.83±0.65 1.83±0.65 72 h干预后0 1.92±0.63 1.08±0.36▲干预前0 1.92±0.63 1.92±0.63 7 d干预后0 1.50±0.43 0.92±0.36▲干预前0 2.00±0.60 2.00±0.60 3周干预后0 1.33±0.39 0.71±0.26▲
2.2 蛋白免疫印迹检测结果
NeuN蛋白:模型组各时间点NeuN蛋白表达均低于假手术组,其中24 h、7 d、3周表达相对于假手术组差异显著(P<0.05);相比模型组,治疗组NeuN的表达量逐渐升高,在IR 72 h后基本接近正常,7 d、3周表达差异显著(P<0.05)。详见图1 A及图2 A。
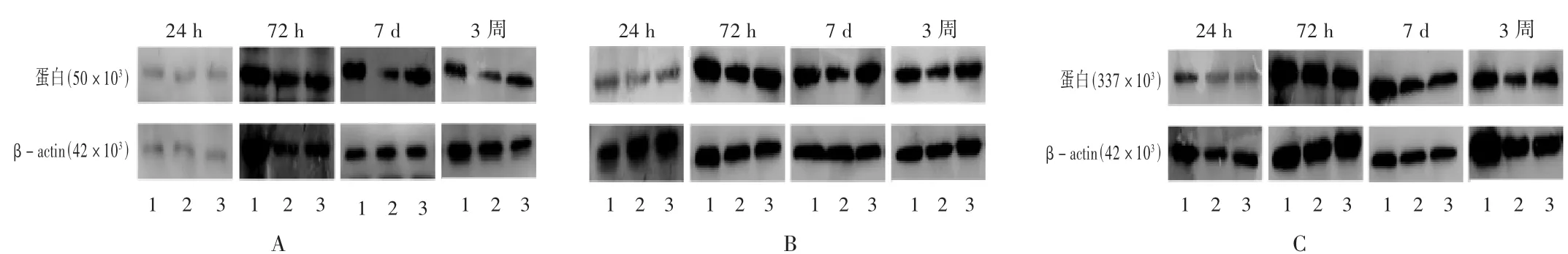
图1 不同时间点各组蛋白免疫印迹检测结果

图2 不同时间点各组大鼠脑组织灰度值比较(± s,n=6)
GFAP蛋白:GFAP蛋白相对表达量,模型组逐渐增加,各时间点表达均低于假手术组(P<0.05);与模型组相比,治疗组各时间点较模型组升高,其中72 h、7 d、3周表达差异显著(P<0.05),至 IR 7 d后,治疗组GFAP蛋白表达基本接近正常。详见图1 B及图2 B。
LN蛋白:模型组LN蛋白表达量逐渐增加,各时间点表达仍低于假手术组,24 h、72 h、7 d相比假手术组差异显著(P<0.05);治疗组各时间点LN蛋白表达量较模型组高,其中7 d、3周与模型组相比差异显著(P<0.05)。详见图1 C及图2 C。
2.3 大鼠脑缺血灶周边NVU超微结构变化
神经元:见图3 A。各时间点,假手术组神经元无变化,胞核大,圆形或椭圆形,核仁清晰可见,着色深,多位于中央,染色质均匀分布,核膜清晰完整;细胞膜结构完整;胞质内细胞器丰富,结构正常。随时间的延长,模型组神经元超微结构不同程度的破坏,胞核变形、伴有切迹甚至破裂皱缩,核仁边聚或消失,核膜有模糊或断裂,细胞器开始肿胀伴空泡状,有溶解空白区,甚至结构疏松减少。治疗组神经元胞核形态尚可、核膜完整不断裂、核仁大部分可见,细胞器结构状态好于模型组同时间点表现。
胶质细胞:各时间点,假手术组胶质细胞无改变,轮廓清晰,结构完整,胞核呈卵圆形,核膜正常,染色质分布均匀,染色略深,细胞器结构正常、清晰。随时间的延长,模型组胶质细胞超微结构有不同程度的破坏,胞核不同形状变形,染色质大部分边聚多见,核膜72 h开始模糊不清,细胞器可见空泡状或空白区、有溶解甚至结构破坏疏松。治疗组胶质细胞的细胞核形态优于模型组、核膜完整清晰,细胞器结构状态好于模型组同时间点表现。详见图3 B。
微血管:各时间点假手术组微血管无变化,周围无水肿,间隙致密无扩大,管壁光滑,管腔正常,内皮细胞结构正常,基底膜连续、薄厚均匀。模型组微血管内皮细胞逐渐出现变形甚至有空泡,管腔不同程度狭窄,血管周围不同程度溶解伴水肿、72 h较明显,可见空泡状或空白区。治疗组微血管内皮细胞变形不明显、管腔基本通畅、管周水肿较模型组减轻,细胞器结构状态好于模型组同时间点表现。详见图3 C。
3 讨论
目前,对脑损伤的研究焦点逐渐从单一的神经元转向神经元、神经胶质细胞和微血管等组成的复合体,即NVU。该概念于2002年由美国神经疾病与卒中研究所首次提出[4],强调NVU中三者间相互联系、相互作用的重要性。NVU各成分之间存在复杂的信号偶联和传递,任何一组分的破坏都会影响到NVU的整体功能[5]。局灶性脑缺血时,不仅是神经元受损害,提供神经元氧和能量的微血管及起支持功能的胶质细胞也同时受到损伤[2],对缺血性脑损伤的研究应把神经元、神经胶质细胞和微血管视为整体进行研究。脑缺血涉及多种不同类型细胞的功能障碍,单纯对神经细胞保护或单个靶点治疗难以达到充分的保护效果[6],因此神经保护治疗的目标应是同时对NVU中胶质细胞、微血管的整体保护。
三七总皂苷对脑缺血具有多靶点、多方位作用。ZHOU等[7]发现,PNS可通过抗氧化降低大鼠脑皮层星形胶质细胞死亡。徐士欣等[8]发现,PNS能对脑缺血再灌注损伤早期发挥神经保护效应,可能与显著抑制血脑屏障破坏相关的蛋白表达水平有关,为PNS干预脑缺血后对血脑屏障损伤起一定保护作用提供实验依据。PNS通过抑制细胞凋亡,对脑缺血治疗后能促进神经元形态恢复和数量增加[9]。PNS可通过干预脑缺血性损伤的多个级联病理反应,从而防护脑缺血性损伤。

图3 各组大鼠神经元血管单元电镜下超微结构
NeuN被认为是成熟神经元的特异性标志物,其蛋白表达逐渐上调,可反映神经细胞成熟程度[10]。SHARP等[11]选用沙鼠短暂性脑缺血模型来研究海马、齿状回部位新生成的细胞,通过BrdU标记新生成的分裂细胞,发现脑缺血后1个月有2/3的细胞表达出现成熟神经元的标志物NeuN,表明脑缺血后内源性的神经干细胞或前体细胞被增殖分化,从而进行修复神经元结构及功能重塑。本试验中经PNS干预后NeuN的表达量逐渐升高,同时电镜观察到神经元形态学较模型组损伤减轻,考虑是NeuN对神经元结构和功能起到修复、重塑作用的结果,表明PNS能保护神经元存活,可能与上调NeuN蛋白表达有关。
GFAP被认为是活化状态星形胶质细胞特有的标志物[12]。GOMES等[13]的研究表明,上调 GFAP表达水平可促进脑组织损伤的修复,提示GFAP可能有诱导星形胶质细胞对脑缺血损伤起修复作用。本研究结果显示,PNS可上调脑缺血后GFAP蛋白表达,电镜观察到胶质细胞的细胞核形态好于模型组,核膜完整清晰,说明GFAP可对缺血损伤发挥神经保护作用,与文献[13]报道大致相符,提示PNS可能与上调GFAP蛋白表达而发挥神经保护作用有关。
LN是检测血管基底膜完整性的敏感指标,具有调控细胞增殖、黏附,促进血管新生的作用[14]。本研究中治疗组LN的表达量较模型组逐渐升高,电镜观察到微血管管周水肿较模型组逐渐减轻,细胞器结构状态好于模型组同时间点表现,表明了LN增多能促进血管新生,对微血管起到修复作用,与施浩[14]的研究结果大致相似,提示PNS可能与上调LN表达起微血管修复作用。
脑缺血后可导致NVU损伤,主要表现在NVU结构完整性的改变。细胞超微结构变化是反映细胞损伤程度甚至死亡最直观的指标[15]。HAN等[16]在大鼠脑缺血再灌注模型研究中选择电镜技术能细微地观察到脑损伤后神经元、星形胶质细胞及微血管三者的超微结构变化。通过透射电子显微镜不仅同时观察到大鼠脑缺血后NVU的神经元、内皮细胞、血管基底膜及血管周边的胶质细胞超微结构的完整性破坏,发现周细胞损伤的同时伴随着线粒体嵴的肿胀破坏,血管损伤性水肿[17]。利用电镜技术对阿尔茨海默病的老年患者脑组织中神经元、胶质细胞及毛细血管观测,不仅能清晰观察到三者同时出现细微结构改变,也发现血管壁与邻近神经元和星形胶质细胞之间在功能和形态上有着相互作用[18]。因此,电镜不仅可同时观察NVU中三者的细微形态结构,还能观察NVU各组分间相互关联的病理形态学改变。提示电镜技术是目前观察和研究NVU超微结构最直接、最客观的方法。
本研究选用电镜同时观察脑缺血后NVU中神经元、神经胶质细胞和微血管的动态超微病理形态改变的研究,目前尚未见相关报道。电镜结果显示,与模型组相比,各PNS治疗组大鼠脑细胞神经元、胶质细胞和微血管的病理形态改变均有所改善,提示PNS能同时减轻脑缺血再灌注后NVU的病理形态改变,这与文献[19]报道结果大致符合;治疗组大鼠神经功能评分与模型组相比逐渐改善,神经功能缺失症状也逐渐减轻,有临床研究表明,神经功能的缺失是最直接的评价脑梗死后神经损伤轻重的指标[20],说明PNS干预后可改善脑缺血再灌注后大鼠神经功能缺损症状,减轻脑缺血后损伤。神经功能评分和病理形态学是评价药物抗脑缺血效应的指标[19],表明三七总皂苷可通过整合促进脑缺血后NVU神经元、胶质细胞和微血管的修复,改善神经功能缺损症状,对脑缺血具有保护作用。
