文蛤酶解产物的抗氧化活性评价及其组成分析
2019-07-04胡大伟李恒蒋敏丁海龙王松涛沈才洪许正宏史劲松
胡大伟,李恒*,蒋敏,丁海龙,王松涛,沈才洪,许正宏,史劲松*
1(江南大学 药学院,江苏 无锡,214122) 2(国家固态酿造工程技术研究中心,四川 泸州,646000) 3(江南大学 生物工程学院,江苏 无锡,214122) 4(粮食发酵工艺与技术国家工程实验室(江南大学),江苏 无锡,214122)
文蛤(MeretrixmeretrixL.)是我国沿海地区常见的经济贝类,其肉质鲜美,食用与药用历史悠久。《本草纲目》中记载了文蛤的“治疗疮、疖、肿毒,消积块,解酒毒”功效;《伤寒论》中也述及文蛤可治疗“饮水不止”的消渴之症[1-2]。近代研究进一步明确了文蛤具有抗肿瘤、抗氧化、降血糖、降血脂、免疫调节和抗疲劳等多种药理作用[3-7]。其中,抗氧化活性是其他各类生理功能的基础[8-10],可作为活性评价的基础依据。
蛤类等海洋生物是优良的活性蛋白、活性多肽的来源。采用生物酶酶解的方式可以促进活性物质的发现,从而实现海洋蛋白资源的高值化利用。文蛤中含有多种营养与活性成分,其中蛋白含量约占干物质总质量的50%以上[11-13]。蛋白的酶法水解是近年广泛应用的一项生物技术,动物组织中的蛋白质、蛋白复合物等大分子原料可被蛋白酶酶解成肽类等小分子物质,从而利于后续浓缩和活性物质提取。
本研究以文蛤软体为原料,通过筛选酶解用酶进而确定酶解工艺条件,在评价酶解物抗氧化活性的基础上,进一步对抗氧化活性的组成物质进行分析,探索具有抗氧化活性的文蛤小分子肽类物质的构成特征。
1 材料与方法
1.1 材料与试剂
文蛤软体:南通昌华水产食品有限公司,-20 ℃储存备用;酶解用蛋白酶:诺维信;抗坏血酸、水杨酸、DPPH、邻苯三酚等试剂:国药试剂集团;弱阴离子交换柱(DEAE FF)5 mL柱:GE公司;用于分子质量测定的HPLC标准品由尿嘧啶(112 Da)、核糖核酸酶A(13.7 kDa)及牛血清蛋白(66 kDa)组成:苏州赛分科技有限公司。
1.2 实验仪器
Eppendorf Centrifuge 5804R高速冷冻离心机,德国DASGIP公司;Triad 2.5 L冷冻干燥机,美国Labconco公司;Milli-Q超纯水仪,美国Millipore公司;UltiMate 3000高效液相色谱,美国Dionex公司。
1.3 实验方法
1.3.1 酶解工艺及蛋白酶筛选
考查不同种类蛋白酶对文蛤软体酶解的效率。测定水解度与水解得率考察水解情况,选择水解度高的蛋白酶研究复合酶解,确定最佳酶解工艺。
1.3.2 水解度与水解得率的测定
根据水解物中游离氮与总氮含量的比值计算酶解后的水解度。采用甲醛滴定法测定游离氮含量。取不同条件的酶解上清液5 mL于250 mL锥形瓶中,加入60 mL冷却的去CO2水,搅拌并且精密测定其pH值。用0.1 mol/L的NaOH溶液(用基准邻苯二甲酸氢钾标定过)调节pH值至8.2,再加入pH值已中和至7.0的甲醛溶液20 mL,随后记录将其pH值滴定至9.2时所消耗的0.1 mol/L NaOH溶液的体积。利用凯氏定氮法测定样品中总氮含量。水解得率反映酶解后可溶性物质的得率,计算如公式(1)所示:

(1)
1.3.3 抗氧化能力的测定
(1)总还原能力的测定
在不同梯度浓度的样品中加入铁氰化钾,50 ℃加热20 min后迅速冷却,加入三氯乙酸,3 500 r/min离心10 min,取适量上清加入FeCl3,混匀静置10 min,在700 nm处检测吸光值。
(2)水杨酸法测定羟自由基清除能力
采用固定反应时间法,在 510 nm处测量含被测物反应液的吸光度,并与空白液比较,以测定被测物对羟自由基的清除作用。在试管中加入一定浓度的待测液,依次加入FeSO4、水杨酸,蒸馏水补齐至10 mL,最后加入H2O2,静置10 min后于510 nm处测定吸光值。
(3)DPPH·清除率测定
准确称取7.0 mg的DPPH·,用无水乙醇定容至100 mL棕色容量瓶中于4 ℃避光保存。将制得的文蛤酶解物及各分离组分分别配制成不同浓度的溶液,分别取2 mL不同浓度的样品溶液,和等体积已配制好的DPPH·溶液混合摇匀,常温避光静置30 min后于517 nm下测定其吸光度Ai,取2 mL DPPH·溶液与等体积无水乙醇混合,测定混合液的吸光度Aj,以及样品溶液与等体积无水乙醇混合液的吸光度值Ac,每个样品平行测定3次,实验以Vc作为对照。DPPH·清除率按照公式(2)进行计算:
(2)
采用邻苯三酚自氧化法测定超氧阴离子自由基清除率。取一定量的Tris-HCl缓冲液置于25 ℃水浴5 min,分别加入不同量的样品溶液和邻苯三酚,混匀后25 ℃继续水浴5 min后加入HCl终止反应,于420 nm 处检测吸光值。
1.3.4 小分子酶解组分(enzymatic hydrolysate components with low molecular weight, LMEC)物质分析
总蛋白含量采用凯氏定氮法测定;灰分含量采用高温灼烧法测定;脂肪含量采用索氏提取法测定;总糖含量采用苯酚硫酸法测定;水解氨基酸及游离氨基酸均采用氨基酸自动分析仪进行测定。
1.3.5 LMEC的分子质量测定
采用聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)初步判断分子质量范围,同时采用高效液相色谱法(high-performance liquid chromatography, HPLC)精确测定。
受经济下行、房地产调控等多重因素影响,2018年的厨电市场结束了持续长达6年的高速增长态势,不得已放缓了前进的步伐。中怡康测算数据显示,2018年1-9月,厨电市场零售额同比仅微增0.4%,消毒柜、电烤箱、吸油烟机、燃气灶等品类均遭遇断崖式下跌,仅有洗碗机、水家电、热水器、微波炉实现了正向增长。其中,前三季度油烟机、燃气灶及消毒柜终端零售量同比分别下滑14.82%、13.48%、22.11%。
SDS-PAGE条件:配制18%的分离胶,5%浓缩胶,样品经浓缩胶分离时,电压为80 V,时间约为30 min;经分离胶分离时,电压为100 V,时间为100 min,电泳缓冲液为变性蛋白胶电泳缓冲液。电泳至蓝色指示前沿至分离胶3/4位置时停止电泳。
HPLC条件:将LMEC用流动相配成 1 g/L的溶液,经0.2 μm滤膜过滤后进行检测。使用已知特定分子质量的标准品分析并绘制标准曲线。色谱条件为:色谱柱Zenix SEC-80,7.8×300 mm;流动相为V(乙腈) ∶V(水)∶V(三氟乙酸)=40∶60∶0.05;检测波长214 nm;流速1 mL/min;柱温30 ℃;进样量10 μL。
1.3.6 LMEC的初步分离及肽序分析
采用DEAE-FF弱阴离子交换柱进行初步分离,以NaCl溶液作为洗脱液。线性洗脱采用1 mol/L NaCl溶液,梯度洗脱设定NaCl溶液浓度在100 min内由0增加至1 mol/L,之后在出峰浓度下进行梯度洗脱,每次洗脱直到样品基线平稳至少5个柱体积再切换至下一浓度梯度。
对分离得到的组分进行液相色谱与质谱联用分析(liquid chromatography and mass spectrometry, LC-MS)。液相色谱条件:色谱仪Waters Acquity UPLC;检测器Waters Acquity PDA;检测波长200~400 nm;流动相为甲酸、乙腈溶液;柱温45 ℃;流速0.3 mL/min; 进样量5 μL。质谱条件:离子方式ESI+;毛细管电压3.5 kV; 锥孔电压30 V;离子源温度100 ℃;脱溶剂气温度400 ℃;质量范围20~2 000m/z。检测数据使用MassLynx进行氨基酸序列的推测分析。
1.4 统计学分析
采用SPSS 19.0对实验数据进行处理分析,数据结果用平均值±标准差表示,采用Origin 8.5进行作图。
2 结果与分析
2.1 蛋白酶的选择
以水解度及水解得率为判定指标进行水解用蛋白酶种类的选择。由表1结果比较可知,风味蛋白酶对文蛤软体的水解度最高,为28.08%,其次为复合蛋白酶和酸性蛋白酶;中性蛋白酶酶解后可溶性组分的水解得率最高,为71.67%。基于以上结果,以风味蛋白酶分别与复合蛋白酶及中性蛋白酶复配进一步优化酶解效果。风味蛋白酶与中性蛋白酶双酶酶解后,水解度与水解得率分别为33.39%和76.27%,由此确定酶解用酶及条件。
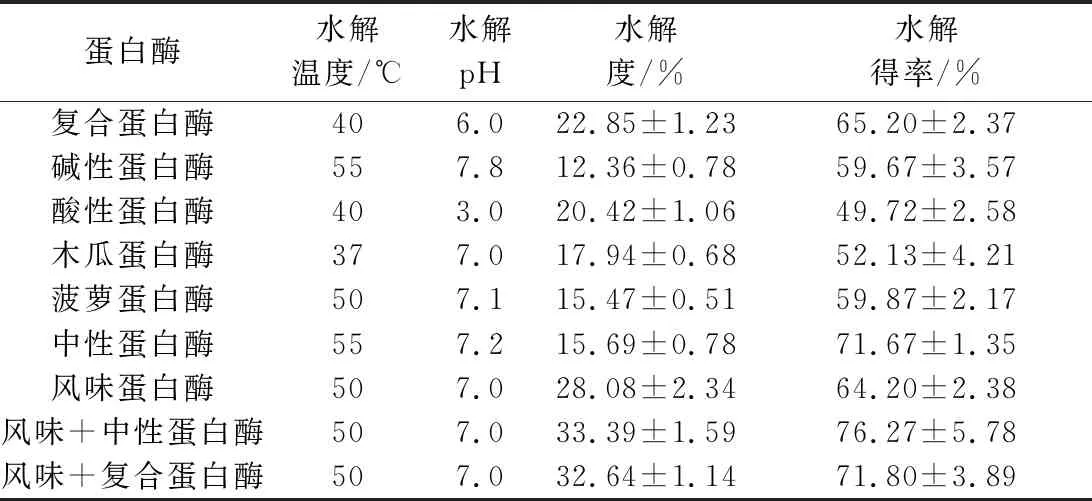
表1 不同蛋白酶水解得率及水解度Table 1 Hydrolytic yield and hydrolytic degree of different protease
2.2 酶解工艺及得率
通过试验确定的最佳酶解工艺如图1所示,将冷冻文蛤肉置于室温下解冻1 h,煮沸10 min后按照1∶3(mg∶mL)的料液比加入去离子水匀浆。
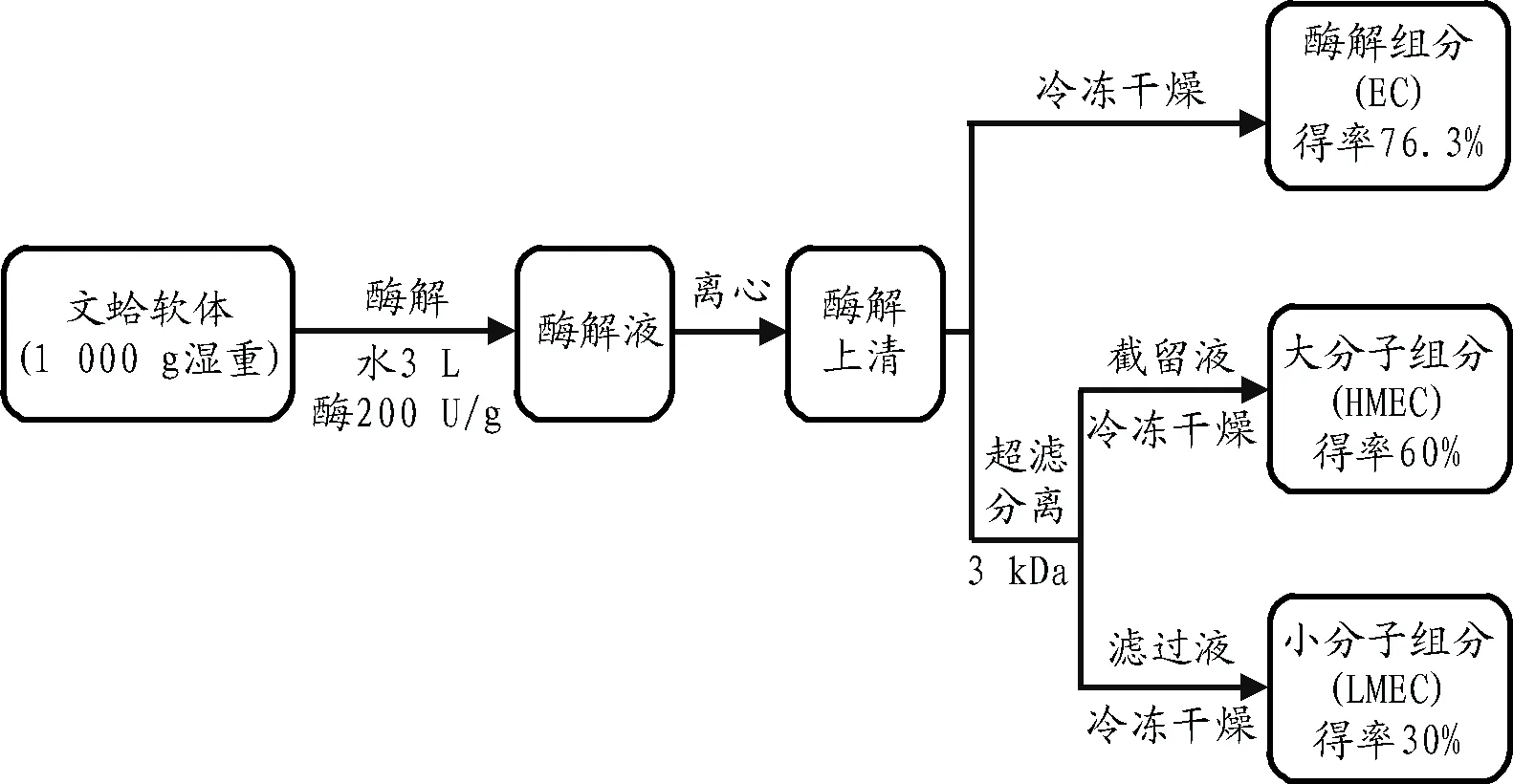
图1 文蛤软体酶解工艺流程图Fig.1 Flow chart of enzymatic hydrolysis of Meretrix Meretrix L.
匀浆后加入风味蛋白酶与中性蛋白酶各100 U/g湿重,在其最适酶解条件下酶解4 h。水解结束后于100 ℃ 灭活10 min,冷却后4 ℃过夜,8 000 r/min离心去除沉淀,水解得率为76.3%,上清液经3 kDa超滤分离得大分子组分(enzymatic hydrolysate components with high molecular weight, HMEC)、小分子组分(LMEC),得率分别为60%和30%。
2.3 酶解物体外抗氧化活性评价
总还原能力能客观地反应物质的整体抗氧化活性[14]。其测定原理是铁氰化钾在抗氧化剂的作用下Fe3+还原成Fe2+,Fe2+进一步和Fe3+反应生成的普鲁士蓝在波长700 nm处有吸收。吸收值越大,表示样品的还原力越大。实验结果由图2所示,随着各组分浓度的增大,其总还原能力也逐渐增大,当质量浓度高于20 g/L后,总还原力上升趋势趋于平缓。酶解物(enzymatic hydrolysate components, EC)及小分子质量组分(LMEC)的抗氧化活性差异不大,且略高于大分子组分(HMEC)。在质量浓度为25 g/L时,LMEC的总还原能力为54.16%。
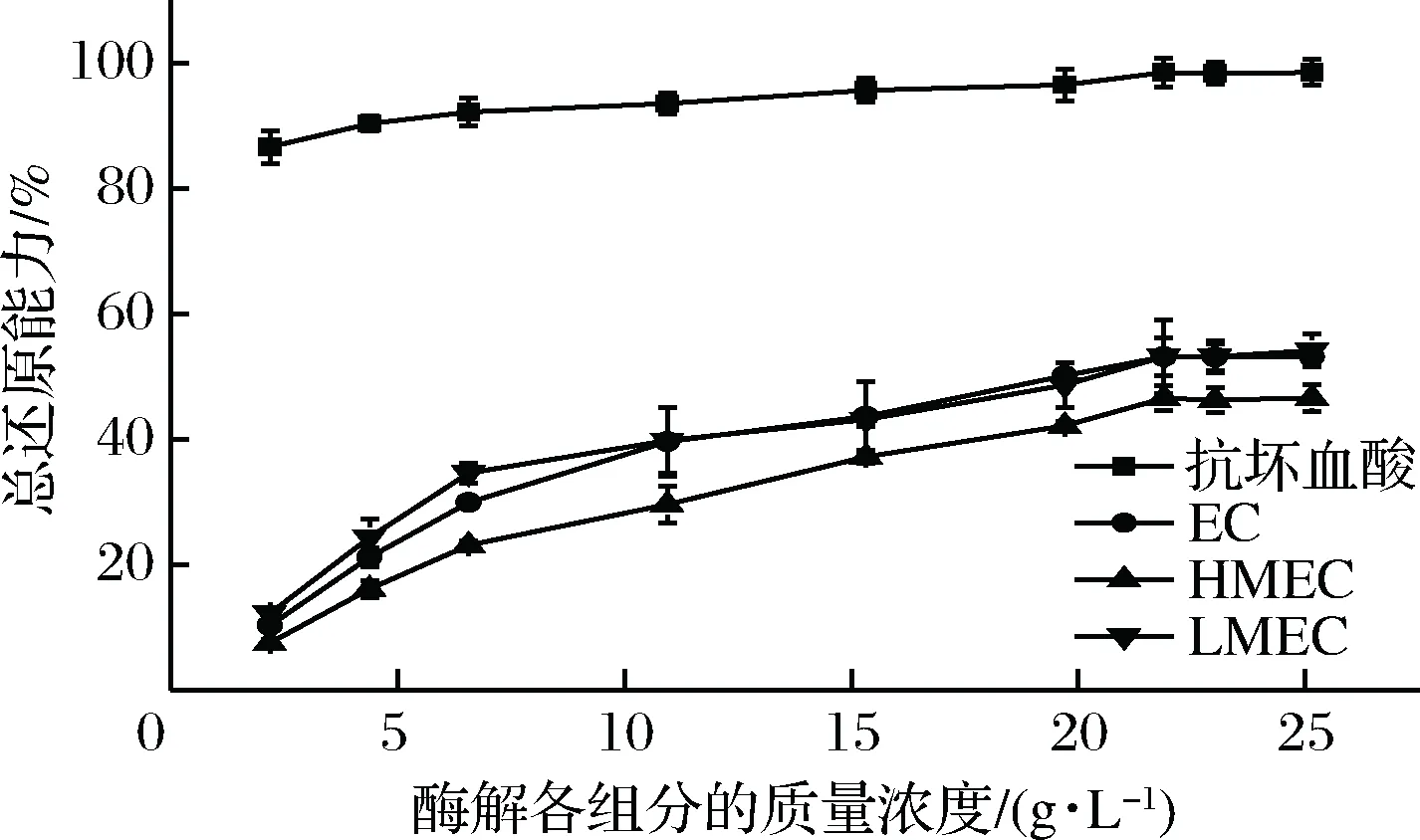
图2 酶解各组分的总还原能力Fig.2 Total reducing capacity of hydrolysate fractions
羟自由基是造成组织脂质过氧化、蛋白质解聚等的主要活性氧种类[15]。测定过程中,双氧水在Fe2+的作用下生成羟自由基及Fe3+,向体系中加入水杨酸与羟自由基反应,生成在510 nm处有特殊吸收的 2,3-二羟基苯甲酸。如果向反应体系中加入具有清除羟自由基功能的物质,有色化合物的生成量就会相应减少。羟自由基清除率是反映物质抗氧化作用的重要指标。结果由图3所示。
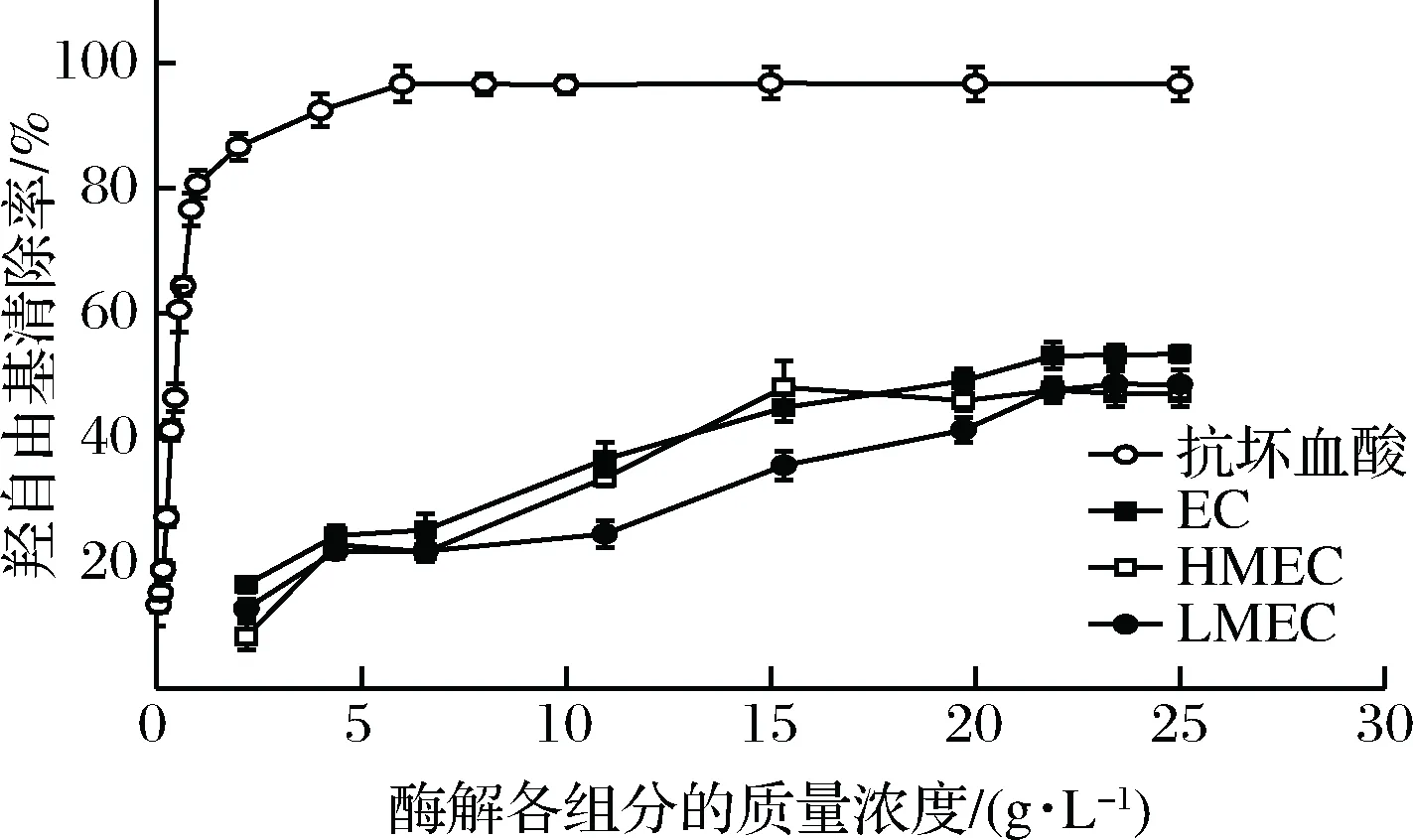
图3 酶解各组分的羟自由基清除活性Fig.3 Scavenging activity of hydroxyl radical in various hydrolysate fractions
文蛤酶解各组分对羟自由基均具有一定的清除能力,酶解物整体组分略高于分离组分。随着各组分质量浓度的增大,羟自由基的清除率也缓慢升高,组分EC在23 g/L时羟基自由基清除率可达到53.5%。
DPPH·是一种较为稳定的自由基。由图4所示,文蛤酶解物各组分对DPPH·均具有一定的清除能力。组分EC与LMEC的DPPH·清除能力显著高于HMEC,随质量浓度的升高,对DPPH·的清除率也逐渐增大,在15~20 g/L达到饱和,清除率最高约49%。
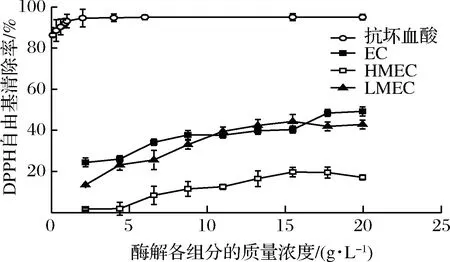
图4 酶解各组分的DPPH自由基清除活性Fig.4 Scavenging activity of DPPH radical in various hydrolysate fractions
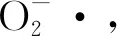
图5 酶解各组分的超氧阴离子自由基清除活性Fig.5 Scavenging activity of superoxide anion radical in various hydrolysate fractions
文蛤软体酶解物(EC)及其超滤分离的组分(LMEC、HMEC)均具有一定的抗氧化活性,其中,小分子组分的总还原能力与DPPH清除能力高于大分子组分。为进一步探讨LMEC产生抗氧化活性的原因,从组分的构成角度首先进行研究,分析LMEC的物质基础。
2.4 酶解产物LMEC的组分构成
各酶解组分的基本组成见表2。
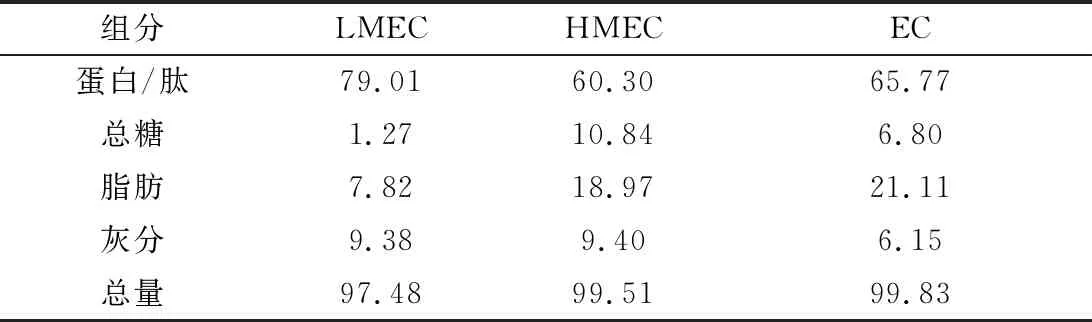
表2 酶解产物的组成 单位:%(质量分数)
由表2可看出,各组分中含量最高的物质均为蛋白或肽类,所含质量分数均达到60%以上。超滤处理进一步提高了LMEC的蛋白含量至79.01%,同时使得大部分脂肪与糖类物质富集于HMEC组分中。文献报道,小分子肽类具有良好的抗氧化活性,且更易被吸收[17]。NAZEER等[18]用木瓜蛋白酶酶解紫文蛤(Meretrixcasta)的产物具有很高的抗氧化活性,经FPLC离子交换层析和凝胶过滤层析,分离得到具有抗氧化活性的肽类物质。张泽等[19]以水解度作为评价指标,考察了中性蛋白酶和胰蛋白酶双酶水解长牡蛎的最佳工艺,并证明了酶解产物有一定的还原能力和对DPPH自由基有较强的清除能力。由此推测,LMEC的抗氧化活性与其含有大量的肽类物质有直接关系。
2.5 LMEC中肽类组分分子质量测定
首先采用SDS-PAGE重点对LMEC中的肽类组分进行分析。由图6可直观看到,文蛤软体经双酶酶解后(EC),产生一系列大小不一的酶解产物,条带分子质量主要集中于16 kDa以下。通过超滤分离后,LMEC的分子质量集中于1.2 kDa以下,仅由少量12~20 kDa组分残留,说明超滤可较高效地将小分子肽类组分富集。
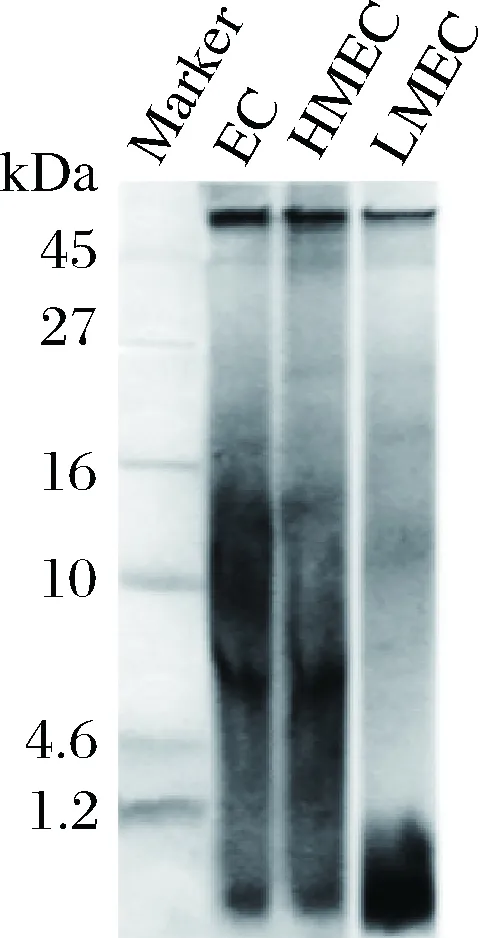
图6 酶解产物SDS-PAGE检测Fig.6 Detection of enzymatic hydrolysate fractions by SDS-PAGE
进一步地,采用HPLC方法更精确地分析,结果如图7-b所示。因组分较为复杂,LMEC的HPLC图谱中在6.0~12.0 min形成较大的宽峰,12.0~16.0 min还有3个吸收峰。为判定其分子质量,我们在同样的液相条件下进行标准品的检测,结果如图7-a所示。
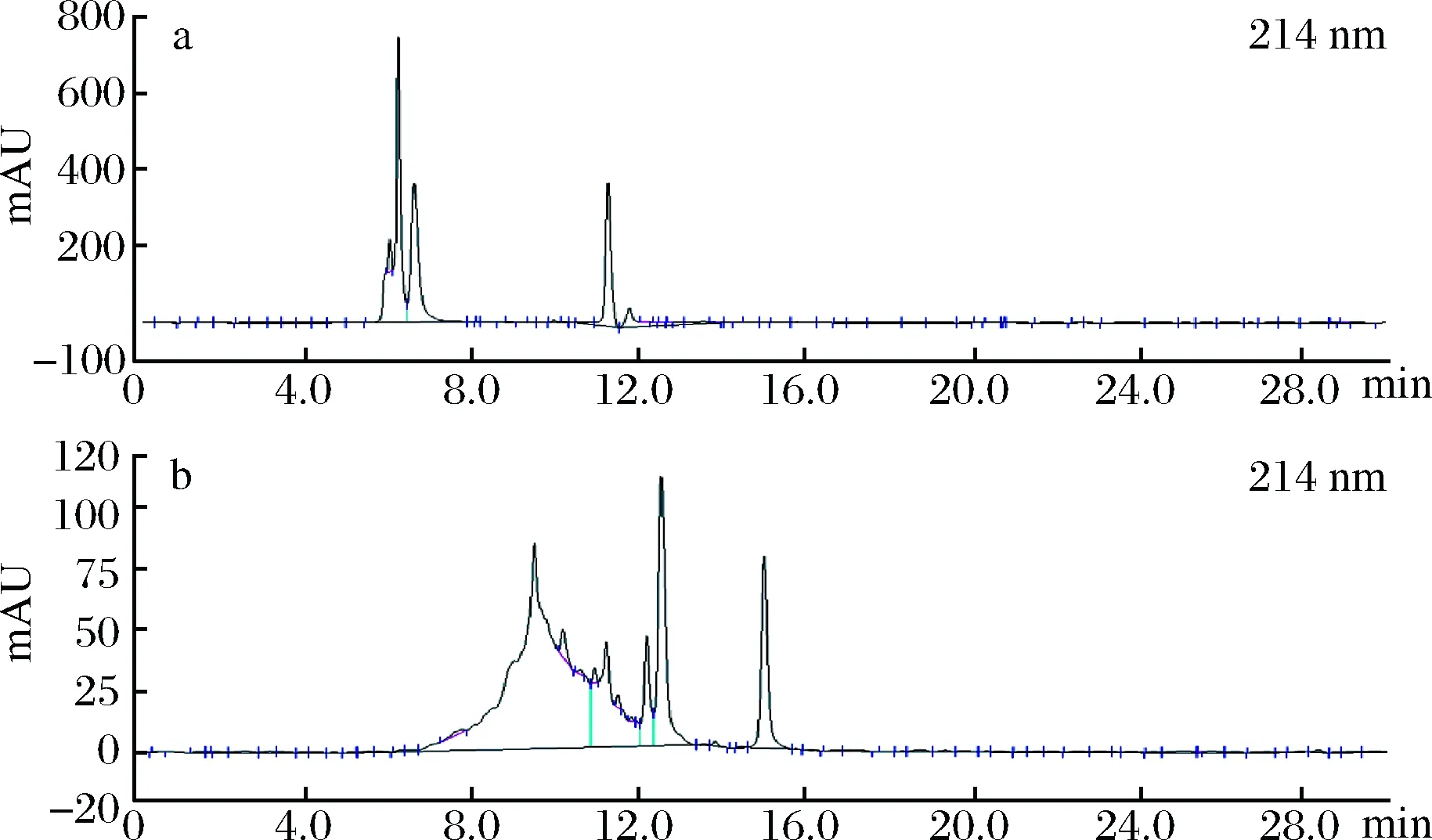
a-标准品;b-LMEC图7 LMEC及标准品的HPLC色谱图Fig.7 HPLC chromatogram of LMEC and standard products
通过曲线拟合得到分子质量与保留时间的线性计算式lgM=-0.544 7t+8.24,并以此计算得到LMEC的分子质量为1.05 kDa,与SDS-PAGE的结果相吻合。
2.6 LMEC氨基酸组成分析
蛋白质中氨基酸组成与其生理功能具有密切关联[20]。LMEC的氨基酸组成如表3所示。LMEC含有较高含量的游离氨基酸,其中以三支链氨基酸(Leu、Val和Ile)和His含量较高。分析水解氨基酸组成可以看出,LMEC中肽类组分中主要含有Glu、Asp、三支链氨基酸及Arg等氨基酸单元。文献报道,Arg及三支链氨基酸(branched chain amino acid, BCAA)是长时间持续运动时参与供能的重要氨基酸[21]。由于肌肉中支链氨基酸分解非常活跃,BCAA能以相当快的速率转氨基和完全氧化,其氧化产生ATP的效率高于其他氨基酸,进而可能影响机体的氧化指标(如丙二醛、超氧化物歧化酶及乳酸脱氢酶等)[22-23]。
2.7 LMEC的初步分离与肽段组成分析
在测定LMEC氨基酸组成的基础上,进一步了解LMEC可能含有的肽类构成。为简化后续分析过程,首先对LMEC进行初级分离。采用DEAE对LMEC进行线性与梯度洗脱分离,结果如图8所示。
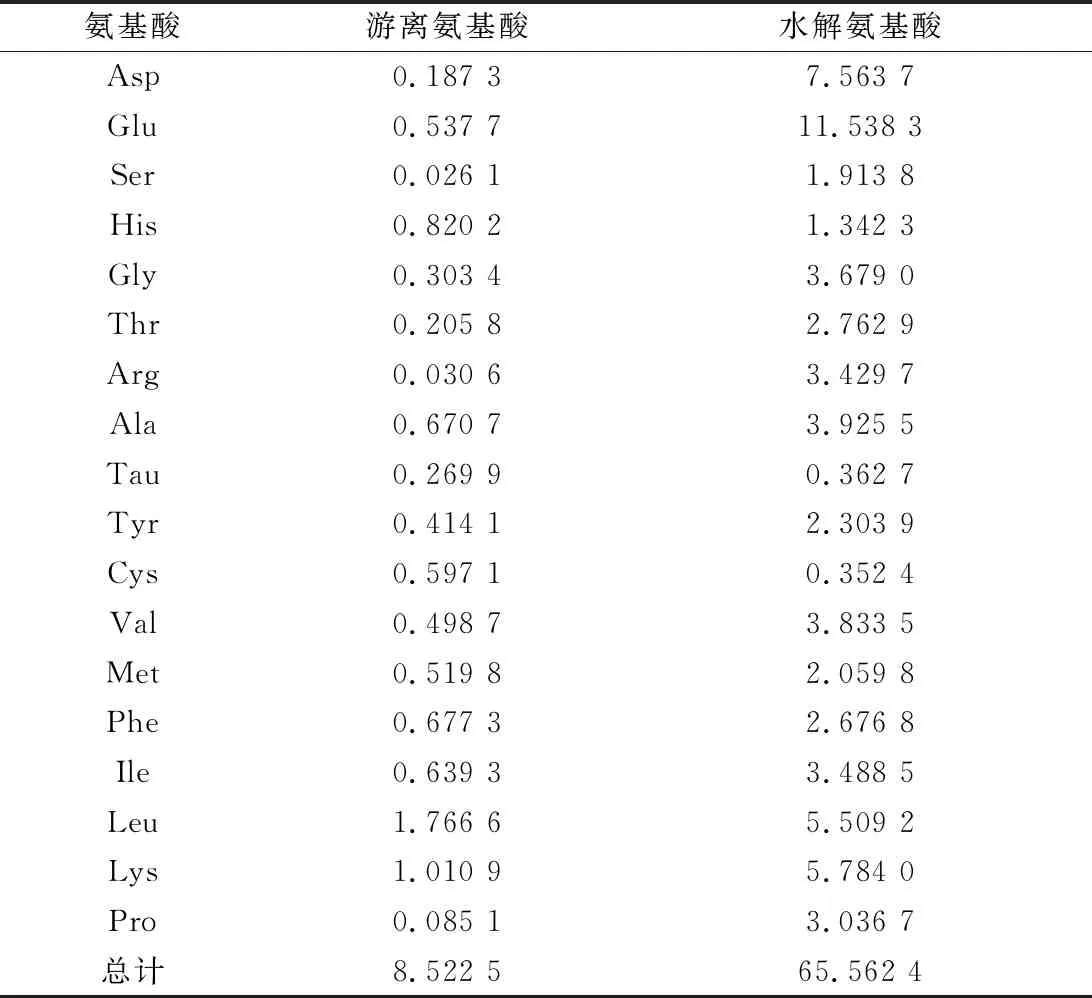
表3 LMEC的氨基酸组成 单位:%(质量分数)
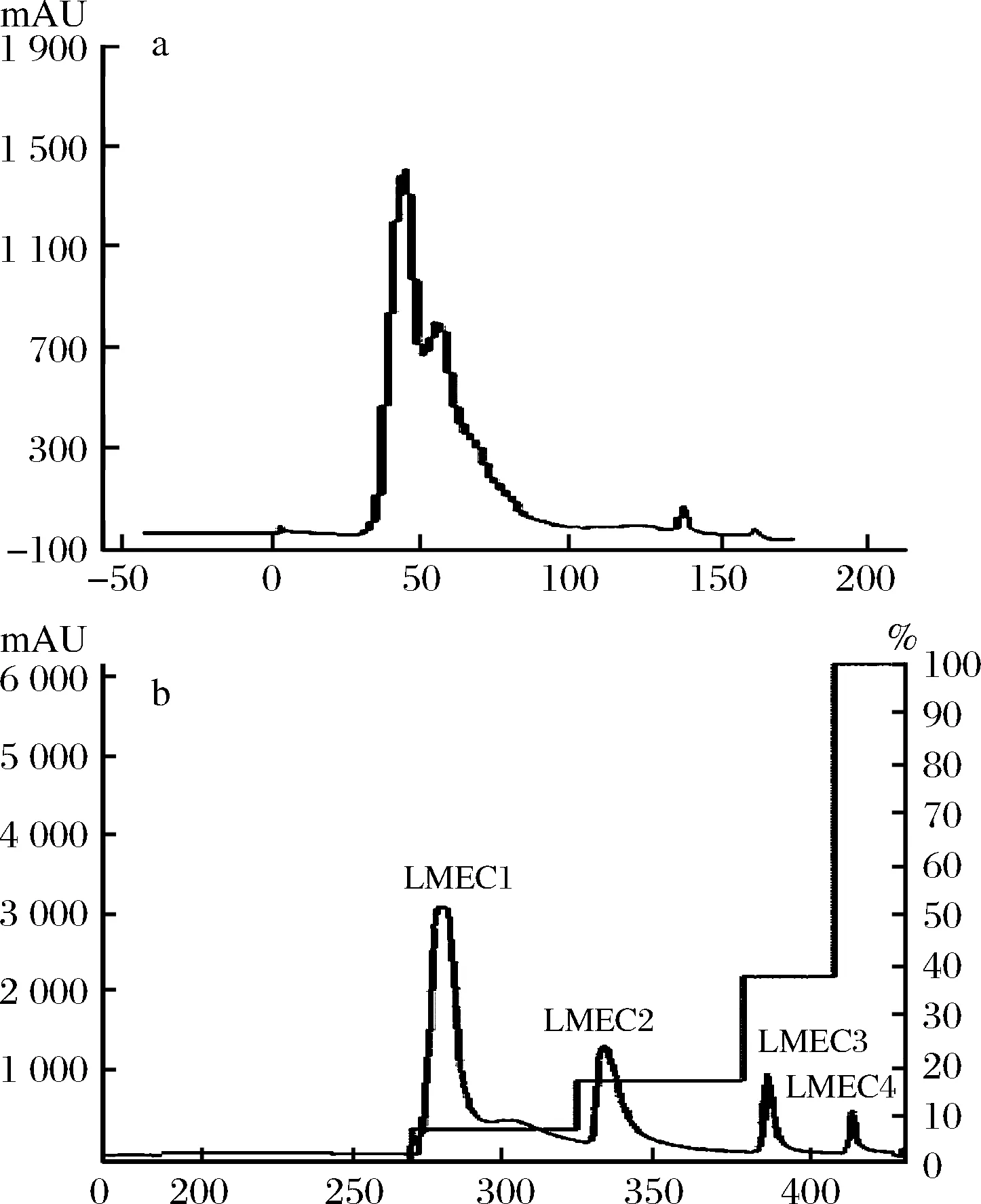
a-线性洗脱;b-梯度洗脱图8 DEAE线性及梯度洗脱曲线Fig.8 DEAE linear and gradient elution curves in DEAE
通过线性洗脱(图8-a),确定了样品中成分在0、0.064、 0.163,0.37、1 mol/L NaCl浓度下可被洗脱,以此进行NaCl梯度洗脱,如图8-b得到4个组分,按照洗脱顺序依次标记为LMEC1~LMEC4。
分别对获得的4个洗脱组分进行UPLC-MS联用分析。分析4个组分的液相图可知,LMEC1成分较为复杂,LMEC2、LMEC3及LMEC4谱图类似。对4个组分中液相分析得到物质进一步进行质谱分析(图9),并基于质谱系统的多肽分析方法进行序列鉴定,得到其所含多肽的序列汇总如表4。
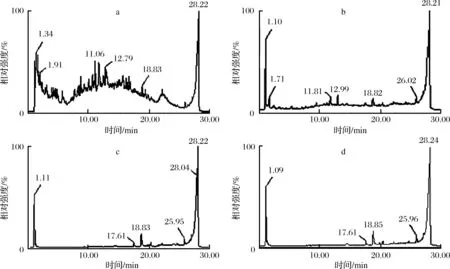
a-LMEC1;b-LMEC2;c-LMEC3;d-LMEC4图9 LMEC的液相图谱Fig.9 Liquid chromatogram of LMEC

表4 LMEC可能含有的多肽序列Table 4 Polypeptide sequences speculated in LMEC
分析发现,推测得到的多肽序列中多含有Ala、Thr、Val、Leu、Pro、Glu等,与LMEC的氨基酸组成分析结果相吻合。文献报道抗氧化肽通常在N端含有疏水性氨基酸,如Val或Leu,且序列中多含有Pro、His、Tyr、Trp和Cys等氨基酸[24]。吴艳艳等[25]从珍珠贝的蛋白酶酶解产物中分离出相对分子质量为1 039.56 Da的1种抗氧化肽,具有清除自由基的活性,其氨基酸序列为Gly-Ala-Gly-Leu-Pro-Gly-Lys-Arg-Glu-Arg。JIN等[26]通过酶解舟贝分离出Met-Cys-Leu-Asp-Ser-Cys-Leu-Leu(P1)和His-Pro-Leu-Asp-Ser-Leu-Cys-Leu(P2)2种抗氧化肽,均具有DPPH·及ABTS+清除活性。王雪琴等[27]也从鲭鱼蛋白酶解产物中分离得到Leu-Asp-Ile-Gln-Lys-Glu-Val(843.5 Da)和Thr-Ala-Ala-Ile-Val-Asn-Thr-Ala(759.4 Da)2个具有抗氧化活性的肽序。对比发现,实验分析得到的肽段序列符合文献中对于抗氧化肽的特征描述,因而与其具有的抗氧化活性存在一定的关联。但其确定的抗氧化活性尚需进一步实验证实,因而对LMEC的精细分离及活性验证工作还有待进一步开展(图10)。
3 结论
以水解度及水解得率为优化依据,考察并筛选了文蛤软体酶解用蛋白酶种类,确定了双酶酶解的最佳条件为风味蛋白酶与中性蛋白酶各100 U/g,50 ℃水解4 h,优化后的水解度是33.39%,水解得率是76.3%。 酶解产物经超滤分离得到LMEC及HMEC组分,通过体外抗氧化活性检测发现LMEC具有较好的抗氧化活性。进一步对LMEC进行物质基础分析发现,LMEC含有约79%的肽类物质,分子质量约1.05 kDa。通过离子交换初步分离并采用UPLC-MS联用,分析并推测了LMEC中可能含有的6种肽序,富含Ala、Thr、Val、Leu、Pro、Glu等氨基酸单元,符合文献报道的抗氧化肽序列特征。通过研究,从物质层面对文蛤酶解物中产生抗氧化活性的肽类物质进行了初步定性分析,为文蛤抗氧化活性提供理论依据,也为后续活性肽的分离提供参考方向。
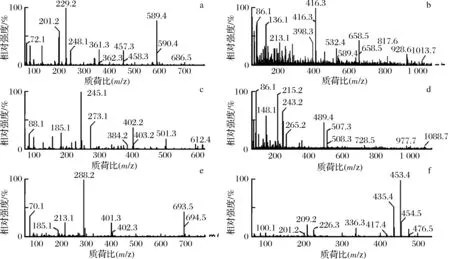
a~f-保留时间分别为11.05、11.71、11.80、13.04、16.69、18.84 min图10 LMEC中可解析的肽类物质质谱图Fig.10 Mass spectra of LMEC
