紫菜发酵提取物的体外降血脂功能分析
2019-07-04邓茜莹李缓缓曾荣急李桂玲刘静雯李健
邓茜莹,李缓缓,曾荣急,李桂玲,2,刘静雯,李健,2*
1(集美大学 食品与生物工程学院,福建 厦门,361021)2(福建省海洋功能食品工程技术研究中心,福建 厦门,361021)
紫菜是一种深受人们喜爱的食品,营养丰富,其蛋白质的含量远高于一般的蔬菜和其他食用海藻,且含有大量的牛磺酸[1-2]。但是由于紫菜细胞壁的构成,采用传统的加工方式无法使得紫菜中丰富的营养成分充分溶出而被人体消化吸收。为了更好地利用紫菜这种富含优质蛋白质的藻类,可以采用发酵的方式进行破壁处理,现代研究表明,食品被发酵的本质是由于微生物分解代谢食物中的营养物质得到新的次生代谢物质和转化物质赋予发酵食品独特的风味和营养[3-7]。例如生活中常见发酵制品酱油、腐乳等,经过微生物发酵之后,不仅品质风味发生了明显的改变,最重要的是豆制品的成分也发生了不同程度的变化。
据报道,采用微生物发酵可以提高海藻中可溶性成分的利用率[8]。酿酒酵母菌、枯草芽孢杆菌和乳酸菌对豆粕进行发酵后使得豆粕本身的蛋白质被分解,从而获得低分子质量的优质蛋白饲料[9]。近年来诸多研究发现紫菜多糖具有降血脂、抗氧化[10-11]的作用,如紫菜多糖能降低高血脂症大鼠体内总甘油三酯和胆固醇含量,从而有效预防大鼠的高胆固醇血脂症形成[12];利用蛋白酶对紫菜进行酶解,可以制备具有抗氧化活性的多肽[13]。然而通过微生物发酵紫菜后的体外降血脂功效的研究还鲜有报道。
本研究采用酿酒酵母菌(Saccharomycescerevisiae)和枯草芽孢杆菌(Bacillussubtilis)以固态、液态两种发酵方式发酵紫菜,并对发酵产物采用加水、乙醇分别浸提以得到粗提物。利用非酒精性脂肪肝(non-alcoholic fatty liverdisease,NAFLD)细胞模型对紫菜发酵提取物的体外降血脂活性进行研究,为紫菜发酵提取物的进一步开发利用提供理论依据。
1 材料与方法
1.1 材料
酵母菌(Saccharomycescerevisiae)、枯草芽孢杆菌(Bacillussubtilis),来自集美大学保藏菌种;坛紫菜,购于集美新华都超市;LO2人肝细胞株,集美大学食品与生物工程学院。
1.2 主要试剂
软脂酸(分析纯),阿拉丁公司;油酸、油红O(分析纯),西亚试剂有限公司;噻唑蓝(MTT,98%标准品),美国Sigma公司;检测蛋白质含量试剂盒,碧云天;检测甘油三酯(total triglyceride, TG)、总胆固醇(total cholesterol, TCH)试剂盒,南京建成。
1.3 主要仪器与设备
DFY-600摇摆式高速万能粉碎机,青州市精诚机械有限公司;5810R高速冷冻离心机,德国艾本德股份有限公司;SynergyH1酶标仪,美国伯腾仪器有限公司;MM-2微型振板器,上海精密仪器有限公司;240I CO2恒温细胞培养箱,赛默飞世尔科技有限公司;XDS-2倒置显微镜,广州粤显光学仪器有限责任公司。
1.4 紫菜发酵提取物的制备
参照文献[14-15]做出适当改进。选取坛紫菜于50 ℃恒温干燥箱中干燥3 h,粉粹干燥机粉碎后,80目过筛。称取紫菜粉末,按照料糖比5∶3(g∶g)加入蔗糖,料液比1∶0.5和1∶0.9(g∶g)加入蒸馏水,分别为固态、液态发酵。搅拌均匀后放入高压蒸汽锅中灭菌20 min,取出冷却后紫外灭菌30 min。酵母组发酵条件为:温度28 ℃,发酵时间72 h,接种量1%。枯草芽孢杆菌组除发酵温度为37 ℃外,其余的条件均与酵母组相同。每个菌种固态、液态发酵样品各2份,分别用于加水、乙醇进行提取粗提物。
发酵结束后,向各菌种的2份固态发酵产物中分别加入100 mL蒸馏水和乙醇,充分混匀后,浸提1 d,4 ℃,10 000 r/min离心20 min。收集上清液经旋转蒸发后,将加水浸提所得粗提物以蒸馏水定量为100 g/L 样品液,即为水提物;将加乙醇浸提所得粗提物以含体积分数10%的DMSO的超纯水定量为100 g/L 样品液,即为醇提物。将各菌种的2份液态发酵产物经旋转蒸发蒸干后,向残留固体中分别加入100 mL蒸馏水和乙醇,其余处理同上。
空白组以紫菜干粉加入1∶20(g∶mL)蒸馏水,于磁力搅拌器室温浸提1 d,10 000 r/min离心20 min,浸提2次,收集上清后真空冷冻干燥得到干粉,以蒸馏水配制成100 g/L的母液。
1.5 紫菜发酵后营养组分含量测定
1.5.1 紫菜发酵后蛋白质含量测定
采用碧云天蛋白质测定试剂盒测定0~4号紫菜发酵水提物中蛋白质含量,凯氏定氮法测定紫菜中蛋白质的含量。蛋白提取率为发酵水提物中蛋白含量(g)与紫菜中总蛋白含量(g)的百分比。
1.5.2 紫菜发酵后还原糖含量测定
采用3,5-二硝基水杨酸法测定还原糖[16],用葡萄糖配制成质量浓度0.2、0.4、0.6、0.8、1.0 g/L的标准液,用蒸馏水做空白。取2 mL的标准液,加1.5 mL的DNS溶液,摇匀后在沸水浴中加热5 min。冷却后以蒸馏水定容至25 mL。混匀后,取微量反应液用酶标仪在540 nm处测定,制定标准曲线。样品测定时,取样品2 mL如上述操作测定,以标准曲线计算样品中的还原糖量。还原糖提取率为发酵水提物中还原糖含量(g)与紫菜中还原糖含量(g)的百分比。
1.6 紫菜发酵提取物的体外降血脂功能活性研究
1.6.1 细胞培养及分组
参考文献[17-22]有所改动。LO2细胞培养于含有体积分数为10%的胎牛血清和体积分数为1%的抗生素的DMEM(高葡萄糖)培养液中,于体积分数为5%CO2、37 ℃ 培养箱中培养。实验分为对照组、模型组、不同浓度的8种紫菜发酵提取物和紫菜浸提物干预组、阳性对照组。其中对照组以DMEM(高葡萄糖)培养基培养;模型组以含终浓度为0.6 mol/L 游离脂肪酸(free fatty acids, FFA,V(油酸)∶V(软脂酸)=2∶1) 培养液处理;样品干预组以5和1 g/L的9种培养液处理;阳性对照组以1 g/L洛伐他汀培养液处理。
1.6.2 细胞活力测定
将对数生长期的细胞接种于96孔板,调整细胞密度为1×104个/孔,待细胞贴壁后吸出培养液,各干预组分别加入各浓度紫菜发酵提取物和紫菜浸提物培养72 h后,同模型组一起分别加入0.6 mol/L FFA继续培养24 h后,将细胞培养液弃去,收获细胞后采用MTT法测定细胞活力。根据公式(1)计算细胞活力:
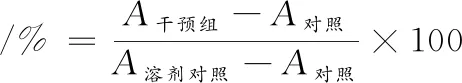
(1)
1.6.3 细胞内脂质堆积半定量测定
将对数生长期的细胞接种于96孔板,调整细胞密度为1×104/孔,其余处理同1.6.2,收获细胞后,PBS清洗,用体积分数为10%的中性甲醛溶液固定30 min后,再以PBS清洗,油红避光染色40 min。染色完成后,以体积分数为60%的异丙醇溶液快速清洗,加PBS二次清洗,于显微镜40倍下观察细胞形态[23]。
观察过后,加入体积分数为60%的异丙醇溶液,室温静置40 min,振板10 min,在528 nm处检测吸光值,根据公式(2)计算脂变率:

(2)
1.6.4 细胞内TG、TC含量测定
将对数生长期的细胞接种于6孔板,其余处理同1.6.2,收获细胞后,PBS清洗、离心后加入200 μL PBS重悬,于液氮中反复冻融破碎细胞,离心取上清,按照试剂盒说明书操作测定TG、TC含量。
1.7 数据处理
数据统计分析采用SPSS statistics 17.0软件程序进行,采用单因素方差分析和Duncan检验进行统计学检验(置信水平P= 0.05)。
2 结果与分析
2.1 紫菜发酵水提物中可溶性蛋白质得率
通过测定紫菜发酵水提物上清液中蛋白质的含量,可知紫菜经酵母菌和枯草芽孢杆菌发酵后的水提物中水溶性蛋白质含量有所增高,见图1。
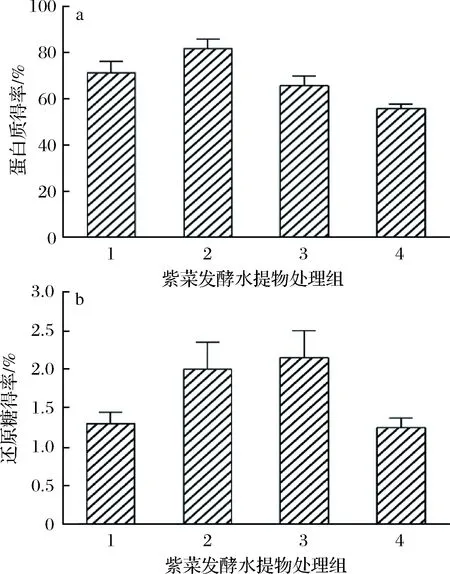
a-蛋白质;b-还原糖图1 发酵上清液中蛋白质、还原糖得率Fig.1 Protein and reducing sugar yield of fermentation supernatant
可溶性蛋白质含量增加可能是发酵菌体分泌的多种酶裂解紫菜细胞壁使得其中含有的营养成分充分释放,菌体分泌的蛋白酶水解蛋白质大分子为短肽。因研究目的在于通过微生物发酵破壁的方式获得具有生物活性的短肽,因此只选定发酵液中的可溶性蛋白质含量进行测定。不同发酵形态的发酵产物之间蛋白质含量无显著差异,不同菌种发酵产物中的蛋白质含量也无显著差异(P< 0.05)。
2.2 紫菜发酵水提物中还原糖得率
通过DNS法测定紫菜发酵水提物上清液中还原糖的含量,其含量的变化间接反映两种微生物的生长状态。由图1可知发酵后还原糖含量极显著下降(P< 0.01),这是由于还原糖在发酵过程中被微生物生长代谢所利用,因而含量明显下降。其中2(酵母菌液态发酵紫菜水提物)和3(枯草芽孢杆菌固态发酵紫菜水提物)中的还原糖含量高于1(酵母菌固态发酵紫菜水提物)和4(枯草芽孢杆菌液态发酵紫菜水提物),说明酵母菌在液态发酵时对糖的利用率高于固态发酵,枯草芽孢杆菌在固态发酵时对糖的利用率高于液态发酵。
2.3 紫菜发酵提取物在NAFLD细胞模型中的应用
2.3.1 发酵提取物对细胞活力的影响
采用MTT法评估紫菜发酵提取物作用下的细胞毒性,见图2。
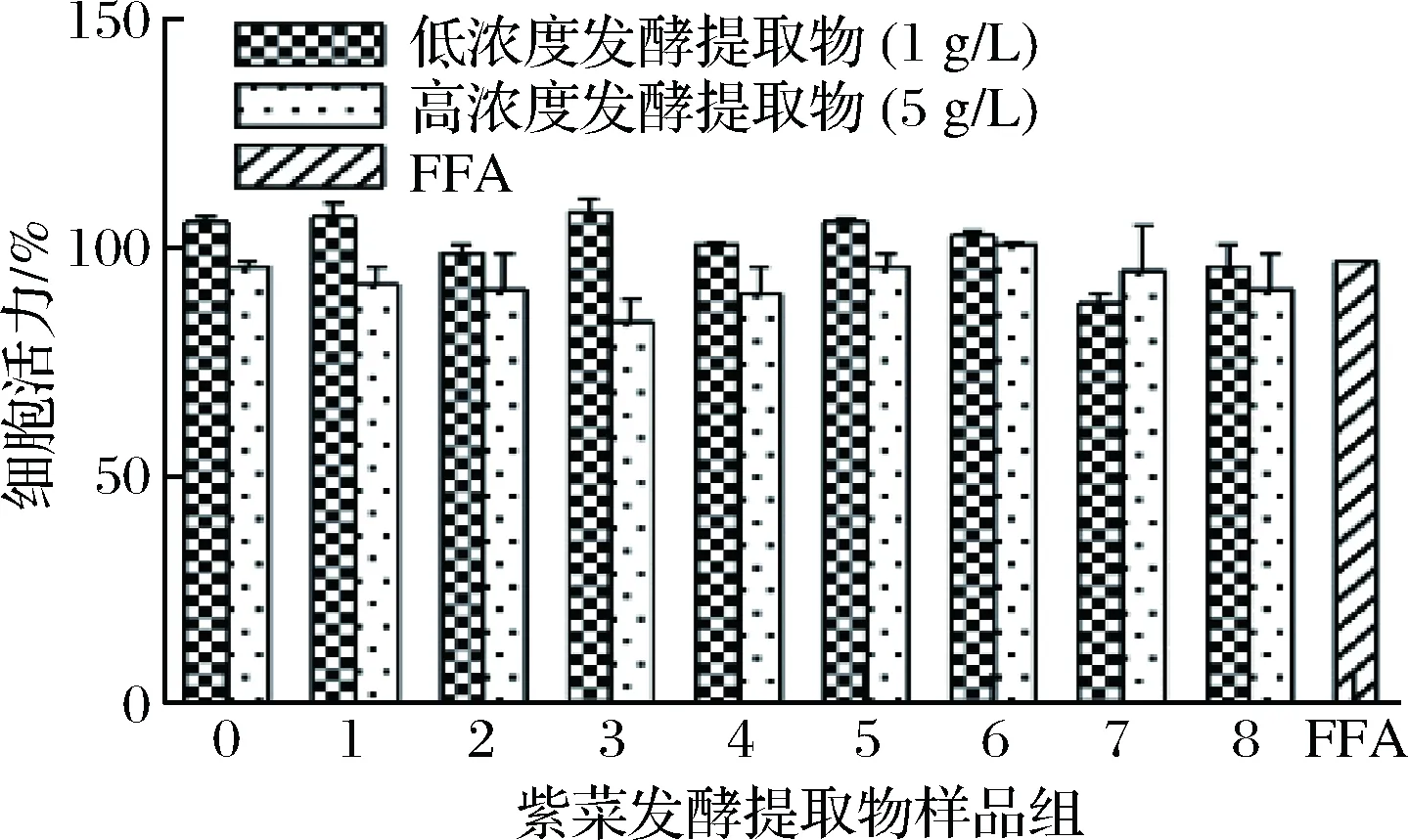
图2 提取物对LO2细胞活力对的影响Fig.2 MTT assay of extracts to the LO2 cell
结果表明,紫菜发酵提取物在指定浓度下对LO2细胞活力无显著影响,细胞活力均在体积分数80%以上,说明紫菜提取物无显著细胞毒性,并具有良好的细胞相容性。
2.3.2 发酵提取物对细胞内脂质堆积的影响
通过油红O染色观察不同浓度紫菜发酵提取物干预下影响FFA诱导处理细胞后胞内脂滴分布情况,见图3-a。
结果表明,5 g/L的7(枯草芽孢杆菌固态发酵醇提物)、8(不同浓度的枯草芽孢杆菌液态发酵醇提物)干预下,细胞内脂滴相较于模型组FFA明显减少,细胞轮廓变得不清晰,且5 g/L的8(枯草芽孢杆菌液态发酵醇提物)相较于阳性药物洛伐他汀的70%抑脂率无统计学差异(P< 0.05),见图3-b,说明枯草芽孢杆菌液态发酵醇提物可以有效抑制细胞内脂滴形成。另外,在1 g/L的4(枯草芽孢杆菌液态发酵水提物)干预下细胞内脂滴相较于模型组FFA也有所减少,对细胞的抑脂率为41%,说明该水提物对胞内脂质堆积也有一定的抑制作用。
2.3.3 发酵提取物对细胞内TG、TC含量的影响
通过测定细胞内TG、TC的含量,结果表明,1 g/L的紫菜发酵提取物对细胞内TG含量无明显影响,5 g/L 的4(枯草芽孢杆菌液态发酵水提物)处理后胞内TG含量相较于模型组FFA下降了30%,见图4。
5 g/L的0(紫菜浸提物)、不同质量浓度下的7(枯草芽孢杆菌固态发酵醇提物)、8(枯草芽孢杆菌液态发酵醇提物)处理细胞后,TC含量相较于模型组FFA显著下调(P< 0.05)。

a-胞内脂质堆积; b-抑脂率图3 油红染色后发酵提取物对细胞内脂质堆积的影响和半定量检测发酵提取物对细胞的抑脂率Fig.3 Effect of extracts to intracellular lipid accumulation and semi-quantitative detection of lipid suppression rate of fermentation extract to LO2 cells
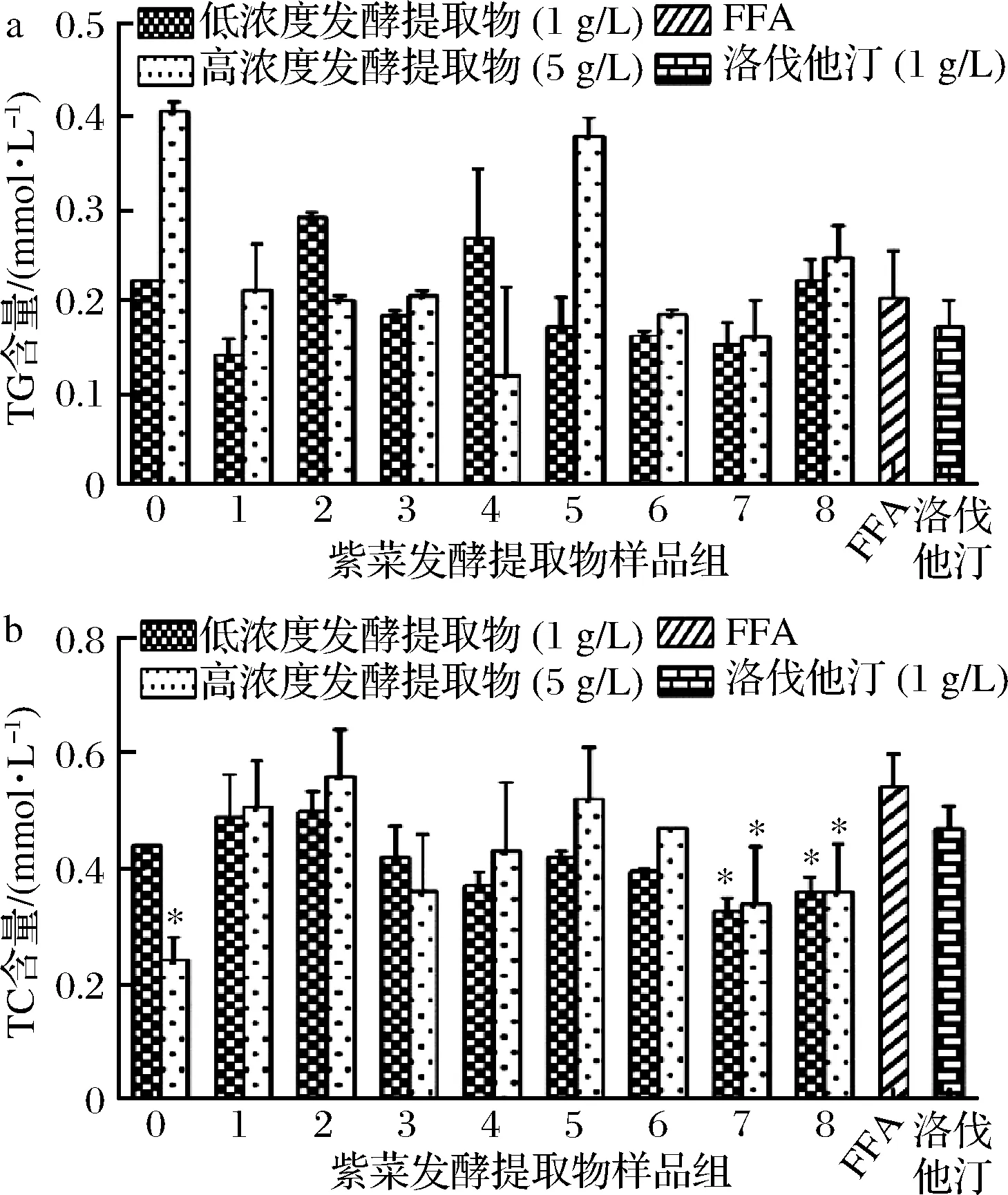
a-TG含量;b-TC含量图4 紫菜发酵提取物对细胞内TG和TC含量的影响Fig.4 Effect of extract on intracellular TG and TC content
3 结论
本研究在进行降血脂活性研究之前,通过HPLC对各个发酵提取物中物质成分及含量的差异性进行了分析,发现紫菜发酵前后的成分及含量有显著差异,同时通过研究发现紫菜发酵后水溶性蛋白质含量显著升高,这可能是由于菌体分泌的蛋白酶水解蛋白质大分子为低分子质量蛋白所致,这与马文强等[9]的研究结果一致。说明紫菜通过微生物发酵破壁的方式,可以更好地获得优质蛋白质,促进紫菜在体内的消化吸收,使得紫菜的营养价值得到提高。
利用NAFLD细胞模型的筛选结果发现紫菜发酵提取物对游离脂肪酸诱导细胞中脂滴的形成有抑制活性,其中枯草芽孢杆菌液态发酵水提物对胞内总甘油三酯(TG)有一定的下调作用,枯草芽孢杆菌固、液态发酵醇提物对总胆固醇(TC)含量具有显著下调作用,而发酵提取物对细胞内脂滴形成的抑制作用高于未发酵的紫菜浸提物,这说明紫菜发酵后的产物可能具有降血脂的活性。STEINKRAUS[24]、KIERS等[25]研究发现可以利用微生物发酵将蛋白质大分子水解为多肽、氨基酸等一些小分子物质。HONG等[26]研究表明,经Aspergillusoryzea发酵后,豆粕中蛋白质大分子降解为< 20 ku的小分子肽。邵伟等[27]研究发现豆粕经枯草芽孢杆菌发酵后将大豆蛋白水解为多肽,且得到的多肽经研究发现具有促进微生物生长、降血脂等生理活性。因此推测发酵提取物中具有降血脂活性的物质可能是酵母菌和枯草芽孢杆菌菌体分泌的酶将紫菜中的大分子蛋白质水解为的小分子肽,这还有待进一步的分离纯化鉴定,为紫菜的活性研究提供理论基础。
