卵白蛋白低聚肽的体外抗氧化及ACE抑制作用
2019-07-04张江涛秦修远贾福怀袁媛周明方磊张瑞雪谷瑞增刘文颖
张江涛,秦修远,贾福怀,袁媛,周明,方磊,张瑞雪,谷瑞增*,刘文颖*
1(中国食品发酵工业研究院,北京市蛋白功能肽工程技术研究中心,北京,100015) 2(宁波御坊堂生物科技有限公司,浙江 宁波,315012)
鸡蛋是人类摄入营养的重要来源之一,含有丰富的蛋白质、脂质、维生素、矿物质和生长因子,其蛋白质主要分布在蛋黄和蛋清当中,其中蛋清蛋白的含量最为丰富,而卵白蛋白又是蛋清中的主要蛋白质(占54%),是获得生物活性肽的很好资源[1]。目前研究认为,人体内存在独立的二肽、三肽转运系统,相比较于蛋白质和游离氨基酸,低聚肽具有吸收速度快、耗能低、不易饱和等特点[2];另外研究发现食源性低聚肽往往具有抗氧化、降血压、免疫调节等多种生物活性功能,在食品、医药和饲料行业展现出极好的应用前景[3]。
人体正常的生命活动过程中,机体内的多种生理活动代谢产物都会产生自由基,因其具有未配对的电子对而非常不稳定,若在体内发生氧化则可能会引发一些疾病,如心脑血管疾病、皮肤病等[4]。具有抗氧化活性的低聚肽能够利用其活性位点或基团,配对电子、清除自由基,从而达到一定的抗氧化效果[5]。血管紧张素转化酶(angiotensin converting enzyme,ACE),是人体调节血压的一种关键酶。ACE抑制肽是ACE活性区域较强的竞争性抑制剂,能够阻止血管紧张素Ⅰ转化为血管紧张素Ⅱ,从而一定程度上抑制血管收缩和胆固醇分泌[6];另外还可以阻止舒缓激肽的降解,保证其正常的血管收缩能力,从而达到降血压的作用[7]。很多抗氧化和降压药物也是利用相同的作用机理,但是单一药物往往对人体有一定的副作用,长期食用会造成严重损伤,所以说寻找安全可靠的功能性食源类替代品是非常有必要的。
目前,关于卵白蛋白低聚肽的抗氧化性和ACE抑制活性的文献鲜有报道,本实验的主要目的是用多种方法较全面地评价卵白蛋白低聚肽的体外抗氧化能力以及ACE抑制作用,为下一阶段特征性功能肽段的筛选奠定一定的基础,为相关抗氧化和降血压等保健类食品的开发利用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
卵白蛋白低聚肽,北京中食海氏生物技术有限公司通过两步酶解法获得;4种分子质量肽标准品、Vc、邻苯三酚、三氯乙酸,美国Sigma公司;甲醇(色谱纯),美国Fisher公司;三氟乙酸(分析纯),英国Alfa Aesar公司;乙酸、硼酸、HCl(分析纯),北京化工厂;血管紧张素转化酶(angiotensin converting enzyme,ACE)、马尿酰组氨酰亮氨酸(HHL)(色谱纯),美国Sigma公司;卡托普利,北京曙光药业公司。
QSY-Ⅱ型凯氏定氮仪,北京强盛分析仪器制造中心;835-50型氨基酸分析仪,日本日立公司;LC-20A高效液相色谱仪,日本SHIMADZU公司;UV22100紫外可见分光光度计,尤尼柯上海仪器有限公司。
1.2 方法
1.2.1 卵白蛋白低聚肽的基础成分测定
总蛋白含量测定采用GB/T 5009.5规定的凯氏定氮法[8];酸溶蛋白质含量测定采用三氯乙酸法[9];脂肪含量测定采用GB/T 5009.6规定的酸水解法[10];灰分含量测定采用GB/T 5009.4规定的灼烧法[11];水分含量测定采用GB/T 5009.3规定的常压干燥法[12]。
1.2.2 卵白蛋白低聚肽总氨基酸组成和游离氨基酸含量的测定
参照GB/T 5009.124食物中氨基酸的测定方法[13],检测卵白蛋白低聚肽中总氨基酸组成和游离氨基酸的含量,其中游离氨基酸不需要水解,采用氨基酸自动分析仪进行分析。
1.2.3 卵白蛋白低聚肽分子质量分布的测定
采用高效液相凝胶色谱法(HPLC)测定其分子质量分布情况[14]。色谱柱采用:TSKgel G2000 SWXL (300×7.8) mm;将样品溶解于流动相并过膜,用高效液相色谱仪进行凝胶过滤,紫外检测器进行检测,最后使用G P C软件对色谱数据进行处理。以4种肽标准品做相对分子质量标准曲线:乙氨酸-乙氨酸-乙氨酸(分子质量189 u)、乙氨酸-乙氨酸-酪氨酸-精氨酸(分子质量451 u)、杆菌酶(分子质量1 450 u)和细胞色素C(分子质量12 500 u)。
1.2.4 DPPH自由基(DPPH·)清除能力测定[15]
分别配制8个不同浓度的样品溶液1.5 mL,与1.5 mL浓度为0.1 mmol/L的DPPH溶液混合于试管中,避光30 min后于517 nm下测其吸光值Ai,同时测相同体积的乙醇与DPPH混合液的吸光值A0,以及样品与乙醇混合液的吸光值Aj,其自由基清除率计算公式(1)为:
(1)
参考张强等[16]方法,并略微改动。取0.05 mol/L的Tris-HCl(pH 8.2)4.5 mL于试管中,25 ℃水浴预热20 min。分别加入不同浓度的样品液0.1 mL,再加入0.3 mmol/L的邻苯三酚0.3 mL,混匀后于25 ℃水浴中准确反应4 min,立即加入2滴8 mol/L的HCl终止反应,于325 nm下测其吸光值A。空白组以去离子水代替样品。按公式(2)计算超氧阴离子自由基清除率。
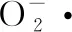
(2)
式中:A空白,去离子水代替样品测得的吸光值;A样品,加入样品液测得的吸光值。
1.2.6 羟基自由基(·OH)清除能力测定
采用水杨酸钠法测定样品中·OH清除能力[17]。反应体系为2.3 mmol/L FeSO4溶液1 mL,2.3 mmol/L水杨酸钠-乙醇溶液1 mL,不同浓度样品溶液0.5 mL,最后加入1 mL H2O2溶液(2.2 mmol/L)启动反应,37 ℃水浴锅中反应1 h后,于520 nm下测定吸光值。计算公式(3)为:
(3)
式中:A0,不加样品的吸光度值;Ai,加入样品的吸光度值;Aj,无显色剂时样品的本底值。
1.2.7 ACE抑制率测定
通过反向高效液相色谱(RP-HPLC)的方法测定ACE抑制作用[18]。将20 μL样品溶液与30 μL ACE溶液(50 mg/mL)充分混合,置于37℃水浴锅中预热5 min后,加入50 μL的HHL溶液(7.6 mmol/L)在37 ℃水浴锅中反应30 min。加入100 μL的HCl(1 mol/L) 终止反应,再加入硼酸缓冲液400 μL,混匀后RP-HPLC检测(空白对照为硼酸缓冲液,阳性对照为降血压药物卡托普利)。
色谱图中,ACE的酶解产物马尿酸的峰面积与马尿酸的浓度之间成线性关系,因此通过测定加入样品前后马尿酸峰面积的差别即可计算样品的ACE抑制率,如公式(4)。
(4)
式中:M为空白对照组中马尿酸的峰面积(mAu·s);N为添加样品组中马尿酸的峰面积(mAu·s)。
1.2.8 数据分析
实验平行3次,采用Excel、Origin 8.0软件进行数理统计分析与相关性分析。
2 结果与分析
2.1 卵白蛋白低聚肽的基础理化成分
卵白蛋白低聚肽的总蛋白质含量为(87.25±0.57)%酸溶蛋白含量高达(80.21±3.47)%,脂肪含量为(0.07±0.01)%、灰分含量为(5.43±0.12)%、水分含量为(5.01±0.27)%。刘文颖等[19-20]在玉米低聚肽研究中,测得总蛋白质含量为89.28%,酸溶蛋白质含量为84.20%,占总蛋白质94.31%;小麦低聚肽抗氧化实验中,酸溶蛋白占总蛋白的93%,都与本文的卵白蛋白低聚肽的酸溶蛋白比例相接近;此外水分、脂肪和灰分含量也相似。研究发现,只有小分子的肽类物质和游离氨基酸可以溶于酸性溶液,大分子蛋白往往遇酸沉淀。卵白蛋白的酸溶蛋白占总蛋白含量的91%,表明卵白蛋白低聚肽的主要成分为小分子肽类物质及氨基酸(表1)。

表1 卵白蛋白低聚肽的基础理化成分Table 1 Basic physical and chemical components of ovalbumin oligopeptide
2.2 卵白蛋白低聚肽的分子质量分布
通过HPLC进一步分析卵白蛋白低聚肽的相对分子质量,其分子质量分布凝胶色谱图和具体的分子质量分布情况分别如图1和表2所示。卵白蛋白低聚肽分子质量高于1 000 u的仅占7.42%,低于1 000 u 占92.58%,主要集中在140~500 u(占71.24%)。
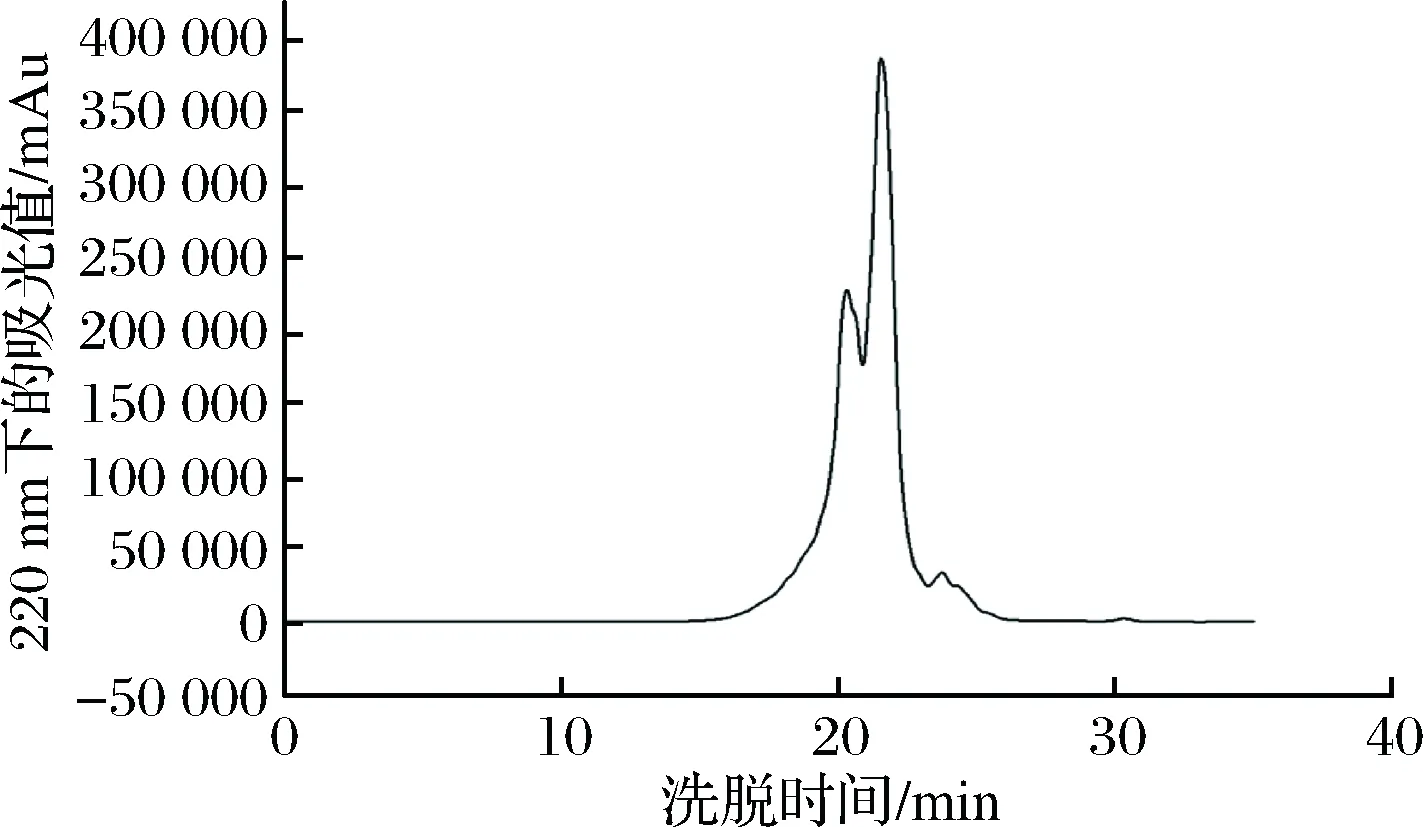
图1 卵白蛋白低聚肽分子质量分布凝胶色谱Fig.1 Ovalbumin oligopeptide molecular weight distribution gel chromatography
表2 卵白蛋白低聚肽的分子质量分布Table 2 Molecular weight distribution of ovalbumin oligopeptide
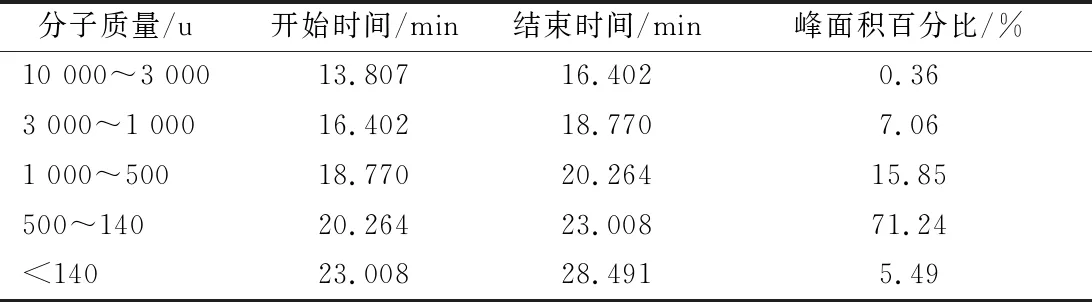
分子质量/u开始时间/min结束时间/min峰面积百分比/%10 000~3 00013.80716.4020.363 000~1 00016.40218.7707.061 000~50018.77020.26415.85500~14020.26423.00871.24<14023.00828.4915.49
相对分子质量的大小,直接决定肽的吸收速率,分子质量低于1 000 u的多为二肽和三肽。研究发现,二肽、三肽的转运吸收存在独立的系统以及相应的载体[21]。相比较于蛋白质和游离氨基酸,肽具有吸收速度快、耗能低、不易饱和、各种肽之间转运无竞争性与抑制性等特点[22],因此可以推论卵白蛋白低聚肽具有良好的吸收效率。
2.3 卵白蛋白低聚肽的氨基酸组成
卵白蛋白低聚肽的总氨基酸组成如表3所示,其氨基酸组成比较完善,含有丰富的谷氨酸、亮氨酸、丝氨酸、异亮氨酸、赖氨酸、苯丙氨酸、精氨酸和丙氨酸,其中必需氨基酸和半必需氨基酸(精氨酸和组氨酸)含量分别为36.92%和6.66%。丰富的氨基酸组成对人体生理机能的调节具有重要意义,例如,谷氨酸是中枢神经系统中兴奋性神经突触的主要神经递质,在维持神经细胞信号传导中起重要作用[23];赖氨酸是第一限制性氨基酸,能影响其他氨基酸的吸收利用,同时还能影响机体的代谢和免疫[24];亮氨酸、异亮氨酸、缬氨酸作为支链氨基酸,是体内重要的供能氨基酸[25]。此外测得游离氨基酸的含量很少,仅占4.92%,表明本实验所得的卵白蛋白低聚肽多为小分子肽段。
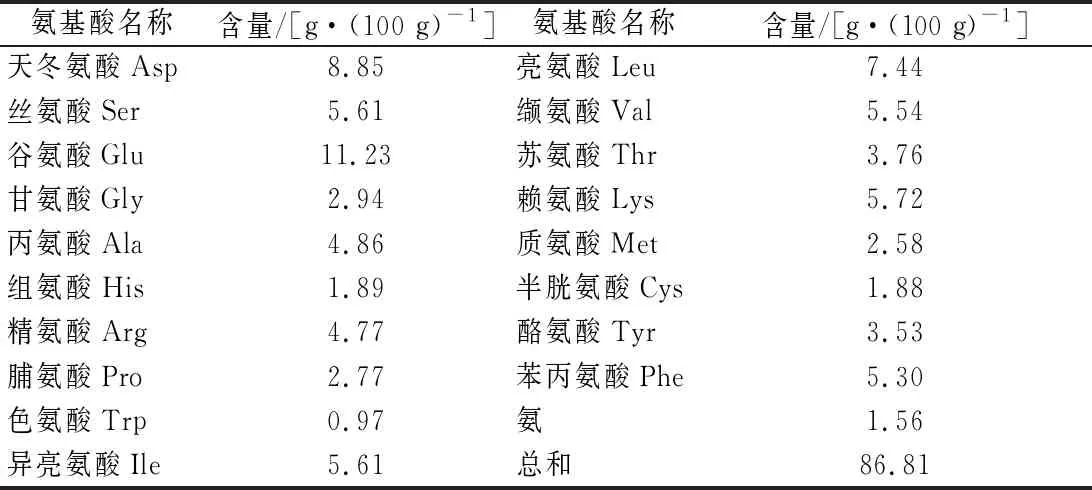
表3卵白蛋白低聚肽的总氨基酸组成Table 3 Total amino acid composition of ovalbumin oligopeptide
氨基酸的种类和数量对肽的功能活性有关键性影响。研究表明,许多氨基酸及其衍生物具有抗氧化能力,如亮氨酸、组氨酸、精氨酸、酪氨酸、赖氨酸、缬氨酸、丙氨酸、半胱氨酸、脯氨酸等;含有组氨酸的二肽、由酪氨酸和组氨酸组成的三肽等都具有较强的抗氧化能力[26-27]。KONG等[28]研究发现玉米低聚肽良好的抗氧化能力与其含有如亮氨酸等具有较强螯合金属离子能力的氨基酸有关。卵白蛋白低聚肽中亮氨酸等抗氧化性氨基酸高达38.45%,可与金属离子发生螯合反应,可能是极具潜力的具有抗氧化性的天然物质。另外卵白蛋白低聚肽含有较多的疏水性氨基酸,具有潜在ACE抑制作用[29]。
2.4 卵白蛋白低聚肽的抗氧化作用
2.4.1 卵白蛋白低聚肽对DPPH·的清除能力
DPPH·在有机溶剂中是一种稳定的自由基,在517 nm处具有最大吸收率,有自由基清除剂存在时,DPPH·的单电子被捕捉而使其颜色变浅,吸光度与抗氧化性成反比线性关系,是评价物质抗氧化能力的一项重要指标[30]。图2-A展示了卵白蛋白低聚肽的DPPH·清除能力,在0~5 mg/mL,清除率和浓度呈现出良好的线性关系,在质量浓度为6 mg/mL 时清除率达到80%,之后随着浓度增高逐渐趋于平稳,其半抑制质量浓度(IC50)为0.25 mg/mL。

A-卵白蛋白;B-Vc图2 卵白蛋白低聚肽和Vc的DPPH自由基清除作用Fig.2 DPPH free radical scavenging effect of ovalbumin oligopeptide and Vc
另外Vc作为阳性对照(图2-B),清除率最高可达到98%,明显优于卵白蛋白的DPPH·清除率。相比较于单一成分的Vc来说,卵白蛋白低聚肽属于天然小分子混合物,其在达到较高质量浓度时也能起到较高的清除作用。与其他低聚肽物质相比,卵蛋白低聚肽显示出较强的DPPH·清除能力。王宁丽等[31]对鱼皮低聚肽抗氧化性研究中发现,其DPPH·清除率IC50值为0.635 mg/mL;刘文颖等[5]大豆低聚肽的DPPH·清除率IC50值为2.6 mg/mL,清除作用都不及卵白蛋白低聚肽。卵白蛋白低聚肽能够抑制脂质过氧化链反应,从而起到清除DPPH·的作用。
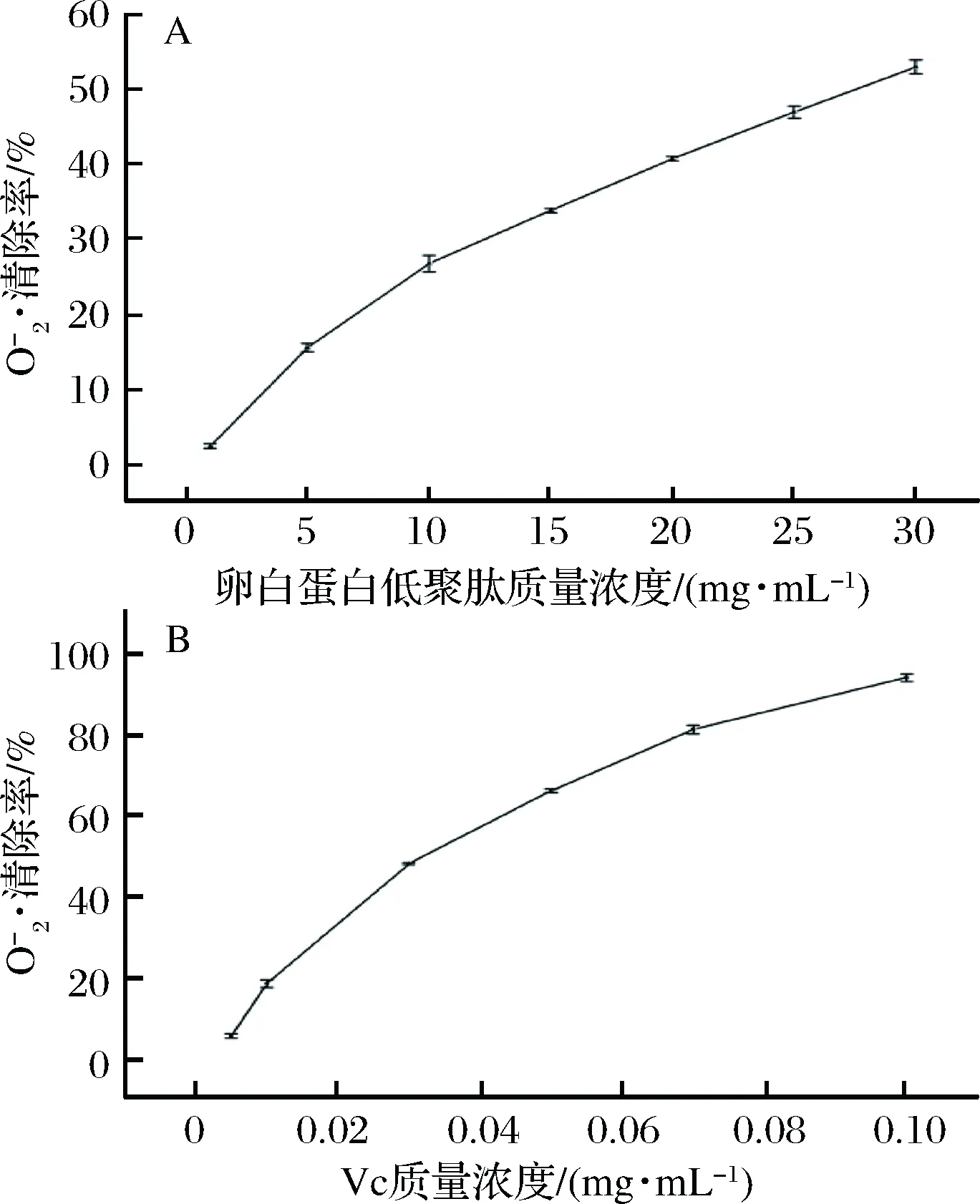
A-卵白蛋白; B-Vc图3 不同浓度的卵白蛋白低聚肽和Vc的清除作用Fig.3 Effect of different concentrations of ovalbumin oligopeptide and Vc superoxide anion radical scavenging
2.4.3 卵白蛋白低聚肽对·OH的清除作用
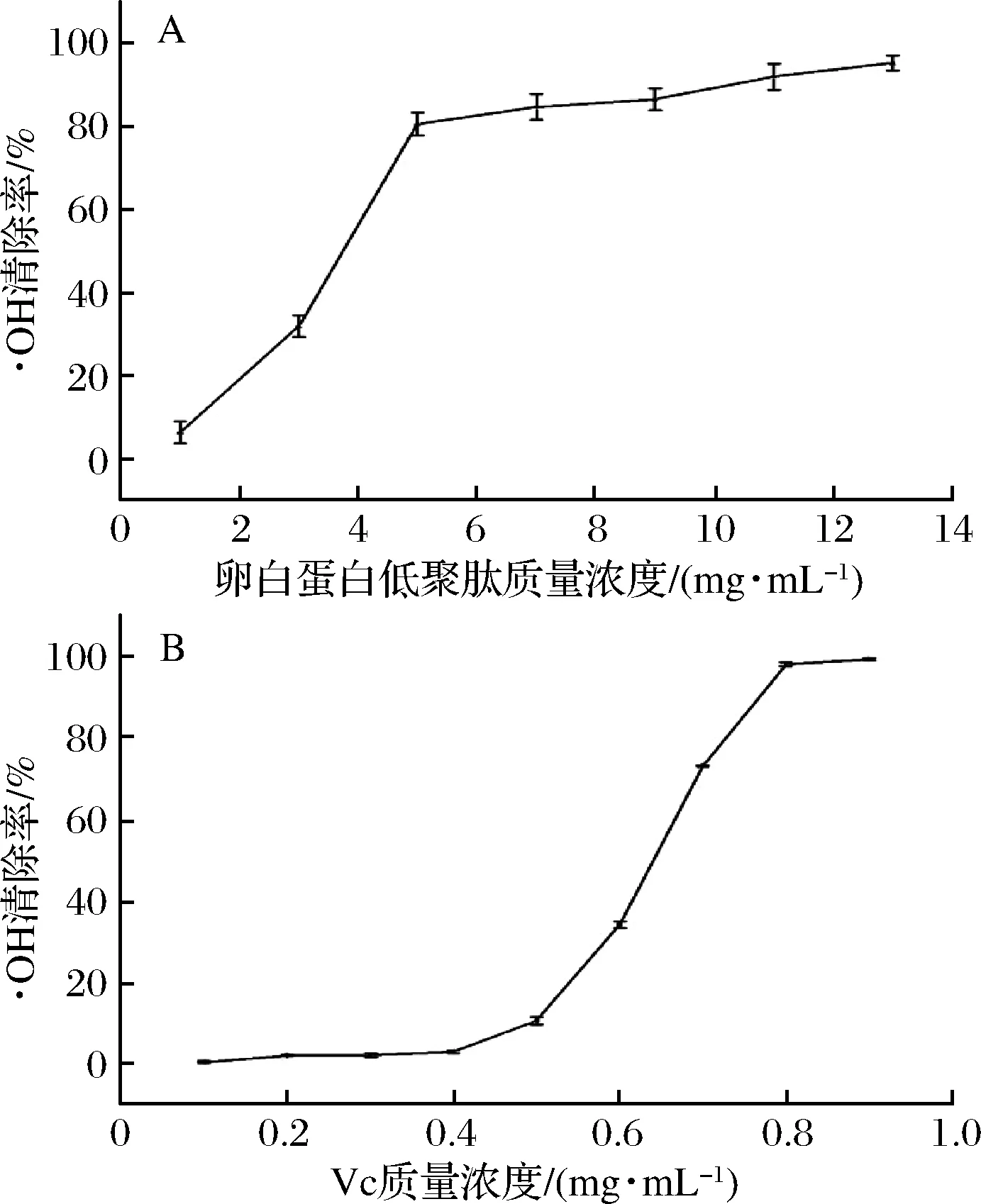
图4 不同质量浓度的卵白蛋白低聚肽和Vc的羟基自由基清除作用Fig.4 Hydroxyl radicals scavenging effects of different concentrations of ovalbumin oligopeptides and Vc
2.5 卵白蛋白低聚肽的ACE抑制能力
由图5-A可见,卵白蛋白低聚肽的ACE抑制率随着其质量浓度的增加而逐渐升高,当质量浓度3.0 mg/mL 时抑制率达到80%,半抑制浓度(IC50值)为1.5 mg/mL,显示出较好的ACE抑制作用;作为阳性对照的常见降压药,卡托普利ACE抑制率如图5-B所示,其质量浓度为0.2 mg/mL时达到95%,IC50值为0.065 mg/mL。BOUGATEF等[35]研究的沙丁鱼蛋白水解物的ACE抑制率IC50值为1.2 mg/mL;刘文颖[36]研究的鲑鱼皮胶原低聚肽的ACE抑制率IC50为1.18 mg/mL,都与本实验卵白蛋白低聚肽的ACE抑制能力相接近;另外HAI等[37]测定了48种海洋蛋白质水解产物ACE抑制活性,IC50值范围为0.17~501.7 mg/mL,与本实验IC50值1.5 mg/mL比较而言,可知本实验所得的卵白蛋白低聚肽具有较强ACE抑制活性。但是相比较于降压药物卡托普利,其ACE抑制活性要弱的多,但是长期食用卡托普利可能引起味觉失调、皮疹和肾脏毒害等有副作用,而卵白蛋白低聚肽属于食物蛋白质,具有高安全性,作用温和,适合长期食用。
图5 卵白蛋白低聚肽和卡托普利的ACE抑制能力Fig.5 ACE inhibitory ability of ovalbumin oligopeptide and captopril
3 讨论

有研究表明,肽的ACE抑制活性可能与其肽链长度有关,ACE抑制肽的分子质量比较低,一般低于1 000 u[39]。卵白蛋白低聚肽中低于1 000 u的小肽占92.58%,其中二肽、三肽为主要成分,能够保持良好的ACE抑制活性,这可能是其具有较好ACE抑制作用的原因之一。此外卵白蛋白低聚肽可能是对ACE活性区域亲合力较强的竞争性抑制剂,与ACE的亲合力比血管紧张素I或舒缓激肽更强,从而阻碍ACE催化血管紧张素I的转化和舒缓激肽的降解,最终达到降血压的作用。有研究表明,ACE抑制肽往往含有疏水性氨基酸残基,并且ACE抑制肽C端的3个氨基酸序列会影响多肽结合ACE的能力,若该位置有疏水性氨基酸时往往具有较高的ACE抑制活性[40];另外有研究者发现,ACE抑制肽C端氨基酸为芳香族氨基酸或者脯氨酸,或者N端为疏水性氨基酸时,其ACE抑制能力较强[41]。卵白蛋白低聚肽中疏水性氨基酸含量高达35.83%,这可能与其较强的ACE抑制能力相关,此外推测其可能具有上述所说的结构特征,需要下一阶段实验对功能肽段进行筛选验证。
4 结论

