微生物还原法合成纳米硒益生菌的筛选及其培养条件优化
2019-07-04王丽红毛建丽耿懿璠
王丽红, 杨 辉, 毛建丽, 耿懿璠, 苏 文, 贺 博
(1.陕西科技大学 食品与生物工程学院, 陕西 西安 710021; 2.安康市富硒产品研发中心 农业农村部富硒产品开发与质量控制重点实验室, 陕西 安康 725000 )
0 引言
硒(Se)是一种对生物系统有广泛影响的重要微量元素,包括抗氧化、抗癌、抗病毒和促进生长繁殖等生物学效应[1].缺硒可导致心血管疾病、癌症、大骨节病、病毒感染性疾病的发生[2-4].目前人体补硒的形式主要为传统的无机硒、有机硒.无机硒一般安全性低,每日服用超过800μg就会引起中毒,生物利用率低.有机硒是目前主要的补硒形式,有机硒比无机硒有较高的生物活性,但价格高,资源匮乏.急性毒性实验研究[5]发现LD50值对无机硒(亚硒酸盐)为15.72 mg/kg body weight,而纳米硒则为112.98 mg/kg body weight,说明纳米硒具有低毒高效的活性优势,作为一种高活性、高安全的补硒产品将成为替代其他形式硒营养制剂或药剂的最佳选择.纳米硒的合成有化学法与生物转化法,生物法转化合成的纳米硒呈规则的球状,且稳定性好,不易转化成褐色或黑色的单质硒,因而性能优于化学合成的纳米硒[6].目前发现许多微生物如蜡样芽胞杆菌(BacillusCereus)[7]、假单胞菌(Pseudomonas alcaliphila)[8,9]、地衣芽孢杆菌(BacillusLicheniformis)[10]、干酪乳杆菌(Lactobacilluscasei)[11],枝状动胶菌(Zooglearamigera)[12]、沼泽红假单胞菌(Rhodopseudomonaspalustris)[9]、大肠杆菌(Escherichiacoli)[13]等能将亚硒酸或硒酸盐还原成红色纳米单质硒.
益生菌是一类能够通过促进肠道菌群平衡,对宿主发挥有益作用的活的微生物.近年来的研究发现,越来越多的疾病与肠道菌群失调相关.调节肠道菌群平衡对许多疾病的治疗有重要意义,从而使益生菌在胃肠道疾病、肥胖与代谢紊乱相关疾病、抑郁症的防治等许多方面得到广泛应用[14].刘红芳等[15]筛选出中1株乳酸菌,亚硒酸钠还原效率为46.79%,并应用于小鼠生长繁殖及抗氧化研究.本实验拟从实验室保存的10株益生菌中筛选能将亚硒酸钠还原为纳米硒的高转化率菌株,10株益生菌种类包括鼠李糖乳杆菌、双歧杆菌、嗜热链球菌、嗜酸乳杆菌、保加利亚乳杆菌、植物乳杆菌,均为人体肠道中的重要菌群,具有重要的生理功能.采用益生菌转化合成纳米硒将益生菌的保健功效和纳米的补硒相结合,后期可制备成高活性纳米硒益生菌复合发酵菌粉,应用于富硒益生菌发酵产品的开发.
1 材料和方法
1.1 菌种
陕西科技大学实验室分离保藏的10种益生菌,包括1#-鼠李糖乳杆菌(Rhamnoselactobacillus)、2#-双歧杆菌(Bifidobacterium)、3#-嗜热链球菌S2(Thermophilicstreptococcus)、4#-嗜酸乳杆菌 LA5(Lactobacillusacidophilus)、5#-保加利亚乳杆菌L9(Bulgarianlactobacillus)、6#-植物乳杆菌L6(Plantlactobacillus)、7#-保加利亚乳杆菌L13、8#-嗜酸乳杆菌LA3、9#-嗜热链球菌S13、10#-植物乳杆菌L3.
1.2 培养基和试剂
MRS肉汤和MRS培养基购于北京奥博星生物技术有限公司,亚硒酸钠山东西亚试剂有限公司,溴化氢、3,3-二氨基联苯胺、甲苯、甲酸、乙二胺四乙酸二钠均为分析纯.
1.3 实验仪器
恒温培养箱(重庆试验仪器设备厂),紫外-分光光度计(上海光谱仪器有限公司),高速冷冻离心机(湖南湘仪离心机仪器有限公司),冷冻干燥机(上海比朗仪器制造有限公司),高分辨场发射扫描电镜(美国FEI),X光衍射仪(德国布鲁克公司).
1.4 实验方法
1.4.1 菌株筛选
将保藏菌种接种MRS肉汤培养基连续活化3次后,以1%的接种量,接种于亚硒酸钠终浓度为1 g/L的MRS液体培养基,37 ℃厌氧培养72 h.以亚硒酸钠还原率及发酵醪液红色纳米硒的颜色为指标,筛选亚硒酸钠还原率高、发酵液红色物质生成量多的益生菌.将MRS中亚硒酸钠终浓度调整为3 g/L,重复以上操作,筛选耐受亚硒酸钠能力强、还原率高的菌株.然后将还原率较高的益生菌在含3 g/L亚酸钠的固体MRS平板上再划线培养,挑取红色单菌落,重复液体发酵、固体平板纯化3次以保证获得纯化的菌株.
1.4.2 X光衍射仪(XRD)和场发射高分辨扫描电镜(SEM)纳米硒表征
将嗜酸乳杆菌LA5接种于亚硒酸钠终浓度为的3 g/L的MRS液体培养基中,37 ℃厌氧培养72 h得到纳米硒益生菌发酵醪液,高速冷冻离心机离心10 min(10 000 r/min,4 ℃),弃上清液收取沉淀,再用无菌水洗涤三次离心得湿菌粉,在-20 ℃下预冻2 h后冻干24 h,进行XRD测定和SEM观察.
1.4.3 亚硒酸钠浓度对菌体生长和亚硒酸钠还原率的影响
将嗜酸乳杆菌LA5以1%接种量接种于含有不同浓度亚硒酸钠(4 g/L、6 g/L、8 g/L、10 g/L、12 g/L)的MRS液体培养基中,37 ℃厌氧培养72 h,每个处理三个重复.观察菌体生长情况、亚硒酸钠还原率及发酵液颜色.
1.4.4 发酵时间对纳米硒形成及亚硒酸钠还原率的影响
将嗜酸乳杆菌LA5以1%接种量接种于亚硒酸钠浓度为6 g/L的MRS液体培养基中,37 ℃厌氧培养,观察菌体在不同培养时间(12 h、24 h、36 h、48 h、60 h、72 h)亚硒酸钠还原率及发酵液颜色变化.
1.4.5 培养温度对纳米硒形成及亚硒酸钠还原率的影响
将嗜酸乳杆菌以1%接种量接种于亚硒酸钠浓度为6 g/L的MRS液体培养基中,不同的温度下(28 ℃、31 ℃、34 ℃、37 ℃、40 ℃)厌氧培养48 h,观察菌体生长、亚硒酸钠还原率及发酵液颜色变化.
1.4.6 pH对纳米硒形成及亚硒酸钠还原率的影响
将嗜酸乳杆菌以1%接种量接种于亚硒酸钠浓度为6 g/L的MRS液体培养基中,37 ℃厌氧培养48 h,研究不同在pH(4.5、5.0、5.5、6.0、6.5、7.0)的培养基中,菌体生长、亚硒酸钠还原率及发酵液颜色变化,确定最适合pH.
1.4.7 数据测定与处理
硒酸钠含量测定采用分光光度法测定[16].
采用LSD法对各处理间的差异进行多重比较.
2 结果与讨论
2.1 菌株筛选
在微生物生长繁殖过程中中加入亚硒酸钠,低浓度可为菌体提供所需的硒元素,满足菌体生长,高浓度的硒盐会影响到培养液的电极电位、细胞膜的通透性和渗透压,从而对菌体的生长产生负面的影响.自然界中不同菌种对亚硒酸钠的耐受和转化形成纳米硒的能力不同,采用微生物培养转化合成纳米硒需对菌体的亚硒酸钠耐受性进行考察,或者对菌株进行亚硒酸盐的耐受性驯化,从而筛选出高活力菌株.本研究将实验室保存的10种益生菌接种于亚硒酸钠终浓度为1 g/LMRS发酵72 h后,观察发酵醪液颜色和亚硒酸钠还原率结果如表1所示.

表1 1 g/L亚硒酸钠浓度下益生菌发酵醪液颜色及亚硒酸钠的还原率
从表1可以看出,在亚硒酸钠浓度较低时,益生菌普遍能够转化亚硒酸钠形成红色的纳米硒颗粒,但不同菌种还原能力有较大差异,其中嗜热链球菌S2(3#)、嗜酸乳杆菌LA5(4#)、嗜酸乳杆菌LA3(8#)对亚硒酸钠的还原能力较强,红色纳米硒形成较多.说明嗜酸乳杆菌有较强转化能力,可能跟菌体内所含的亚硒酸钠还原酶活力较高相关.
进一步将这三种菌接种于亚硒酸钠终浓度为3 g/LMRS液体发酵72 h后,结果如表2所示.
许多益生菌能耐受低浓度的亚硒酸钠并还原亚硒酸盐形成纳米硒,但随着亚硒酸钠浓度的升高,硒对菌体的毒性增强,最终抑制菌体生长,影响纳米硒的转化率.当提高亚硒酸钠到3 g/L后,嗜酸乳杆菌转化能力仍然较强,形成的红色纳米颗粒较多.其中嗜酸乳杆菌LA5菌体的亚硒酸钠还原率最高94.2%,形成的红色纳米硒最多.发酵液放置4 ℃冰箱温下2周后,醪液依然呈红色,表明嗜酸乳杆菌LA5转化的纳米硒非常稳定,不容易转变成其他硒形式.

表2 3 g/L亚硒酸钠浓度下益生菌发酵醪液颜色及亚硒酸钠的还原率
2.2 X光衍射仪(XRD)测试结果
将嗜酸乳杆菌LA5纳米硒冻干后制备的纳米硒粉末进行XRD光谱分析,结果如图1所示.由图1可知,嗜酸乳杆菌转化形成的纳米硒为无定形态,无明显的结晶衍射峰,无定形态纳米硒反应活性高于晶体形态,有利于后期产品的开发.
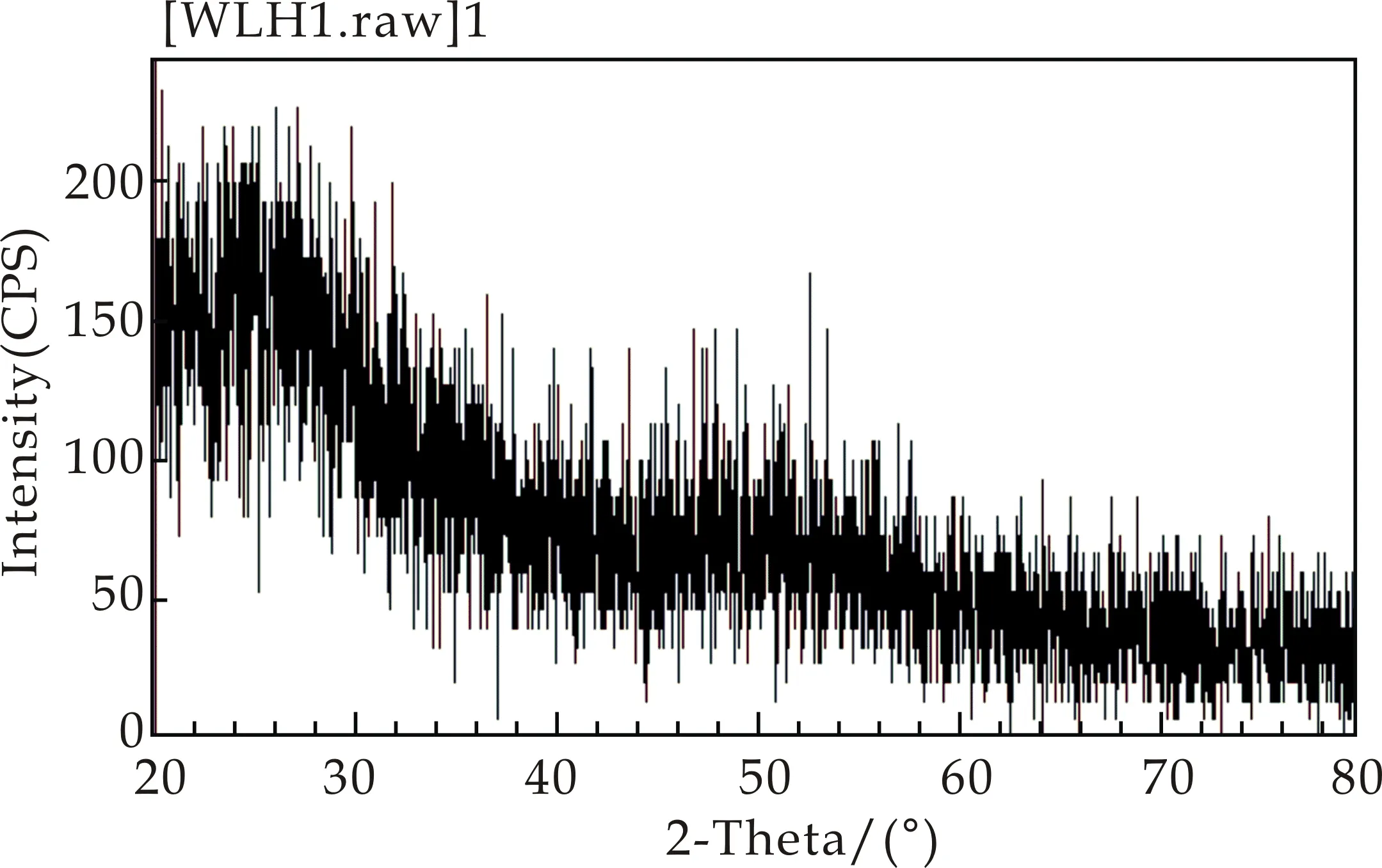
图1 纳米硒冻干粉XRD图谱
2.3 高分辨场发射扫描电镜(SEM)
将嗜酸乳杆菌LA5纳米硒冻干后制备的纳米硒粉末进行SEM光谱分析,结果如图2和图3所示.
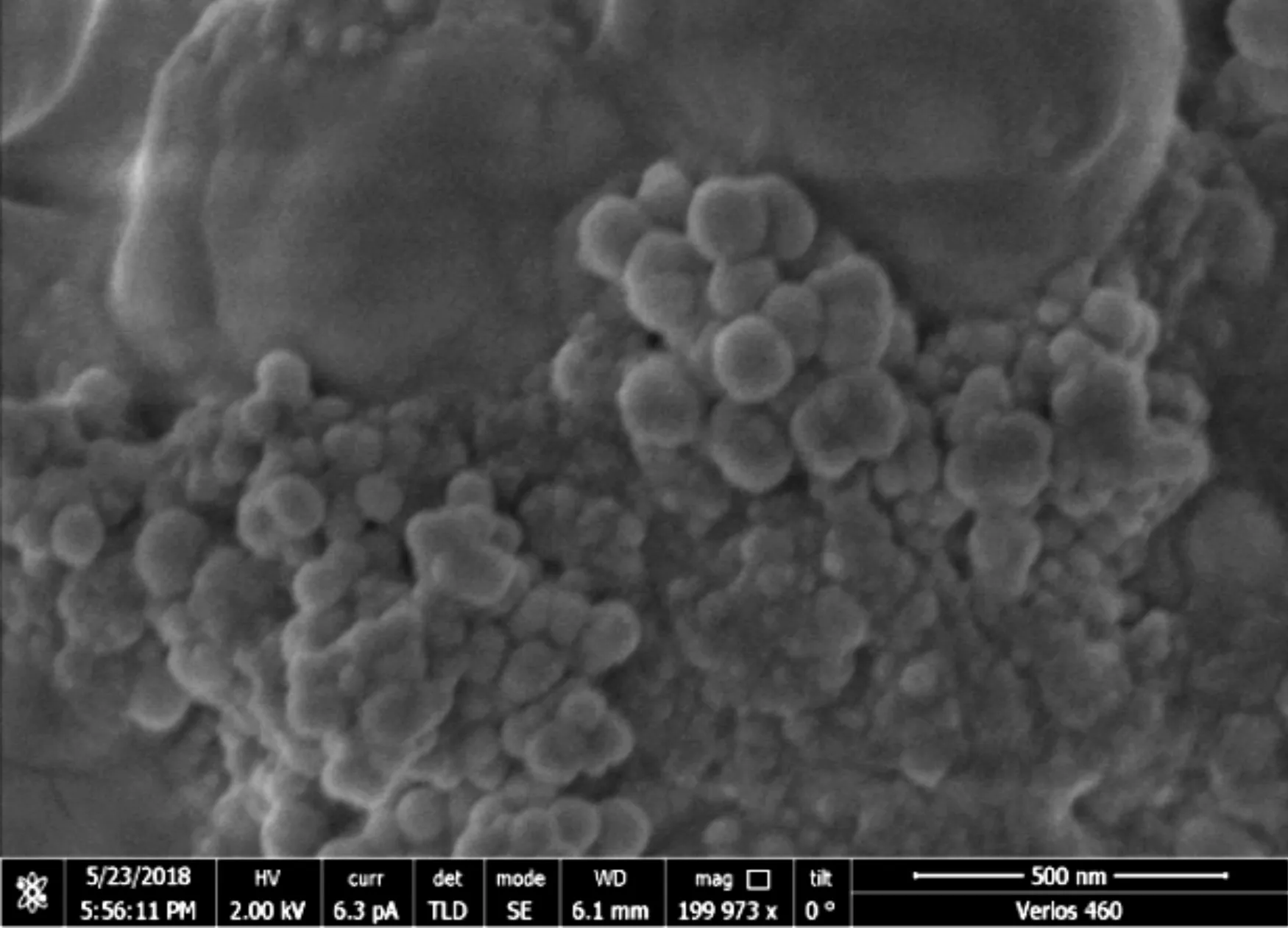
图2 嗜酸乳杆菌LA5制备纳米硒冻干粉的SEM图(200 000×)

图3 嗜酸乳杆菌LA5制备的纳米高倍SEM图(500 000×)
从图2可以看出,在菌体周围分散着大量纳米硒颗粒,颗粒呈规则的球形.图3中对较大的纳米颗粒测定直径,可见嗜酸乳杆菌LA5转化形成的纳米硒直径约80~150 nm,王华丽[17]研究发现,纳米硒粒径在200 nm以内才具有生物学效应.本实验转化的嗜酸乳杆菌LA5纳米硒颗粒更小,为后续研究纳米硒益生菌在体内生物活性奠定基础.
2.4 亚硒酸钠浓度对菌体生长和亚硒酸钠还原率的影响
正如2.1中的分析,亚硒酸钠加入培养基中,将会对菌株生长产生正负两方面的作用,因此,需要在不影响菌体生长的情况确定合成纳米硒适宜亚硒酸钠浓度.将嗜酸乳杆菌LA5接种于不同浓度亚硒酸钠浓度的培养基中,37 ℃厌氧培养72 h,观察菌体的生长情况,亚硒酸浓度对其还原率的影响如图4所示.

图4 亚硒酸钠浓度对其还原率的影响
实验结果表明,亚硒酸钠浓度对嗜酸乳杆菌LA5有较大影响.随着浓度增加发酵液中形成的红色纳米硒颗粒逐渐增多,6 g/L、8 g/L时,红色物质最多,但当超过10 g/L,菌体生长缓慢,红色物质减少,亚硒酸钠浓度为12 g/L时,发酵液较澄清,说明菌体生长受到明显抑制,形成红色纳米硒很少.综合考虑亚硒酸钠的利用率与嗜酸乳杆菌LA5菌体活力,10 g/L亚硒酸钠浓度转化的纳米硒最多,但是当浓度提高到8 g/L时,亚硒酸钠还原率开始下降,说明此时菌体生长受到了抑制,为了利于后期纳米硒益生菌发酵菌粉制备时菌体有较高的活力,确定6 g/L亚硒酸钠浓度为最佳浓度,本研究后续的合成条件优化发现,在最适宜条件下亚硒酸钠还原率在此浓度下也能达到90%左右.
2.5 发酵时间对纳米硒形成及亚硒酸钠还原率的影响
在微生物法合成纳米硒的过程中,微生物中酶或酶的还原性代谢产物起着重要作用,从而将亚硒酸钠还原形成纳米硒,还原性酶可在菌体生长过程中形成,也可以在进入稳定期后产生,研究不同发酵时间纳米硒的形成变化将有助于确定菌体生长和还原性酶的合成关系.将嗜酸乳杆菌LA5接种于亚硒酸钠浓度为6 g/L的MRS液体培养基中,37 ℃厌氧培养,观察菌体在不同培养时期发酵液颜色变化及亚硒酸钠还原率,菌体发酵时间对亚硒酸钠还原率的影响如图5所示.
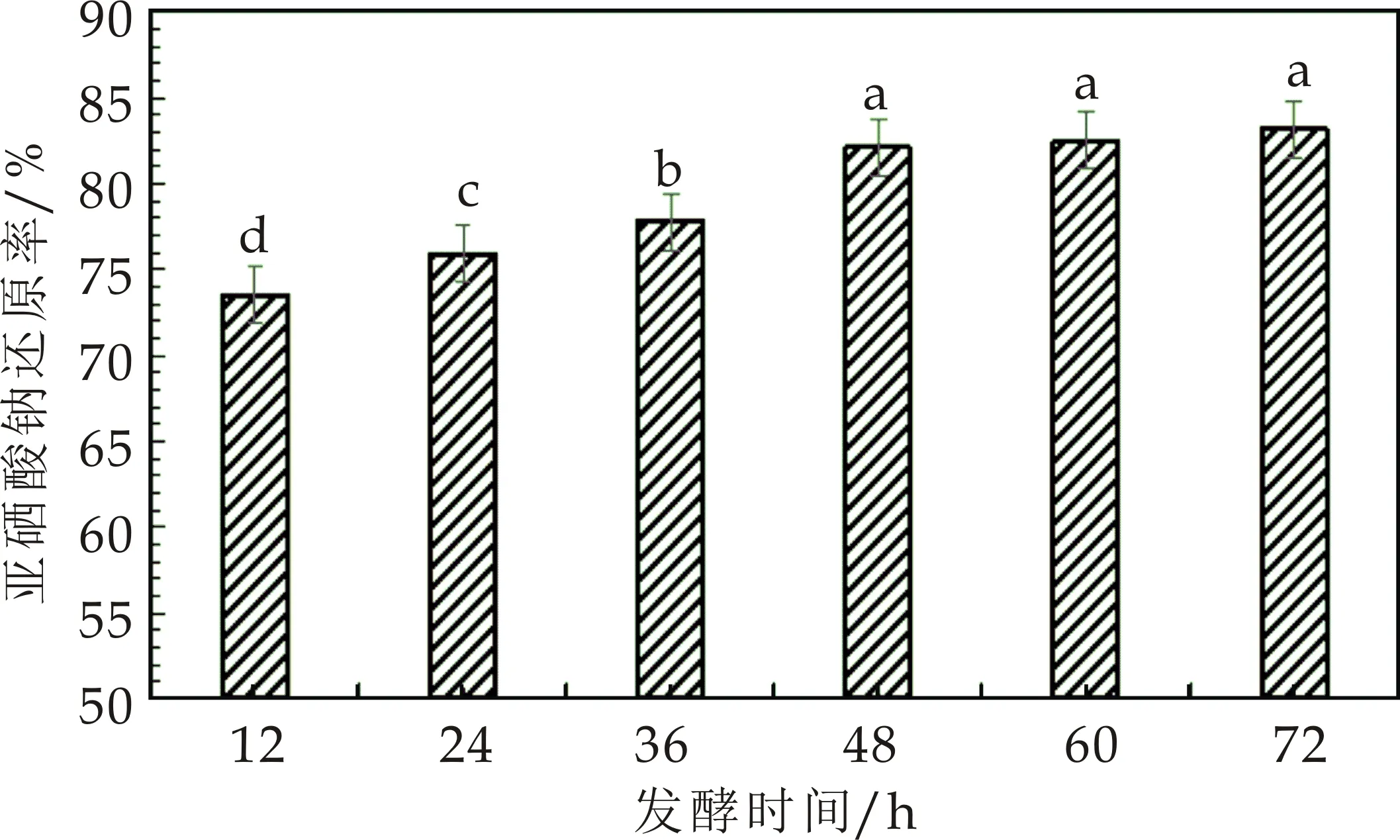
图5 发酵时间对亚硒酸钠还原率的影响
实验结果发现嗜酸乳杆菌LA5生长和纳米硒合成相偶联,随着菌体生长纳米硒合成,说明菌体在生长繁殖过程可能产生的某种酶将亚硒酸钠转化成纳米硒颗粒,当菌体进入稳定期后,红色纳米硒增加缓慢.发酵48 h时发酵液中红色纳米硒增加最多,还原率较高82.1%,发酵48 h后,还原率的增加较慢,菌体生长进入了稳定期,因此确定48 h是菌体生长和还原亚硒酸钠的最适发酵周期.
2.6 培养温度对纳米硒形成及亚硒酸钠还原率的影响
温度是影响一切化学反应的重要因素,温度不仅影响菌体的生长,更对代谢产物的形成产生较大影响,因此,通过考察温度对纳米硒合成的影响确定最佳温度.将嗜酸乳杆菌LA5接种于亚硒酸钠浓度为6 g/L的MRS液体培养基中,不同的温度下厌氧培养48 h.图6给出了温度对亚硒酸钠还原率的影响.

图6 培养温度对亚硒酸还原率的影响
结果表明,温度对菌体生长和亚硒酸钠的还原率有一定影响,随着温度升高,转化率升高,当温度为37 ℃时还原率最高,此时菌体生长速度最快,发酵液红色纳米硒积累较多,进一步说明菌体最适的生长温度和亚硒酸钠的转化温度基本一致.因此确定为适温度为37 ℃.
2.7 pH对纳米硒形成及亚硒酸钠还原率的影响
pH影响菌体细胞膜的带电状况和通透性,在亚硒酸根还原为单质硒的反应中,氢离子参与了反应过程,因此pH对菌体生长和亚硒酸等氧化电位产生明显的影响,进一步影响亚硒酸钠被还原速度和还原率,因而需要考察pH对还原率的影响.将嗜酸乳杆菌LA5接种于亚硒酸钠浓度为6 g/L的MRS液体培养基中,37 ℃厌氧培养48 h,在不同pH下观察菌体生长、发酵液颜色变化,图7显示了pH对亚硒酸钠还原率的影响.
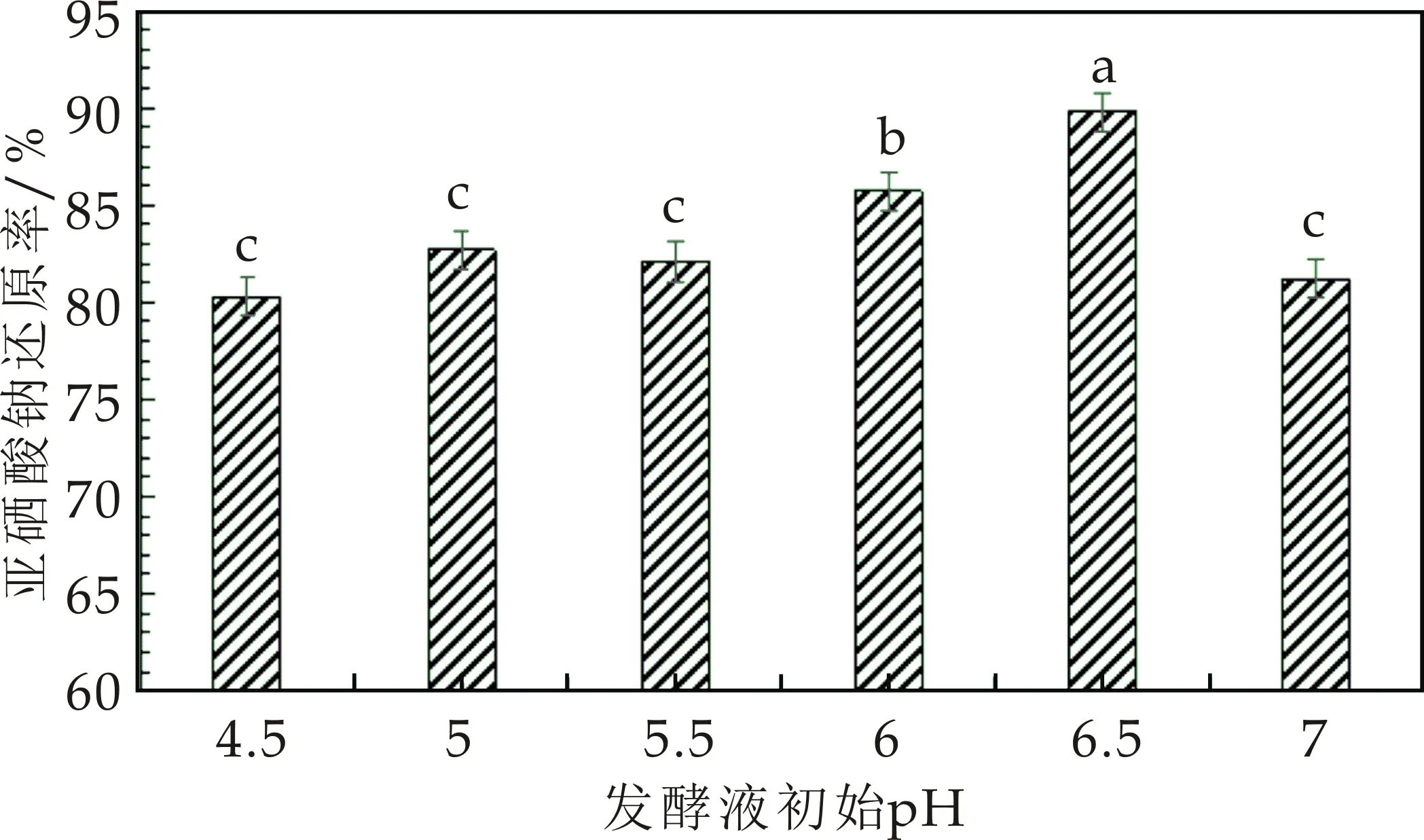
图7 pH对亚硒酸还原率的影响
结果发现,当pH 在酸性范围4.5~7之间时,菌体均能进行正常生长,并能还原亚硒酸钠形成纳米硒.当pH为6.5时,菌体生长良好,产生的红色物质最多,亚硒酸钠还原率达到89.8%.该结果说明,嗜酸乳杆菌LA5在pH为6.5生长良好,并能对亚硒酸钠进行快速还原,因此,6.5确定为最佳pH.
3 结论
(1)益生菌普遍能耐受一定亚硒酸钠,并能将亚硒酸钠还原成红色纳米硒.在供试的实验室10株益生菌中嗜酸乳杆菌LA5还原亚硒酸钠的能力最强.XRD和SEM分析表明所形成的纳米硒为无定形态,呈规则的球形,直径约80~150 nm.
(2)亚硒酸钠浓度、培养时间、培养温度、pH是影响纳米硒形成的重要因素,通过对嗜酸乳杆菌LA5转化纳米硒条件进行优化,确定亚硒酸钠加量6 g/L,培养时间为48 h,温度为37 ℃,pH为6.5为形成纳米硒的适宜条件,在此条件下亚硒酸钠还原率可达到89.8%.
采用嗜酸乳杆菌LA5转化合成纳米硒,发酵周期短,纳米硒转化率高,所形成的纳米硒益生菌同时具有益生菌保健功效和纳米硒的最佳补硒形式,并可制备成高活性纳米硒益生菌复合发酵菌粉,应用于富硒益生菌产品的开发.这类产品不仅富含易于人体肠道的益生菌、矿物质、维生素、膳食纤维,更增添了纳米硒双重营养保健功能,并将为人类健康水平的提高做出贡献.
