三聚氰胺及其金属络合物对活性污泥功能菌活性的影响
2019-07-04裴立影姬少斌王霞霞雷鑫乐郭昌梓
裴立影, 姬少斌, 王霞霞, 雷鑫乐, 郭昌梓
(陕西科技大学 环境科学与工程学院, 陕西 西安 710021)
0 引言
随着我国城市化进程的加快,生活污水的排放量空前增长,市政污水中含有大量的氮磷等营养元素,如不利用有效的方法对其进行去除会导致受纳水体的富营养化,造成水体生态恶化.统计结果表明,生活污水中源氮占我国废水总氮排放量的59.7%,工业废水中氮源占9.73%[1].虽然生活污水中的氨氮含量较高,但生活污水处理技术相对成熟.相比之下,工业废水由于含有大量难降解的含氮污染物,如多环芳烃、卤代烃、杂环类化合物、有机染料等,这些有机物不仅会增加污水处理厂进水中总氮的负荷,而且可能会对污水生物处理的主体——活性污泥产生毒害作用.
三聚氰胺(MA)是一种应用广泛的化工原料,是重要的尿素后加工产品,还可用作阻燃剂、减水剂、甲醛清洁剂等[2-4].MA的大量使用为MA进入环境尤其是水环境打开了缺口.研究结果表明,在河流和灌溉用水中都有MA的存在[5].Y.C.Qin等的研究发现在农田中经常会检测到MA,在生产MA的工厂附近的污水里MA的浓度则会更高[5].一直以来人们普遍认为只有在大量口服或者注射时,MA才表现出毒性[6].但大量的研究结果表明,食用被MA污染的食物会使得动物因急性肾衰竭而死亡[7-9],2008年,轰动全国的三鹿奶粉事件,同样证明了MA对人体的毒性[10].由此可见,MA是一种广泛存在的对人和动物体具有一定毒性的物质.
城市污水处理厂是污染物进入水体的最后一道屏障, MA通过排水系统进入污水处理厂,其本身及其与金属离子的络合物皆可能对活性污泥系统的生化过程带来影响.Shengnan Xu等[11]对三聚氰胺对活性污泥的长期影响进行了研究,结果显示,活性污泥很难诱导出可以降解三聚氰胺的酶,因此也很难将其降解.Hongxue An等[12]认为三聚氰胺在活性污泥中的去除主要是由吸附而非生物降解引起的.迄今为止,MA及其络合物对活性污泥系统短期影响方面的报道仍然鲜见.本研究的目的是探究MA及其络合物对硝化菌和聚磷菌活性造成的影响.研究结果为MA的最终处理提供基本理论和方法.
1 实验部分
本研究主要通过批式试验的方法考察MA-Cu2+络合物对活性污泥中功能菌的影响,首先考察了Cu2+对氨氧化菌活性的影响,并确定络合物中适宜的Cu2+浓度,并以此浓度为基准,按照MA:Cu2+(摩尔比)为1∶1和2∶1确定其中MA的浓度分别为23.6 mg/L和47.2 mg/L,分别测定对应MA浓度下的硝化菌活性(硝化速率)和聚磷菌活性(聚磷菌厌氧释磷好氧吸磷速率),最后按照摩尔比为1∶1、2∶1和1∶2的络合比配制不同的MA-Cu2+,并确定其对硝化菌和聚磷菌活性的影响.
1.1 分析项目和方法
本试验中的常规项目如氨氮、亚硝氮、硝氮、磷酸盐等分析方法,参考《水和废水监测分析方法》[13].
1.2 活性污泥硝化速率的测定
活性污泥硝化速率的测定包括比氨氧化速率(specific ammonia utilizing rate,SAUR)和亚硝酸盐氧化速率(specific nitrite utilizing rate,SNUR)的测定.试验用活性污泥取自西安市第五污水处理厂生物反应池末端,取得的活性污泥在2 h内沉淀后倒去上清液,自来水淘洗一次,纯水淘洗一次后将活性污泥浓缩或稀释到适宜浓度(3 000~4 000 mg/L),通过水浴将活性污泥混合液温度调整至20±1 ℃,通过添加NaHCO3将pH控制在7~8,DO控制在3 mg/L以上,通过测定NH4+-N和NO2--N的消耗确定SAUR和SNUR,起始基质(NH4+-N和NO2--N)浓度分别为30 mg/L和20 mg/L,取样时间间隔为10 min,SAUR和SNUR的线性回归系数R2>0.97.
1.3 活性污泥释磷吸磷速率的测定
聚磷菌活性的测定包括厌氧释磷速率、好氧吸磷速率.批式试验开始前向活性污泥混合液中加入磷酸盐,使得混合液中磷酸盐浓度为 10 mg/L,曝气1 h使活性污泥充分吸磷,同时适应试验环境,然后用自来水淘洗两次后加入蒸馏水,使活性污泥混合液达到一定浓度(3 000~4 000 mg/L)后进行后续试验,试验温度控制在 20±1 ℃, pH控制在 7.0±0.5.具体测定步骤如下:
厌氧释磷速率:厌氧试验过程中冲入氮气以保证厌氧环境,磁子搅拌,以乙酸钠作为碳源,起始浓度为 50 mg COD/gVSS,厌氧释磷试验时间为2 h,前1 h取样间隔时间为10 min,后1 h取样间隔时间为20 min,样品经过滤后测定磷酸盐的浓度.厌氧试验结束后,进行好氧吸磷试验.
好氧吸磷速率:向进行好氧吸磷试验的装置中通入氧气,按照厌氧释磷的取样时长和取样间隔时间进行取样测定磷酸盐浓度.
2 结果与讨论
2.1 铜离子对活性污泥氨氧化菌活性的影响分析
不同Cu2+浓度对氨氧化速率的影响如图1所示.由图1可知,随着Cu2+浓度的增加,氨氧化速率先增加后减小.

图1 不同浓度Cu2+对氨氧化速率的影响
当Cu2+浓度从0 mg/L增加到4 mg/L时, SAUR从3.9 mg NH4+-N/(gVSS·h)增加到5.75 mg NH4+-N/(gVSS·h),提高了32.1%,并达到最大值.当Cu2+浓度继续增加时,氨氧化菌活性持续下降,当Cu2+浓度达到18 mg/L时,SAUR下降到2.19 mg NH4+-N/(gVSS·h),较之对照,SAUR下降了43.9%.即Cu2+对氨氧化菌的活性存在明显的“低促高抑”现象,这与Brown C A等[7]和Dobson R L M等[8]的研究结果相似.另外,从图中还可直观地看出,Cu2+浓度接近12 mg/L时,硝化菌活性接近空白组,因此本试验选定的最适Cu2+浓度为12 mg/L.
2.2 三聚氰胺对活性污泥硝化菌活性的影响
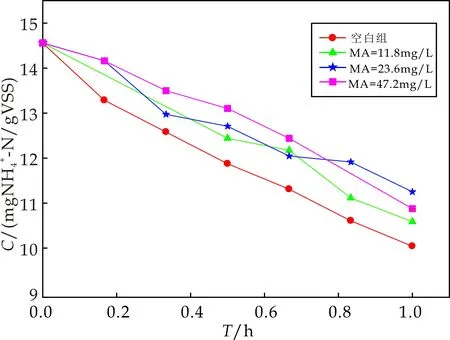
传统的硝化过程分为两步,第一步是氨氮在氨氧化菌的作用下氧化为亚硝氮,第二步是亚硝氮在亚硝酸盐氧化菌的作用下氧化为硝氮.分别创造适宜两类功能菌,即氨氧化菌和亚硝酸盐氧化菌氧化底物的条件,并测定底物随时间降解的速率即可得到两类微生物的活性,即SAUR和SNUR,统称为硝化速率.图2为不同浓度MA条件下的氨氮和亚硝氮浓度随时间变化曲线.
(a)不用浓度MA条件下氨氮随时间变化曲线

(b)不用浓度MA条件下亚硝氮随时间变化曲线图2 不同浓度MA条件下的氨氮和亚硝氮浓度随时间变化曲线
图2(a)为不同浓度MA条件下的氨氮浓度随时间变化曲线.由图2(a)可知,随着MA浓度的增加,SAUR逐渐降低,较之对照,分别下降了8.1%、23.8%、26.4%,因此,MA对氨氧化菌的活性有一定的抑制作用.
图2(b)为不同浓度MA条件下亚硝氮浓度随时间变化的曲线.由图2(b)可知,随着MA浓度的增加,SNUR有所下降,较之对照,分别下降了4.8%、6.3%和16.9%.由此可见,MA对亚硝酸盐氧化菌的活性的影响较氨氧化菌小.因此,MA对硝化菌活性的抑制主要体现在对氨氧化菌的影响上.Shangnan Xu等[11]认为长时间的适应并不能诱导活性污泥微生物产生具有降解MA功能的酶.Hongxue An等[12]的研究结果与本研究相似,即高浓度的MA对活性污泥微生物有毒害作用.
2.3 不同浓度三聚氰胺和铜络合物对硝化菌活性的影响
如上所述,在Cu2+浓度一定的条件下,本实验分别测定了MA∶Cu2+为1∶1、1∶2和2∶1三个不同摩尔比下的氨氮和亚硝氮浓度随时间变化的曲线,其结果具体如下:
图3为MA-Cu2+不同络合比条件下的氨氮浓度随时间变化曲线.由图3可知,较之对照,随着MA-Cu2+络合物的加入,SAUR和SNUR均有所下降.

(a)MA-Cu2+不同络合比条件下氨氮随时间变化曲线

(b)MA-Cu2+不同络合比条件下亚硝氮随时间变化曲线图3 MA-Cu2+不同络合比条件下氨氮和亚硝氮浓度随时间变化曲线
图3(a)为MA-Cu2+不同络合比条件下氨氮浓度随时间变化曲线.由图3(a)可知,MA-Cu2+络合物对SAUR的总体趋势有较大的影响,这说明络合物对氨氧化菌的活性有明显的抑制作用,其中络合比为1∶2时的抑制作用最大,可使得SAUR下降60.2%.较之对照,MA-Cu2+络合物对SNUR的影响较小,如图3(b)所示,络合物的加入使得SNUR最大下降比例为5.8%.
为进一步分析Cu2+、MA和MA-Cu2+对硝化菌活性的影响,将不同批式实验的数据进行对比,如图4所示.

(a)Cu2+、MA和MA-Cu2+对氨氧化菌活性的影响
由图4(a)中Cu2+、MA和MA-Cu2+对氨氧化菌活性的影响可知,12 mg/L的Cu2+暴露下,SAUR为3.9 mg NH4+-N/(gVSS·h),Cu2+浓度不变,络合不同比例的MA(1∶1和2∶1)后,SAUR分别为2.26 mg NH4+-N/(gVSS·h)和1.85 mg NH4+-N/(gVSS·h),即络合物对氨氧化菌活性的抑制效应较单一Cu2+的强.同样,由相同浓度的MA与对应的络合物对氨氧化菌活性的影响可知,络合物对氨氧化菌活性的抑制效应较单一MA强.因此,MA和Cu2+的络合使得其对氨氧化菌的毒性增加,表现出毒性协同效应.
图4(b)为MA和MA-Cu2+络合物的对亚硝酸盐氧化菌活性的影响.由图4(b)可知,向活性污泥体系中加入不同浓度的MA(即11.8 mg/L,23.6 mg/L和47.2 mg/L),对应的亚硝酸盐氧化速率分别为3.95 mg NO2--N/(gVSS·h)、3.89 mg NO2--N/(gVSS·h)和3.45 mg NO2--N/(gVSS·h),对应MA浓度下向活性污泥体系中加入MA-Cu2+络合物(络合比1∶1、1∶2和2∶1),对应的亚硝酸盐氧化速率分别为3.91 mg NO2--N/(gVSS·h)、4.21 mg NO2--N/(gVSS·h)和4.0 mg NO2--N/(gVSS·h),即络合物对亚硝酸盐氧化菌活性的抑制作用较小,甚至还有促进作用,因此,MA和Cu2+的络合使得其对亚硝酸盐氧化菌Cu2+暴露有一定的解毒作用.
2.4 三聚氰胺及三聚氰胺和铜络合物对聚磷菌活性的影响
2.4.1 不同浓度三聚氰胺对聚磷菌活性的影响
图5为不同浓度MA对聚磷菌活性的影响.由图5可知,空白组的厌氧释磷和好氧吸磷速率分别为1.85 mg PO43--P/(gVSS·h)和1.33 mg PO43--P/(gVSS·h),向活性污泥体系中加入不同浓度的MA(即11.8 mg/L、23.6 mg/L和47.2 mg/L),对应的厌氧释磷速率和好氧吸磷速率分别为1.72 mg PO43--P/(gVSS·h)和0.86 mg PO43--P/(gVSS·h),1.6 mg PO43--P/(gVSS·h)和0.44 mg PO43--P/(gVSS·h),1.09 mg PO43--P/(gVSS·h)和0.27 mg PO43--P/(gVSS·h).即随着MA浓度的增加,其厌氧释磷速率逐渐下降,较之对照,分别下降了5.4%、11.9%和39.5%,好氧吸磷速率分别下降了35.3%、66.9%、79.7%.可见,MA对好氧吸磷的影响大于对厌氧释磷过程的影响.梁洁的研究结果表明MA会对聚磷菌厌氧释磷好氧吸磷过程产生抑制作用,抑制的原因在于MA对除磷过程关键酶活性的抑制[14].对揭示本研究的实验现象有一定的借鉴.
此外,随着活性污泥体系中MA浓度的增加,在厌氧一小时后观察到聚磷菌吸磷的现象,厌氧段的最大释磷量也出现了大幅度降低的现象,具体原因,有待于进一步研究.
2.4.2 不同比例三聚氰胺和铜络合物对聚磷菌活性的影响
图6是MA-Cu2+不同络合比条件下对聚磷菌活性的影响.由图6可知,络合物对聚磷菌厌氧释磷和好氧吸磷过程均有不利影响.
将单一MA和MA-Cu2+络合体系对应数据进行对比分析可知,MA-Cu2+络合物对聚磷菌厌氧释磷和好氧吸磷的抑制作用均大于单纯的MA体系,络合体系对好氧吸磷过程的影响会随着MA浓度的增加逐渐减弱.
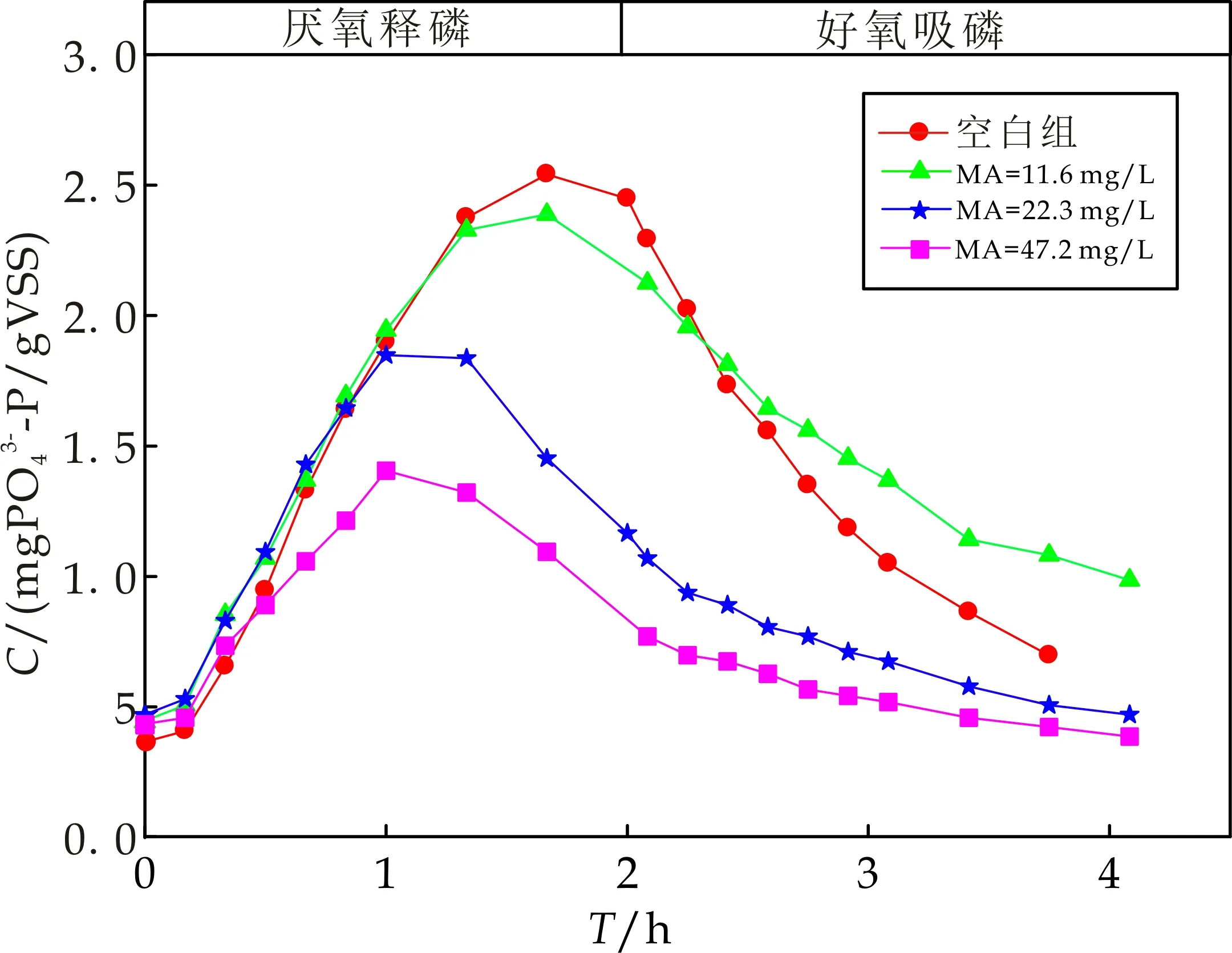
图5 不同浓度MA条件下磷酸盐浓度随时间变化曲线

图6 不同络比条件下磷酸盐浓度随时间变化曲线
3 结论
(1)Cu2+对活性污泥中氨氧化菌的活性表现出明显的“低促高抑”现象,当溶液中Cu2+浓度为4 mg/L时,氨氧化菌活性可以提高30%以上.
(2)MA对硝化菌活性具有明显的抑制作用,相同浓度条件下,MA对氨氧化菌活性的抑制作用较亚硝酸盐氮氧化菌强.
(3)MA-Cu2+络合物对硝化菌活性的影响主要表现在对氨氧化菌活性的抑制上.同时,络合物的形成较单一Cu2+和MA体系对氨氧化菌抑制作用更强,对亚硝酸盐氧化菌的影响较单一MA体系弱.
(4)MA对聚磷菌厌氧释磷和好氧吸磷均表现出明显的抑制,其中MA对好氧吸磷的抑制作用较厌氧释磷强.MA-Cu2+络合物对聚磷菌活性的抑制作用较单独MA体系强.
