金银花多糖的组成成分与抗氧化活性
2019-07-03刘红萍龙源元杨婉羚
刘红萍,赵 琳,龙源元,杨婉羚,李 燕,黄 健,闵 迅,张 涛*
(1.遵义医科大学 检验医学院,贵州 遵义 563006;2.遂宁市中心医院 医学检验科,四川 遂宁 629000)
金银花(Lonicerajaponica)为忍冬科忍冬属植物忍冬干燥的花蕾和待初开的花,主要分布于贵州、河南、山东和湖北等地,其经济、食用及药用价值较高,属药食同源植物。金银花作为历史悠久的中草药,在神农本草经中被列为上品,其具有抗病毒、抗肿瘤、提高免疫及抗氧化等诸多功效[1-2],其药物活性成分主要是多糖、挥发油类、有机酸类和三萜皂苷类等物质[3-5]。多糖作为植物中的一种重要生物大分子,具有抗氧化、免疫调节、抗肿瘤和抗病毒等多种功能[6-8]。但是,到目前为止,关于金银花多糖抗氧化活性方面的研究仅仅停留在金银花粗多糖或总糖上。周立等[9]通过优化金银花多糖的复合酶法提取工艺,仅评价了金银花总糖的抗氧化活性。向佳兰等[10]采用响应曲面法优化了超声提取金银花总糖的条件,也仅研究了金银花总糖的抗氧化活性。李尔春[11]虽然尝试对金银花总糖进行了分离纯化,但对于金银花多糖抗氧化活性方面的研究也仅局限于金银花总糖。目前,金银花总糖中主要抗氧化活性多糖组分尚不明确,阻碍了金银花多糖结构及抗氧化活性的深入研究。鉴于此,通过沸水煮提、乙醇醇沉并联合采用DEAE-纤维素柱层析和凝胶排阻色谱对金银花粗多糖(LJP)进行分离纯化,最后采用单因素试验研究金银花多糖对4种氧化剂的体外抗氧化作用,旨在为金银花多糖的综合开发和利用提供试验数据支撑。
1 材料与方法
1.1 供试材料
1.1.1 金银花 购于贵州省遵义市绥阳县市场。
1.1.2 试剂 维生素C、磷酸二氢钠、磷酸氢二钠、氯化钠、FeSO4和水杨酸,购于国药集团;间羟基联苯、氨基磺酸、1,1-二苯基-2-三硝基苯肼,1-苯基-3-甲基-5-吡唑啉酮(PMP)均购于Sigma,以上试剂均为分析纯。称量磷酸二氢钠4.992 3 g和磷酸氢二钠17.906 g,用超纯水定溶于820 mL,配制pH 7.0 0.1 mol/L的PBS溶液。称量PMP 4.355 g,用无水甲醇定溶于50 mL,配制0.5 M的PMP甲醇溶液。
1.1.3 仪器与设备 723型可见分光光度计,上海光谱仪器有限公司;FA1004C电子天平,上海越平科学仪器有限公司;冷冻干燥器,北京松源华兴科技发展有限公司;电热恒温水浴锅,上海一恒科学仪器有限公司;BT100MH创锐蠕动泵,保定创锐泵业有限公司;BS-100A自动部分收集器,上海沪西分析仪器厂有限公司;Waters e2695配备2489型紫外检测器,美国沃特世公司;Cl-型 DEAE-纤维素离子交换柱(2.6 cm×50 cm),上海化学试剂厂;Tensor 27布鲁克傅里叶红外光谱仪,德国布鲁克公司。
1.2 试验方法
1.2.1 金银花粗多糖的提取与分离纯化
1)提取。参照图1制备流程,称取干燥金银花500 g,置于装有14 L蒸馏水的容器中,100℃煮提4 h,过滤;向残渣中再加入8 L蒸馏水煮提3 h,过滤;向残渣中再加入6 L蒸馏水煮提2 h,过滤。合并3次滤液并浓缩至约600 mL,4 000 r/min离心10 min,收集上清液并加入1 800 mL无水乙醇,静置过夜。次日,4 000 r/min离心10 min,收集沉淀并冻干即得金银花粗多糖。分别采用苯酚-硫酸法、间羟基联苯法和考马斯亮蓝法分析金银花粗多糖中糖、糖醛酸和蛋白质的含量[9]。
2)分离纯化。称取2 g金银花粗多糖溶于20 mL蒸馏水中,上样于DEAE-纤维素离子交换柱。依次用600 mL的去离子水和600 mL 0.5 M NaCl溶液进行洗脱,流速2 mL/min,每20 mL洗脱液收集1管。采用苯酚-硫酸法和间羟基联苯法分别检测洗脱液中糖和糖醛酸的含量。以洗脱管数为横坐标,吸光度为纵坐标绘制洗脱曲线[9]。根据洗脱曲线收集相应的洗脱液,透析除盐后冻干备用。

图1 金银花粗多糖的制备流程Fig.1 Preparation flow chart of crude L.japonica polysaccharide
1.2.2 金银花多糖组成成分分析
1)单糖组成。将2 mg金银花多糖置于水解瓶中,加入1.0 mL 2 M 盐酸甲醇,于80℃反应16 h;氮气吹干后加入1.0 mL 2 M 三氟乙酸溶液,于120℃水解1 h;将水解产物转移至蒸发皿中,加入适量的无水乙醇,蒸干。向蒸干的水解产物中加入0.5 mL PMP和0.5 mL 0.3 M NaOH溶液,70℃反应30 min;再加入0.5 mL 0.3 M HCl溶液及0.9 mL氯仿萃取未反应的PMP;最后用0.22 μm滤膜过滤,过滤后的得到衍生化产物滤液待HPLC分析。HPLC分析条件:采用Waters e2695配备2489型紫外检测器,Dikma Platisil ODS色谱柱(4.6×250 mm,5 μm),乙腈∶PBS=18.2∶81.8(V/V),流速1.0 mL/min,柱温35℃[12]。
2)多糖各组分的均一性及分子量检测。分别称取金银花各多糖组分10 mg,溶于0.1 M NaCl溶液,经0.22 μm滤膜过滤后,上样于Sepharose CL-6B柱进行层析分析,洗脱液为0.1 M NaCl水溶液,流速为0.15 mL/min。标准品右旋葡聚糖系列(平均分子量为0.18 kDa、10 kDa、50 kDa、100 kDa、800 kDa和2 000 kDa)。以上述标准聚糖分子量的常用对数为纵坐标,相应的保留时间为横坐标绘制标准曲线。根据标准曲线及金银花多糖的保留时间计算金银花各多糖组分的平均分子量。
3)多糖各组分的红外光谱检测。中草药多糖的药理活性与多糖结构的关系密切,为探索金银花多糖不同级分的基本结构的差异,采用傅里叶变换红外光谱对金银花多糖的基本结构进行分析。称取充分干燥后的金银花多糖样品约2 mg与KBr(溴化钾)粉末约100 mg混匀后研磨压片,置于傅里叶变换红外光谱仪内,常温下扫描400~4 000 cm-1的波长区间,记录数据并分析。
1.2.3 金银花多糖各组分的抗氧化活性
1)对DPPH的清除能力。分别将金银花多糖各组分溶于蒸馏水中,配成不同浓度的溶液(0、0.25 mg/mL、0.5 mg/mL、1.0 mg/mL、2.0 mg/mL和4.0 mg/mL)。取各浓度溶液2 mL分别与2 mL DPPH甲醇溶液(0.2 mM)混合,避光孵育20 min。以去离子水为空白对照,抗坏血酸为阳性对照,于517 nm处测定各管的吸光度,3次重复。计算金银花多糖各组分的DPPH清除率(Y1)。
Y1=[1-(A1-A2)/A0]×100%
式中,A1为样品与DPPH溶液反应后在517 nm处的吸光值,A2为甲醇与样品溶液反应后在517 nm处的吸光值,A0为去离子水与DPPH溶液反应后在517 nm处的吸光值[13]。
2)对羟基自由基的清除能力。将金银花多糖溶于蒸馏水中,配成系列浓度的溶液(0、0.25 mg/mL、0.5 mg/mL、1.0 mg/mL、2.0 mg/mL和4.0 mg/mL)。上述多糖溶液各取0.5 mL,与0.5 mL H2O2(8.8 mM)、0.5 mL FeSO4溶液(9 mmol/L)和0.5 mL水杨酸-乙醇溶液(9 mmol/L)混合,于37℃水浴0.5 h。以去离子水作空白对照,于510 nm处测定各管的吸光度,3次重复。计算金银花多糖各组分对羟基自由基的清除率(Y2)。
Y2=[1-(A1-A2)/A0]×100%
式中,A0为去离子水作空白对照的吸光值,A1为多糖样品反应后的吸光值,A2为去离子水代替H2O2作为多糖的本底对照的吸光值[13]。
3)对ABTS的清除能力。用蒸馏水配制2.6 mmol/L过硫酸钾,用过硫酸钾配制7.4 mmol/L ABTS储备液,室温避光,静置过夜,用时取储备液用蒸馏水稀释29.33倍。将金银花多糖各组分溶于蒸馏水中,配成系列浓度的溶液(0、0.125 mg/mL、0.25 mg/mL、0.5 mg/mL、1.0 mg/mL、2.0 mg/mL和4.0 mg/mL)。在反应体系中加入上述不同浓度多糖溶液0.1 mL及1 mL ABTS测定液,室温避光6 min。以蒸馏水代替样本作参比测定吸光值(A0),以蒸馏水代替ABTS测定液作为多糖的本底吸光值(A2),在734 nm处测定各多糖的吸光值(A1),3次重复。计算金银花多糖各组分对ABTS的清除率(Y3)。
Y3=[1-(A1-A2)/A0]×100%
4)对H2O2诱导红细胞氧化性溶血的抑制作用。将金银花多糖各组分溶于生理盐水中,配成系列浓度的溶液(0、0.125 mg/mL、0.25 mg/mL、0.5 mg/mL、1.0 mg/mL和2.0 mg/mL)。在反应体系中加入0.5% RBC悬浮液0.5 mL,不同浓度多糖溶液0.5 mL,最后加入0.1 mol/L H2O2溶液0.5 mL,混匀,37℃水浴60 min,用生理盐水稀释2倍,3 000 r/min离心10 min,取上清液于415 nm处测定吸光值(A)。正常组以生理盐水代替样本和H2O2,模型组以生理盐水代替样本,3次重复。计算金银花多糖各组分对RBS溶血的抑制率(Y4)。
Y4=(A模型组-A样本组)/(A模型组-A正常组)×100%
1.3 数据统计与分析
采用GraphPad Prism 6进行数据统计与分析。
2 结果与分析
2.1 金银花多糖的制备、分离与纯化
经水煮、乙醇醇沉和冻干等步骤,500 g金银花共提取到黄棕色的金银花粗多糖26.5 g,提取率为5.3%。金银花粗多糖中糖含量为78.0%,糖醛酸含量为40.0%,蛋白质含量为5.2%。从图2可见,金银花粗多糖经DEAE-纤维素柱层析分离纯化得到1个去离子水洗脱的中性糖级分LJP-N和1个0.5 M NaCl洗脱的酸性糖级分LJP-A,分别占粗多糖的33.0%和54.1%。

图2 金银花多糖经DEAE 纤维素柱层析分离纯化的洗脱曲线Fig.2 Elution curve of L.japonica polysaccharide purified by DEAE-cellulose column chromatography
2.2 金银花多糖的组成成分
2.2.1 单糖组成 从图3看出,金银花粗多糖主要由GalA(56.0%)、Ara(16.6%)、Glc(12.5%)、Gal(11.4%)和Rha(1.2%)构成;中性糖级分LJP-N主要由Glc(43.7%)、Gal(25.1%)和Ara(31.2%)构成,表明,LJP-N主要由淀粉样葡聚糖和阿拉伯半乳聚糖组成,无酸性糖成分;酸性糖级分LJP-A主要含有GalA(82.1%)、Gal(7.1%)和Ara(10.8%),表明,LJP-A主要由同型聚半乳糖醛酸以及少量的阿拉伯半乳聚糖组成,Gal和Ara通过共价键连接在GalA构成的主链上,随着同型聚半乳糖醛酸一起被0.5 M NaCl洗脱下来。此外,LJP-N和LJP-A的单糖组成也表明DEAE-纤维素柱层析成功地将金银花粗多糖分成了中性糖级分和酸性糖级分,分离纯化效果较好。
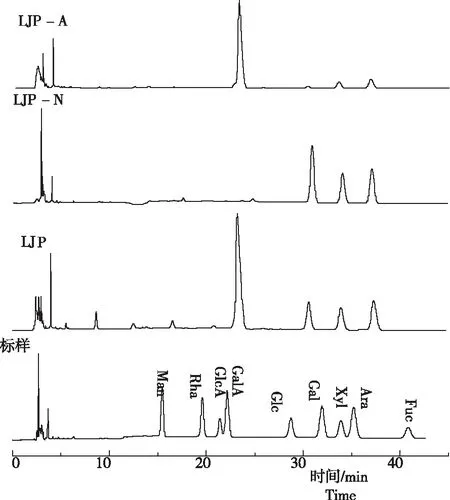
注:Man,甘露糖;Rha,鼠李糖;GlcA,葡萄糖醛酸;GalA,半乳糖醛酸;Glc,葡萄糖;Gal,半乳糖;Xyl,木糖;Ara,阿拉伯糖;Fuc,岩藻糖。
Note:Man,mannose;Rha,rhamnose;GlcA,glucuronic acid;GalA,galacturonic acid;Glc,glucose;Gal,galactose;Xyl,xylose;Ara,arabinose;Fuc,fucose.
图3金银花多糖的单糖组成
Fig.3 Monosaccharide composition ofL.japonicapolysaccharide
2.2.2 多糖的分子量 从图4看出,金银花多糖级分LJP-N和LJP-A的分子量均一性均良好;根据图4显示LJP-N和LJP-A的吸光度计算得出,LJP-N的平均分子量为6 kDa,LJP-A的为400 kDa,是LJP-N的67倍。表明,分子量较大的酸性糖级分是金银花粗多糖的主要成分。
2.2.3 多糖的红外光谱分析 从金银花多糖级分LJP-N和LJP-A的傅里叶变换红外光谱检测结果(图5)看出,3 400 cm-1附件的响应值对应于羟基的伸缩振动峰,2 946 cm-1附件的响应值对应于CH2的C-H的伸缩振动峰,1 630 cm-1附件的响应值对应于羟基的弯曲振动吸收峰,1 413 cm-1附件的响应值对应于C-H的变形吸收峰,1 070 cm-1附件的响应值对应于β-Gal的羟基变角振动特征峰,1 049 cm-1附件的响应值对应于α-Ara的羟基变角振动特征峰,920 cm-1和833 cm-1对应于α-Glc的特征吸收峰。表明,金银花中性糖级分LJP-N主要由淀粉样葡聚糖和阿拉伯半乳聚糖构成。1 742 cm-1附件的响应值对应于羰基的非对称伸缩振动,1 619 cm-1附件的响应值对应于羰基的对称伸缩振动,1 101 cm-1和1 019 cm-1附件的响应值对应于糖醛酸的特征吸收峰。表明,金银花酸性糖级分LJP-A主要由同型聚半乳糖醛酸构成。上述结果均分别与二者单糖组成的结果相吻合,进一步验证了LJP-N主要含有淀粉样葡聚糖和阿拉伯半乳聚糖,LJP-A主要含有聚半乳糖醛酸。

注:Vo,外水体积;Vt,总体积。
Note:Vo,external water volume;Vt,total volume.
图4金银花多糖级分 LJP-N和 LJP-A于 Sepharose CL-6B上的洗脱曲线
Fig.4 Elution curves ofL.japonicapolysaccharide fractions LJP-N and LJP-A on Sepharose CL-6B

图5金银花多糖级分 LJP-N和 LJP-A的红外光谱
Fig.5 Infrared spectra ofL.japonicapolysaccharide fractions LJP-N and LJP-A
2.4 金银花多糖的抗氧化活性
从图6看出金银花粗多糖及其各子级分的抗氧化活性。
2.4.1 对DPPH的清除能力 金银花多糖级分LJP-N和LJP-A均具有明显清除DPPH自由基的能力,二者随着浓度的增加,活性逐渐增强,呈现一定的浓度依赖性。当LJP-A的浓度增至2 mg/mL时,其对DPPH自由基的清除能力接近于抗坏血酸,EC50约为0.58 mg/mL。LJP-N的活性较LJP-A弱,当其浓度增至4 mg/mL时,清除能力也未达80%,EC50约为2.23 mg/mL。
2.4.2 对羟基自由基的清除能力 金银花多糖级分LJP-N和LJP-A均具有清除羟基自由基的能力,但均明显弱于抗坏血酸。LJP-A随着浓度的增加,活性也逐渐增强,呈现一定的浓度依赖性,当其浓度增加至4 mg/mL,其对羟基自由基的清除率约为60%,EC50约为3.61 mg/mL。LJP-N的活性较LJP-A弱,当其浓度增加至4 mg/mL时,其对羟基自由基的清除率<20%。
2.4.3 对ABTS的清除能力 金银花多糖级分LJP-A均具有较强地清除ABTS自由基的能力。LJP-A随着浓度的增加,活性逐渐增强,呈现明显的浓度依赖性,当其浓度增至4 mg/mL时,其活性已趋近于抗坏血酸的活性,其EC50约为1.4 mg/mL。LJP-N的活性较LJP-A弱,当其浓度增至4 mg/mL时,其对羟基自由基的清除率不足40%。
2.4.4 对H2O2诱导红细胞氧化性溶血的抑制作用 金银花多糖级分LJP-N和LJP-A对H2O2诱导红细胞氧化性溶血均具有较强的抑制作用,且二者随浓度的增加,活性也逐渐增强,呈现一定的浓度依赖性。当LJP-A的浓度≥0.25 mg/mL时,其活性相当于抗坏血酸的活性,EC50约为0.1 mg/mL。LJP-N的活性较LJP-A弱,但其浓度增至2 mg/mL时,其抑制率>80%,对H2O2诱导红细胞氧化性溶血展现出较强的抑制作用,其EC50约为0.25 mg/mL。
综上所述,LJP-A和LJP-N对DPPH均具有良好的清除能力,且二者对H2O2诱导红细胞氧化性溶血具有较好的抑制作用,这可能和LJP-N和LJP-A中含有较多的阿拉伯半乳聚糖密切相关;而酸性糖组分LJP-A对羟基自由基和ABTS自由基的清除能力明显强于中性糖组分,且呈现一定的浓度依赖性,推测可能是由于LJP-A中含量较高的半乳糖醛酸发挥了重要作用。说明金银花多糖中中性糖组分和酸性糖组分在抗氧化的机制方面存在差异,金银花多糖可以通过多种途径发挥抗氧化的作用。金银花多糖的不同级分表现出不同的体外抗氧化活性。综合运用上述4种氧化剂检测方法从不同角度系统评价了金银花的抗氧化活性,避免了单一抗氧化方法评价抗氧化活性的片面和不足,可为金银花多糖在天然抗氧化剂方面的研究和综合开发利用奠定数据基础。
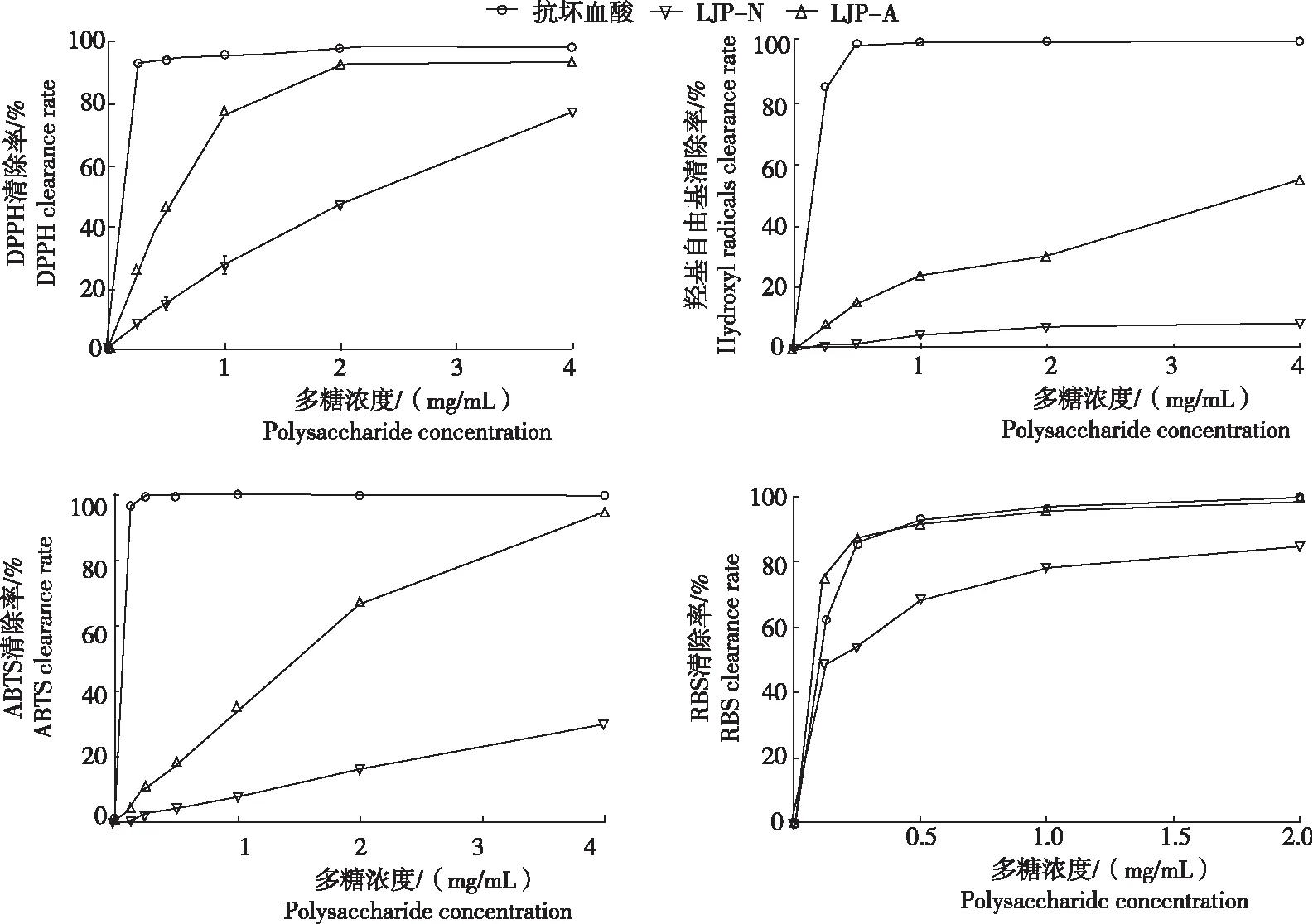
图6 金银花多糖组分 LJP-N和LJP-A 的体外抗氧化活性Fig.6 Antioxidant activity in vitro of L.japonica polysaccharide fractions LJP-N and LJP-A
3 结论与讨论
通过热水煮提制备金银花粗多糖LJP,随后采用DEAE-纤维素柱层析联合分子筛Sepharose CL-6B对LJP进行分离纯化得到1种中性糖组分LJP-N和1种酸性糖组分LJP-A,前者可能为淀粉样葡聚糖和阿拉伯半乳聚糖组成的混合物,平均分子量约为6 kDa;后者可能为同型聚半乳糖醛酸以及少量的阿拉伯半乳聚糖组成的混合物,平均分子量约为400 kDa。通过检测金银花多糖各组成成分对DPPH、羟基自由基和ABTS的清除能力和对H2O2诱导红细胞氧化性溶血的抑制作用,综合分析了LJP-N和LJP-A的体外抗氧化活性,其中,LJP-A对DPPH、羟基自由基和ABTS均具有良好的清除能力,而LJP-N仅对DPPH自由基具有较强的清除能力;LJP-A和LJP-N对H2O2诱导红细胞氧化性溶血均具有较好的抑制作用,且均呈现一定的浓度依赖性。推测,金银花多糖能够通过多种途径发挥自身的抗氧化作用。该研究结果将为金银花多糖开发具有抗氧化功能的药品或保健品提供试验基础,进而对金银花的深度开发和利用有一定的促进作用。
