黄芩苷在脂多糖(LPS)诱导的大鼠多器官急性损伤中的保护作用
2019-07-03马晓娟郝雪琴
汪 旭,张 鑫,马晓娟,郝雪琴
NOD样受体蛋白3 (nod-like receptor 3, NLRP3) 是一种多蛋白复合物,参与caspase-1依赖的白细胞介素IL-1样促炎细胞因子的释放。NLRP3通过组件组装成炎症小体结构激活,对损伤相关分子模式(damage-associated molecular patterns,DAMP)或病原体相关分子模式(pathogen-associated molecular patterns,PAMP)的细胞内识别,进而结合ASC(apoptosis speck-like protein)导致caspase-1的招募和自切割活化,促进细胞因子前体IL-1α,pro-IL-1β,IL-33和pro-IL-18的成熟和分泌[1]。DAMPs是宿主生物分子,它能引起非感染性炎症反应。相反,PAMPs引起病原体感染性炎症反应。细菌脂多糖(lipopolysaccharide,LPS)是革兰氏阴性杆菌细胞膜上发现的内毒素,被认为是一种典型的PAMPs[2]。据报道,微生物感染引起caspase-1依赖的抗菌反应触发炎症小体复合物的组装[3]。黄芩苷(Baicalin,BA)具有抗氧化、抗焦虑作用,广泛用于治疗感染性和炎性疾病,可以预防急性肝损伤、实验性牙周炎和败血症[4]。本研究采用LPS诱导大鼠炎症反应,探讨黄芩苷对肾、睾丸、脑、肺急性损伤的保护作用。现报道如下。
1 材料与方法
1.1 材料动物:40只Sprague-Dawley雄性大鼠购自华中科技大学同济医学院动物培养中心,动物许可证号:SCXK(鄂)2010-0007。试剂:IL-1β和IL-18 ELISA试剂盒(美国R&D Systems公司,RLB00);免疫组化SABC检测试剂盒(SA1020)、NLRP3抗体(BA3677)、DAB试剂盒(武汉博士德生物有限公司,AR1022)。仪器:全波长酶标仪(美国伯腾仪器有限公司,Epoch);轮转切片机(德国Leica公司,RM-2235);Carl Zeiss显微镜(苏州卡尔蔡司有限公司,Axio Scope A1)。
1.2 分组、造模及给药动物在室温(24±1) ℃和12 h的黑暗条件下自由进食实验大鼠标准饲料和纯净水。适应2周后,40只大鼠随机分为5组,每组8只,分别为对照组、LPS组、黄芩苷40 mg组、黄芩苷80 mg组和黄芩苷160 mg组。LPS组大鼠第1、3、5 d腹腔注射LPS 0.79 mg·kg-1;黄芩苷组大鼠第1、3、5 d腹腔注射LPS 0.79 mg·kg-1,然后分别给予黄芩苷40、80和160 mg·kg-1,连续灌胃7 d;对照组大鼠灌胃生理盐水[5]。第12天采集样本。本研究得到河南科技大学当地动物伦理委员会的批准。
1.3 血清IL-1β和IL-18浓度的测量用戊巴比妥(40 mg·kg-1)麻醉大鼠。取腹主动脉血,置于室温30 min,然后3 000 r·min-1离心15 min,取上清。分别使用大鼠IL-1β和IL-18 ELISA试剂盒测量血清IL-1β和IL-18的浓度,使用酶标仪读取数据。
1.4 组织形态改变大鼠经0.9% NaCl和4%多聚甲醛全身灌注后,收集肾脏、睾丸、脑组织和肺组织,4%多聚甲醛溶液中浸泡48 h,脱水后石蜡包埋;4 μm组织切片进行HE染色,光镜下观察肾脏、睾丸、脑组织和肺组织的形态学变化。
1.5 NLRP3免疫组化肾、睾丸、脑和肺组织在4%多聚甲醛中浸泡24 h,石蜡包埋。切片(4 μm)在PBS中冲洗5 min,然后进行免疫组化染色,使用免疫组化过氧化物酶检测试剂盒检测。使用DAB试剂盒观察过氧化物酶活性。采用Image-pro plus软件定量计算每组图片中NLRP3蛋白的表达 (integral optical density,IOD)。

2 结果
2.1 黄芩苷对IL-18和IL-1β的影响LPS 组血清IL-1β和IL-18浓度高于对照组;黄芩苷40 mg组和黄芩苷80 mg组与LPS组相比无显著性差异;与LPS组相比,黄芩苷160 mg组血清IL-1β和IL-18浓度较低。黄芪苷治疗可减轻LPS诱导的大鼠血清IL-1β和IL-18浓度。见表1。
表1 黄芩苷对IL-18和IL-1β的影响
注:①与对照组相比较,P<0.05;②与LPS组相比较,P<0.05。
2.2 黄芩苷对大鼠肾脏形态学变化的影响与对照组相比,LPS组的肾小囊间隙增大,肾间质炎症细胞浸润;黄芩苷160 mg组肾小囊腔有所改善,肾间质未见明显炎症细胞浸润。黄芪苷治疗可减轻LPS诱导的肾形态学损伤。
2.3 黄芩苷对大鼠睾丸的影响与对照组相比,LPS组睾丸生精小管基底膜破坏,精原细胞与初级精母细胞之间的间隙增大,生精细胞的数量减少,排列不规则;黄芩苷160 mg组生精小管基底膜完整,生精细胞排列规则。黄芪苷治疗可以以剂量依赖性的方式缓解LPS诱导的睾丸损伤。
2.4 黄芩苷对大鼠脑的形态学变化的影响LPS组皮质神经元数量少于对照组,细胞排列混乱,无明显边界,在细胞核周围有很大的空泡,细胞核和细胞质染色较浅;黄芪苷80 mg组和160 mg组神经元细胞排列规则,脑细胞内未见明显大液泡。黄芩苷治疗可以以剂量依赖性的方式减轻LPS引起的脑损伤。
2.5 黄芩苷对大鼠肺的形态学变化的影响与对照组相比,LPS组肺泡壁肿胀、变厚,炎性细胞浸润,伴有间质组织充血、水肿;黄芩苷160 mg组肺泡壁无充血、水肿,未见明显炎细胞浸润。黄芩苷治疗可以剂量依赖性的方式缓解LPS诱导的肺损伤。
2.6 黄芩苷对NLRP3蛋白表达的影响NLRP3蛋白主要表达在肾小管上皮细胞的细胞质、睾丸的生殖细胞和精子的细胞核、大脑神经元的细胞质和肺泡上皮细胞的细胞质中。黄芩苷对大鼠各组织器官NLRP3蛋白表达的影响见表2。与对照组相比,LPS组肾、睾丸、脑、肺中NLRP3蛋白表达显著增加;黄芪苷(40、80或160 mg·kg-1)治疗可减少NLRP3蛋白在肾脏(图1)、睾丸(图2)、大脑(图3)和肺(图4)中的表达。
表2 黄芩苷对大鼠各组织器官NLRP3蛋白表达的影响
注:①与对照组相比较,P<0.05;与LPS组相比较,②P<0.05。
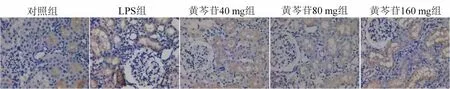
图1 黄芩苷减少LPS诱导的大鼠肾脏NLRP3蛋白的表达(SP,×400)
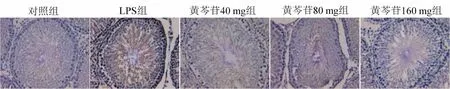
图2 黄芩苷减少LPS诱导的大鼠睾丸NLRP3蛋白的表达(SP,×400)
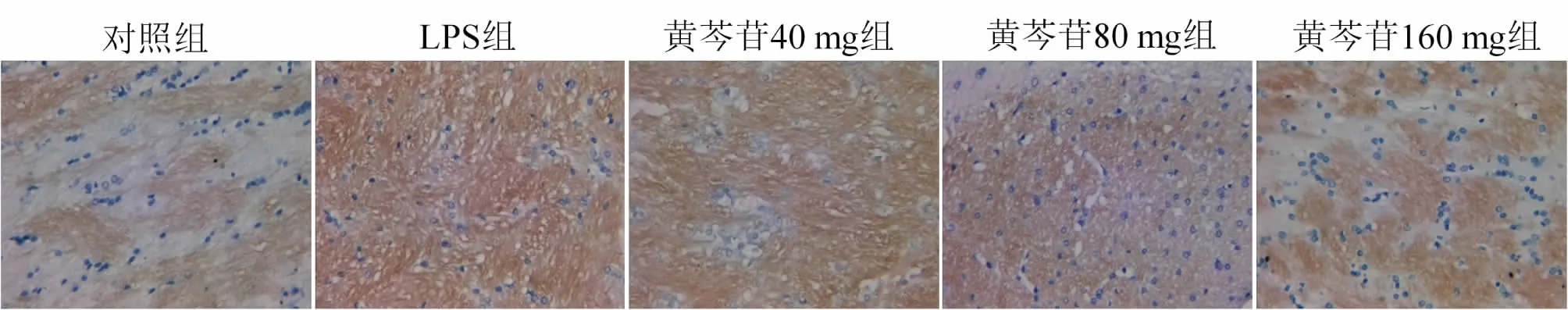
图3 黄芩苷减少LPS诱导的大鼠脑NLRP3蛋白的表达(SP,×400)

图4 黄芩苷减少LPS诱导的大鼠肺NLRP3蛋白的表达(SP,×400)
3 讨论
细菌脂多糖是革兰氏阴性杆菌细胞膜上发现的内毒素,细菌内毒素具有广泛的生物学活性,脂多糖是内毒素的毒性核心,也是细菌的主要致病因子。内毒素进入机体后,会对宿主细胞产生一定的毒性作用,引起机体多种急慢性炎症反应,对组织造成炎性损伤[6]。NLRP3在正常细胞中有表达,炎症刺激如LPS时激活,NLRP3炎性小体激活不当可导致多种疾病的进展[7-8]。新的研究表明,NLRP3炎性小体参与了肾脏炎症[9]、足细胞损伤和高同型半胱氨酸血症肾小球硬化的诱导[10];NLRP3可抑制睾丸类固醇的生成,扰乱精子生成,导致睾丸功能障碍[11];NLRP3的激活会导致LPS暴露动物的长期行为改变。NLRP3可直接或间接损伤肺泡上皮细胞和毛细血管内皮细胞[12]。
黄芩是一味常用的中药,它的有效部位是根部,黄芩的干燥根富含多种黄酮类化合物,可提取多种生物活性物质。黄芩苷是主要的活性成分,具有广泛的药理作用,黄芩苷具有抗氧化、抗炎作用[13-14]。研究表明,在副猪嗜血杆菌感染期间,黄芩苷呈剂量依赖性的方式抑制NLRP3炎症小体和NF-κB信号[8],可防止大鼠的睾丸蒂扭转。黄芩苷可能通过抗炎和抗凋亡机制减轻缺血导致的神经元细胞损伤。黄芩苷降低血脑屏障通透性,有效降低脑出血后脑水肿[15]。研究表明,黄芩苷可能会降低IL-1β的水平,减轻缺血再灌注引起的肾损伤[4]。此外,黄芩苷还能减轻空气栓塞所致急性肺损伤[12]。
本研究在大鼠腹腔注射LPS后,LPS组血清IL-18,IL-1β水平高于对照组,肾、睾丸、脑、肺中NLRP3蛋白表达均高于对照组,LPS组肾小囊腔增大,睾丸生精细胞减少,脑细胞内大液泡、肺泡壁肿胀、增厚。表明由于LPS炎症刺激诱导的NLRP3在大鼠多个器官的表达,IL-1β和IL-18炎性因子的释放,导致大鼠多个器官急性损伤。可能是NLRP3的表达增强了大鼠多个器官的炎性作用,从而使组织发生明显的形态学损伤。
黄芩苷治疗后IL-1β和IL-18 细胞因子水平和各组织器官中NLRP3的水平呈剂量依赖性地下降,其中黄芩苷160 mg组血清IL-18、IL-1β水平和肾、睾丸、脑、肺中NLRP3水平明显低于LPS组。黄芩苷160 mg组肾间质未见明显炎细胞浸润,睾丸生精小管基底膜完整,脑细胞内未见大液泡,肺泡壁无明显肿胀。提示黄芪苷在多个器官中抑制NLRP3的表达,并减少caspase-1依赖的IL-1β和IL-18 细胞因子的释放,以及随后的炎症反应,减缓了炎症刺激引起的组织损伤作用,有效地减轻组织形态损伤及病理学改变。因此,可以得出结论,黄芩苷能保护大鼠肾脏、睾丸、脑和肺免受LPS诱导的急性损伤,其机制可能与抑制NLRP3的表达有关。
