人参皂苷Rg2对慢性坐骨神经损伤大鼠痛觉敏化和抑郁状态的影响*
2019-07-03张巧莲李双英
张巧莲, 李双英, 李 平
(中国人民武装警察部队特色医学中心神经内科, 天津 3001062)
临床上慢性疼痛患者常常伴有抑郁症的发生,而部分抑郁症患者也有慢性躯体疼痛症状[1]。因此,疼痛与抑郁发生之间的关系成为近来研究关注的问题[2-4]。研究表明,慢性疼痛可以诱导出抑郁相关行为。目前神经痛的药物治疗仅能缓解症状,不能终止或逆转外周神经的损伤,并且剧烈的神经痛对药物的反应不佳,虽然有足够的资料支持阿片药物的有效性,可与最好的可用的抗抑郁药和抗惊厥药相媲美,但由于阿片类药物存在耐药性及成瘾性,因此对阿片药物治疗慢性神经病理性疼痛仍存在广泛争议。人参皂苷Rg2具有神经保护作用、抗缺血/再灌注损伤、抗凋亡和抗抑郁作用[5],本研究通过建立大鼠慢性坐骨神经损伤模型(chronic constriction injury, CCI),通过腹腔注射给予人参皂苷Rg2,观察药物对CCI大鼠反映痛觉敏感的指标机械性缩足反射阈值和热辐射缩足潜伏期以及反映焦虑、抑郁表现的指标明暗箱测试观察大鼠在明箱内时间、穿梭次数和强迫游泳实验观察大鼠游泳潜伏期、不动时间的影响,为神经病理性疼痛的临床治疗提供新方案。
1 材料与方法
1.1 材料
健康雄性SD 大鼠50只, 月龄(5~6) 月,体重(180~200) g,SPF级,出售单位为北京维通利华实验动物技术有限公司,实验动物质量合格证为SKXK(京)2016-0006。人参皂苷Rg2(吉林省中医中药研究院)。电针仪(山东省医学科学院设备厂,型号G6805-2);光照测痛仪(山东省医学科学院设备厂,型号YLS-12A),明暗箱(MK-Animex,型号DSE)。
1.2 慢性坐骨神经损伤模型[6]的建立
SD大鼠称重,用2%戊巴比妥钠生理盐水溶液腹腔注射3 ml/kg进行麻醉,用理发器剔除SD 大鼠右下肢毛发,碘酒消毒后,剪开皮肤,用玻璃分针充分暴露股后外侧坐骨神经干,在其分叉处开始,每间隔 1 mm,用 4 根 320 的铬制羊肠线轻度结扎坐骨神经,松紧度,以不影响坐骨神经干的血液供应为准,切口逐层缝合,然后用酒精将缝合皮肤表面血液擦拭干净,肌肉注射青霉素预防感染。假手术组大鼠除不结扎坐骨神经外,其余操作与模型组一致。手术结束后,大鼠进行单笼饲养,以防咬伤,正常饮水摄食。
1.3 动物分组及处理
50只大鼠随机分为5组(n=10):(1)正常对照组( Normal+生理盐水);(2)假手术组(Sham+生理盐水):(3)坐骨神经慢性压迫损伤组(CCI+生理盐水);(4)人参皂苷Rg2低剂量治疗组(CCI+Rg25 mg/kg);(5)人参皂苷Rg2高剂量治疗组(CCI+Rg210 mg/kg),生理盐水及Rg2均为腹腔注射。正常对照组和模型组腹腔注射等体积的生理盐水,每天1次,连续14 d。
1.4 观察指标
手术前1 d 和手术第14日首先检测各组大鼠的机械性缩足反射阈值、热缩足潜伏期,然后进行明暗箱测试、强迫游泳实验。手术后第 1、3、5、7、10日时检测各组大鼠的机械性缩足反射阈值、热缩足潜伏期。明暗箱测试观察大鼠在明箱内时间、穿梭次数;强迫游泳实验观察大鼠游泳潜伏期、不动时间。
1.4.1 机械性缩足反射阈值[7]测定 采用von Frey 细丝方法,将机械测痛仪放置在水平桌面上,实验室内温度控制在(25±1)℃,保持安静明亮的环境,实验开始前将SD大鼠放置在仪器的有机玻璃箱中距离桌面约30 cm的金属网架上,适应10 min开始测量。刺激大鼠足底部选用不同的Von Frey 细丝,折力由小到大,足底部中央刺激部位保持各组一致,观察大鼠缩足反应的时间,即机械性缩足反射阈值(mechanical withdrawal threshold, MWT),每次测量间隔2~3 min,取 3 次测量的平均值作为观察结果。
1.4.2 热缩足潜伏期[8]测定 采用光照辐射刺激痛觉测试仪,实验室内温度控制在(25±1)℃,仪器玻璃箱的温度控制在37℃,保持安静明亮的环境,实验开始前将SD大鼠进行环境预适应再开始实验,将光源聚光后照射到SD大鼠足底部,观察大鼠缩足反应情况,当选定一定强度的光源,照射达到一定时间时,足底快速移开有机玻璃箱底面而出现快速的缩足反应,测定过程中保持有机玻璃箱底板干燥、清洁,以免影响测量结果,观察和记录由照射到SD大鼠出现缩足的时间作为热缩足潜伏期(paw withdrawal thermal latency, PWL), 设置最大光照时间为25 s,如25 s仍不缩足者记为热缩足潜伏期为25 s,测量3次取平均值作为观察结果。
1.4.3 明暗箱实验 明暗箱检测系统包括穿梭箱和记录系统两部分。穿梭箱分为3个不透明室,A室和B室较大,并排放置,为条件训练室;C室较小,位于A室和B室前面,各室之间通过可以移动的门相通。A室为黑色室壁,B室为白色室壁,大鼠具有趋黑的特性,喜欢停留在A室内,C室三壁透明可以用于适应环境。图像采集系统安装在明暗箱顶部正中,并与计算机相连,可以追踪观察大鼠的活动情况,统计大鼠从明箱放入10 min,在明箱中的停留时间和穿梭次数。室温控制在(25±1)℃,保持安静明亮的环境。
1.4.4 强迫游泳实验 大鼠游泳桶高度为60 cm,直径为30 cm,保持加水深度为40 cm。水温控制在(25±1)℃,保持安静明亮的环境。将大鼠从固定位置放入游泳桶内开始计时,记录大鼠开始游泳的时间即游泳潜伏期以及从开始计时5 min内的累积不动的时间。游泳5 min结束后,取出大鼠,用干纱布拭去皮肤毛发大部分水后,放回笼中饲养。
1.5 统计学处理
2 结果
2.1 人参皂苷Rg2 对大鼠机械性缩足反射阈值的影响
各组大鼠手术前1 d至1 d机械性缩足反射阈值均在14 s左右,假手术组大鼠手术前与手术后机械性缩足反射阈值未见明显变化,慢性坐骨神经损伤模型组大鼠机械性缩足反射阈值手术后逐渐降低,7 d时最低,人参皂苷Rg2低、高剂量组与模型组相比,治疗后3 d、7 d、14 d时械性缩足反射阈值显著延长(P<0.01),说明人参皂苷Rg2能抑制大鼠机械性疼痛,并且浓度越高,效果越明显(表 1)。
2.2 人参皂苷Rg2对大鼠光辐射热缩足反射潜伏期的影响
各组大鼠手术前1 d机械性缩足反射潜伏期均在21 s左右,假手术组大鼠手术前与手术后机械性缩足反射阈值未见明显变化,慢性坐骨神经损伤模型组大鼠机械性缩足反射阈值手术后逐渐降低,7 d时最低,人参皂苷Rg2低剂量组治疗后7 d、14 d时,高剂量组3 d、7 d、14 d时与模型组相比,机械性缩足反射阈值明显延长 (P<0.01),说明人参皂苷Rg2能抑制大鼠机械性疼痛,并且浓度越高,效果越明显(表2)。
2.3 人参皂苷Rg2对大鼠在明箱内时间和穿梭次数的影响
各组大鼠手术前1 d在明箱内时间和穿梭次数没有显著性差异,慢性坐骨神经损伤模型组大鼠手术14 d时,与假手术组比较,在明箱内时间显著缩短(P<0.01),在明箱内穿梭次数显著减少(P< 0.01)。人参皂苷Rg2低剂量组治疗后手术14 d时,与模型组相比,在明箱内时间显著延长(P< 0.01),穿梭次数明显增加(P<0.01,表3)。
2.4 人参皂苷Rg2对大鼠游泳潜伏期和不动时间的影响
各组大鼠手术前1 d水中游泳潜伏期没有显著性差异,慢性坐骨神经损伤模型组大鼠手术14 d时,与假手术组比较,水中游泳潜伏期显著延长(P<0.01)。人参皂苷Rg2低剂量组治疗后手术14 d时,与模型组相比,水中游泳潜伏期显著缩短(P< 0.01)。各组大鼠手术前1 d手术第14日水中5 min内不动时间没有显著性差异(P<0.01,表4)。

Tab. 1 Effects of ginsenoside Rg2 on the threshold of mechanical shrinkage foot reflex in rats (s, n=10)
**P<0.01vssham group or normal group;##P<0.01vsCCI group

Tab. 2 Effects of ginsenoside Rg2 on the thermal withdrawal latency in rats (s, n=10)
**P<0.01vssham group or normal group;##P<0.01vsCCI group
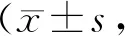
Tab. 3 Effects of ginsenoside Rg2 on the time in the light compartment and the number of transition of rats n=10)
**P<0.01vssham group or normal group;##P<0.01vsCCI group

Tab. 4 Effects of ginsenoside Rg2 on swimming latency and immobility time in rats(s, n=10)
**P<0.01vssham group or normal group;##P<0.01vsCCI group
3 讨论
迄今为止,对神经性病理性疼痛发病机制尚未完全阐明,临床上属于一种比较复杂的慢性疼痛,中药在防治神经系统疾病方面具有多靶点、无耐药性的优点。人参皂苷Rg2作为人参中的主要有效成分,在治疗神经系统疾病方面拥有非常广阔的临床应用前景[5]。 CCI 模型是最经典的、最常用的疼痛模型,造模方法简便、反映稳定,其疼痛特征和神经病理性疼痛十分相似,可表现出自发痛、触发痛等痛觉过敏[9]。本实验建立的大鼠CCI模型,手术后1~14 d时,机械性疼痛阈值和光照辐射热疼痛潜伏期与假手术组比较均明显缩短。
在临床上慢性疼痛患者常常伴随焦虑、抑郁等情绪。抑郁状态可以缩短机体对疼痛反应的阈值,慢性疼痛可以诱发抑郁行为。通过慢性应激的方法建立的抑郁模型大鼠对甲醛诱导的自发性疼痛更加敏感,同时抗抑郁药物能够改善其痛觉过敏。慢性刺激诱导的抑郁状态能够加剧大鼠对疼痛反应的敏感性[10]。叶永贤等研究发现,坐骨神经结扎的大鼠表现为持续热痛阈缩短,明箱内停留时间缩短、穿梭次数减少,强迫游泳潜伏期延长[11]。但也有研究发现破坏调控痛情绪的高级中枢脊髓上中枢的前扣带皮层可以改善疼痛情绪方面的反应,而不能改变急性疼痛的痛觉行为[12]。本研究采用明暗箱测试和强迫游泳试验同时观察了CCI模型的焦虑、抑郁等情绪变化情况,发现CCI手术后14 d大鼠同时具有焦虑、抑郁的表现。中药治疗抑郁症,具有不良反应少、可长期服用、安全可靠等优点。2017 年, Ren 等[13]首次证明了人参皂苷Rg2 与氟西汀类似对小鼠具有抗抑郁作用。其作用机制可能是通过上调海马脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)信号通路发挥作用。研究通过强迫游泳试验、尾部悬吊试验和蔗糖偏好试验三种行为学测试结果表明,人参皂苷Rg2 确实具有抗抑郁效果。此外,Western印迹分析显示,人参皂苷Rg2 可增加海马中的BDNF信号传导途径。
腹腔肠系膜面积大、血管和淋巴管分布丰富,吸收能力强。不同给药途径对各种疼痛的临床治疗效果不同,SD大鼠选择腹腔注射给药,药物吸收快,容易达到药物治疗浓度,而且实验操作比较方便[14-15]。本研究结果显示,腹腔注射人参皂苷Rg2能够延长CCI模型大鼠机械性缩足反射阈值和热缩足潜伏期,同时也能缓解CCI大鼠的焦虑、抑郁状态。
疼痛常伴随抑郁状态,疼痛治疗的同时要关注抑郁指标的变化,关键时刻可以考虑选择性的使用抑郁药物进行综合治疗。综合的心理及药物干预将有助于阐明痛觉的调控机制,从而指导疼痛的临床治疗。
