苹果多酚对野百合碱诱导的肺动脉高压大鼠肺血管重构的作用和机制*
2019-07-04章书豪邵思铭陈方政陈罗薇项歆惠袁琳波
章书豪, 邵思铭, 陈方政, 祝 静, 陈罗薇, 王 恒, 项歆惠, 袁琳波
(1. 温州医科大学第一临床医学院, 2. 温州医科大学仁济学院, 3. 温州医科大学眼视光学院, 4. 温州医科大学基础医学院生理教研室, 浙江 温州 325000 )
肺动脉高压(pulmonary arterial hypertension,PAH)是一类以肺动脉压力进行性升高为特点的致命性肺血管疾病,严重的限制了患者的运动耐受性,且可能会发展为心力衰竭、慢性阻塞性肺病等多种心肺疾病[1-2]。肺动脉高压的形成主要和肺血管收缩和重构有关,但是具体发生机制目前仍不清楚[3]。有研究发现,在肺动脉高压中细胞受到炎症刺激,COX-2的含量上升,引起炎症部位PEG2、PGI2和PGE1含量增加,导致肺动脉血管炎症反应和组织损伤[4]。在肺动脉高压中使用COX-2抑制剂和下调前列腺素,能够调控血管内细胞活性[5],因此COX-2可以作为多种抗炎症药物靶点。
苹果多酚(apple polyphenol,APP)是从苹果中提取的次生植物代谢产物,能通过ros/MAPK/NF-κB通路在抗氧化和抗炎症中发挥重要作用[6]。在心血管疾病研究中发现,苹果多酚能够起到缓解动脉粥样硬化[7],激活内皮型一氧化氮合酶(eNOS),从而改善内皮细胞效应,降低肺部血压[8]。但是目前鲜有研究其在肺动脉高压的作用。在我们的研究中,发现苹果多酚有助于缓解炎症反应、血管收缩和平滑肌细胞的增殖作用,从而能够改善肺动脉高压。
1 材料与方法
1.1 试剂与设备
苹果多酚购自上海源叶生物科技有限公司,野百合碱(MCT)购自上海同田生物技术股份有限公司。COX-2抗体购自英国Abcam公司, eNOS抗体和Abcam购自Cell Signaling Technology(Danvers, MA,USA),PowerLab 4/35(澳大利亚AD Instruments),生理压力传感器(BL—Newcentmry,成都泰盟科技有限公司),CO检测器(ml313C, AD仪器),NO测定试剂盒(南京建成生物工程研究所)。
1.2 实验动物分组与处理
实验采用雄性SD大鼠,体重(180~200 g),由温州医科大学实验动物中心提供(20140038)。购入后普通饲料适应性喂养一周,饲养间温度22~25℃, 相对湿度50%~60%。本实验严格遵循美国国立卫生研究院所制定的《实验动物使用指南》,实验方案经过温州医科大学动物伦理学会审批。大鼠采用随机编号分为四组(Con组,MCT组,APP组,MCT+APP组),每组9只(1)Con组:大鼠皮下注射生理盐水,作为对照组。(2)APP组:隔天按20 mg/kg的剂量腹腔注射苹果多酚。(3)MCT组:按60 mg/kg剂量皮下注射MCT。(4)MCT+APP组:皮下注射60 mg/kg剂量MCT,隔天按20 mg/kg剂量腹腔注射APP,所有处理持续3周[9]。
1.3 大鼠体重与3周存活率的测定
各组大鼠于处理前和处理后一周、两周、三周时分别进行称重,并统计3周后各组存活大鼠数量,计算存活率。
1.4 肺动脉动力学测量
处理三周后,大鼠用3 ml/1 kg的水合氯醛麻醉,暴露右颈外静脉,行颈外静脉插管术,连接血压压力换能器至powerlab生物信号采集分析系统,对肺动脉压力(mean pulmonary artery pressure,mPAP)进行读值。用热稀释法检测心输出量(cardiac output, CO),用CO检测器(ml313C, AD仪器)处理数据。PVR用公式计算:PVR=mPAP/CO
1.5 右心室肥厚指数测量
大鼠处死解剖,将心脏沿着心室边缘和室间隔将右心室切开。用生理盐水略洗,除去多余心肌组织,用滤纸吸干其表面水分,称量右心室、左心室、室间隔(left ventricle+ Interventricular septum, LV+S)的重量,右心室肥大指数计算公式:RV /(LV + S)×100%。
1.6 肺血管结构和形态的组织病理学观察
将大鼠肺组织脱水透明,浸蜡包埋,65℃烘箱中烘干,二甲苯中脱蜡两次,在浓度分别为100%、95% 、90%、80%、70%的酒精中依次浸泡3 min,再经蒸馏水转入苏木精染色。通过1%盐酸乙醇进行分化。再将切片用伊红染色并用蒸馏水洗涤后用70%,85%,95%,100%浓度梯度的乙醇脱水。二甲苯透明化后用中性胶固定。在光学显微镜下观察肺血管结构和形态,以评估组织病理学变化。
1.7 肺动脉血管环外周长比值(WT%),肺小血管管壁面积和管总面积比值(WA%)测量
采用病理图像分析软件 Image-pro Plus,测量肺动脉外径(the diameter of external vessal, ED),内径(the diameter of internal vessal, ID)和内侧壁厚度(medial wall thickness, MWT)。 肺动脉介质厚度(pulmonary arterial media thickness, PAMT)可以通过以下公式计算:PAMT = 2×MWT / ED,计算壁面积(WA),总面积(total area, TA),血管内腔面积(lumen area, LA)。计算WT%公式:WT%= 2×PAMT / ED×100%,计算WA%公式:WA%=(TA-LA)/ TA×100%。
1.8 通过Q-PCR检测基因表达
将各组肺组织样品剪成小块后碾磨,加入TRIzol试剂(Invitrogen,Carlsbad,CA,USA)分离出全部RNA。使用GoScript逆转录试剂盒(Promega,Madison,WI,USA)将RNA用作模板以产生cDNA合成。用于RT-PCR的引物序列如表1:
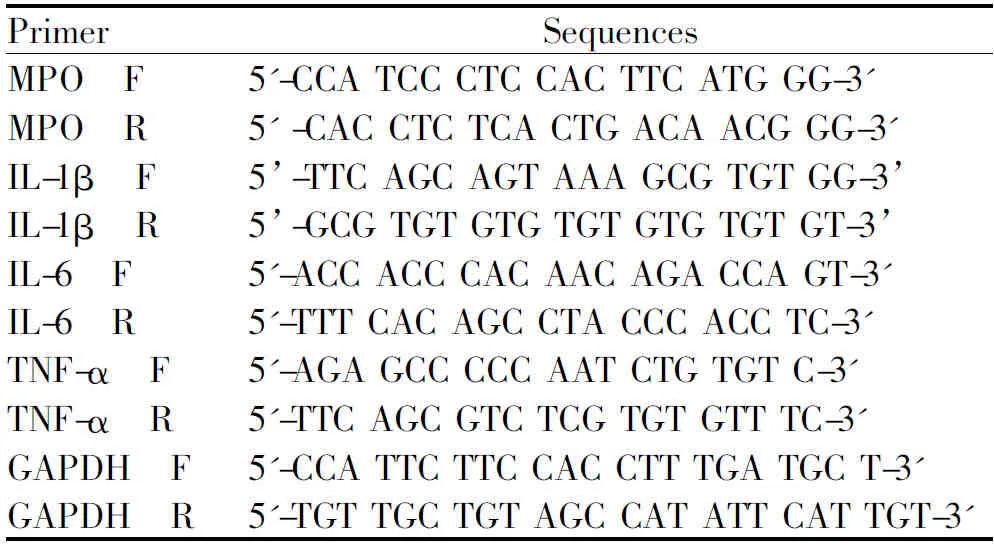
Tab. 1 The primer sequences used for RT-PCR
对于每个样品,三次进行RT-PCR实验。通过琼脂糖凝胶电泳确认PCR产量。
1.9 蛋白质印迹检测COX-2和eNOS水平
通过10%水合氯醛腹腔麻醉大鼠,切除肺组织。分离肺主动脉,剪开动脉,内膜面贴于培养皿置37℃、5%CO2培养箱0.5 h后加含15%胎牛血清的培养液培养,第5日内皮细胞爬出后摘掉除组织块,取内皮细胞放入EP管中,研磨后加入200 μl细胞裂解液,再次研磨置于离心机中14 000g离心15 min,收集上清液。酶标仪检测蛋白质浓度,加上样缓冲液煮沸保存。制备SDS-PAGE凝胶。通过10%SDS-PAGE分离蛋白质并转移至PVDF膜。在通过多克隆抗COX-2(或抗eNOS)检测COX-2(或eNOS)后,使用ECL成像系统显示条纹灰度级来测量COX-2(或eNOS)的含量。
1.10 内皮细胞中NO水平检测
内皮细胞分离方法同上,使用NO测定试剂盒(南京建成生物工程研究所)来定量测定内皮细胞内NO水平,所有测量均遵循制造商方案进行。
1.11 大鼠肺动脉平滑肌细胞培养与鉴定
用10%水合氯醛腹腔麻醉大鼠后,分离肺组织中的肺动脉,在显微镜下剥离肺动脉内外膜,将肺动脉中膜剪为1 mm×1 mm×1 mm的组织块,接种于25 ml培养瓶中,在37℃、5%CO2培养箱孵育。每4~6 d更换培养液1次(含15%胎牛血清的DMEM/F12)。16 d后细胞爬出,呈典型峰谷状分布。经抗α-actin单克隆抗体免疫组化鉴定,为纯度97%以上的肺动脉平滑肌细胞。经胰酶消化传代培养,采用生长良好的4~7代细胞进行实验。
1.12 平滑肌细胞内Ca2 +水平检测
通过Becton Dickinson FACS Calibur流式细胞仪,用Ca2++(-)敏感性荧光染料Fluo-3 /乙酰氧基甲酯(Fluo-3 / AM)测定平滑肌细胞内Ca2+水平。使用PerkinElmer LS 55荧光分光光度计测定荧光值,每1分钟激发和发射波长为488 nm和526 nm。使用以下等式,用fluo-3荧光强度计算平滑肌细胞内Ca2+:[Ca2+] i = Kd [(F-Fmin)/(F max -F)],其中Kd=400 nmol/L。通过添加0.1%Triton X-100测定最大Fluo-3荧光强度(Fmax),通过加入5 mmol/L EGTA抑制Fluo-3荧光测定最小荧光强度(Fmin)。F是在不添加Triton-X-100或EGTA的情况下测量的荧光值。
1.13 统计学处理
2 结果
2.1 APP对MCT诱导的PAH大鼠的体重和存活率的影响
在建模和治疗的3周中,Con组,APP组和APP + MCT组的平均体重增加,而MCT组的平均体重明显减少。在治疗结束时,MCT组的平均值低于Con组,APP组和APP + MCT组。 MCT + APP组的存活率高于MCT组,Con组和APP组的100%存活率。结果表明APP能够提高大鼠存活率和体重(表2)。
2.2 APP对MCT诱导的PAH大鼠肺血流动力学的影响
与Con组和APP组相比,MCT组的mPAP和PVR显著增加(P<0.05),这意味着成功建立PAH模型。 与MCT组相比,MCT + APP组的mPAP和PVR显著降低(P<0.05),显示APP在治疗MCT诱导的PAH大鼠有显著作用。APP组与Con组结果相同,说明APP无明显副作用(表3)。
2.3 APP对MCT诱导的PAH大鼠右心室重塑的影响
与Con组和APP组相比,MCT组的RVHI显著升高(P<0.05)。与MCT组相比,MCT + APP组的RVHI显著降低(P<0.05),表明APP对MCT诱导的PAH大鼠右心室肥大有抑制作用(表3)。

Tab. 2 Effects of APP on body weight and survival rate of MCT-induced PAH rats (g, n=9)
*P<0.05,**P<0.01vsCon group;#P<0.05,##P<0.01vsMCT group


GroupmPAPΔPVRRVHICon15.84±2.48213.37±30.290.17±0.03APP15.09±1.49212.93±27.980.16±0.03MCT56.49±7.71**698.68±80.69**0.50±0.09**APP+MCT39.53±8.85##498.59±115.32##0.35±0.10#
*P<0.05,**P<0.01vsCon group;#P<0.05,##P<0.01vsMCT group
2.4 APP对MCT诱导的PAH大鼠肺动脉重构的影响
组织镜检结果显示Con组和APP组肺动脉壁平滑且内皮细胞连续,平滑肌细胞无异常增厚现象,大多数肺泡壁完整。MCT组内皮细胞不连续,且有炎性细胞浸润,肺动脉中层有10~15层的平滑肌,血管出现明显增厚和重构现象。在MCT + APP组中,内皮细胞连续完整,动脉中层8~12层平滑肌APP治疗缓解了MCT对肺组织的结构破坏,抑制了平滑肌细胞增厚(图1A)。 MCT组的WT% (40.87%±7.58%)和WA%(82.00%±11.80%)显著高于Con组的WT%(13.93%±3.00%)和WA%(59.00%±10.90%,P<0.05,图1B和C),MCT + APP组的WT%(25.36%±4.51%)和WA% (66.00%±10.90%)显著低于MCT组(P<0.05,图1B和C)),结果表明APP能够缓解MCT诱导的血管重构。
2.5 APP对MCT诱导的PAH大鼠肺组织COX-2 和炎症因子表达的影响
MCT组中MPO ,IL-1 ,IL-6 ,TNF-α表达显著高于Con组和APP组中的炎性因子表达(P<0.05,图2A,B和C)。 APP可缓解MCT引起的肺组织炎症,因为MCT + APP组MPO ,IL-1,IL-6 ,TNF-α表达明显低于MCT组(P<0.05,图2A,B和 C)。MCT组的COX-2表达(3.483±0.671)显著高于Con组中的表达,而MCT + APP组的COX-2表达(1.815± 0.215)显著低于MCT组(P<0.05,图2E),结果表明APP能够抑制炎症反应。
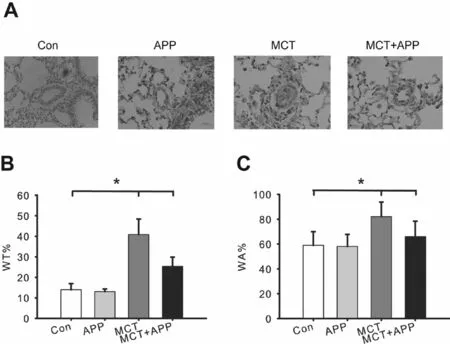
Fig.1The effects of APP on the morphological and structural changes of pulmonary arterioles in the rats
A: Results of HE staining in rat lung tissue(× 200) ; B: Percentage of wall thickness to vascular diameter (WT%); C: Percentage of wall area to total vascular area (WA%).n=9
*P<0.05,**P<0.01vsMCT group
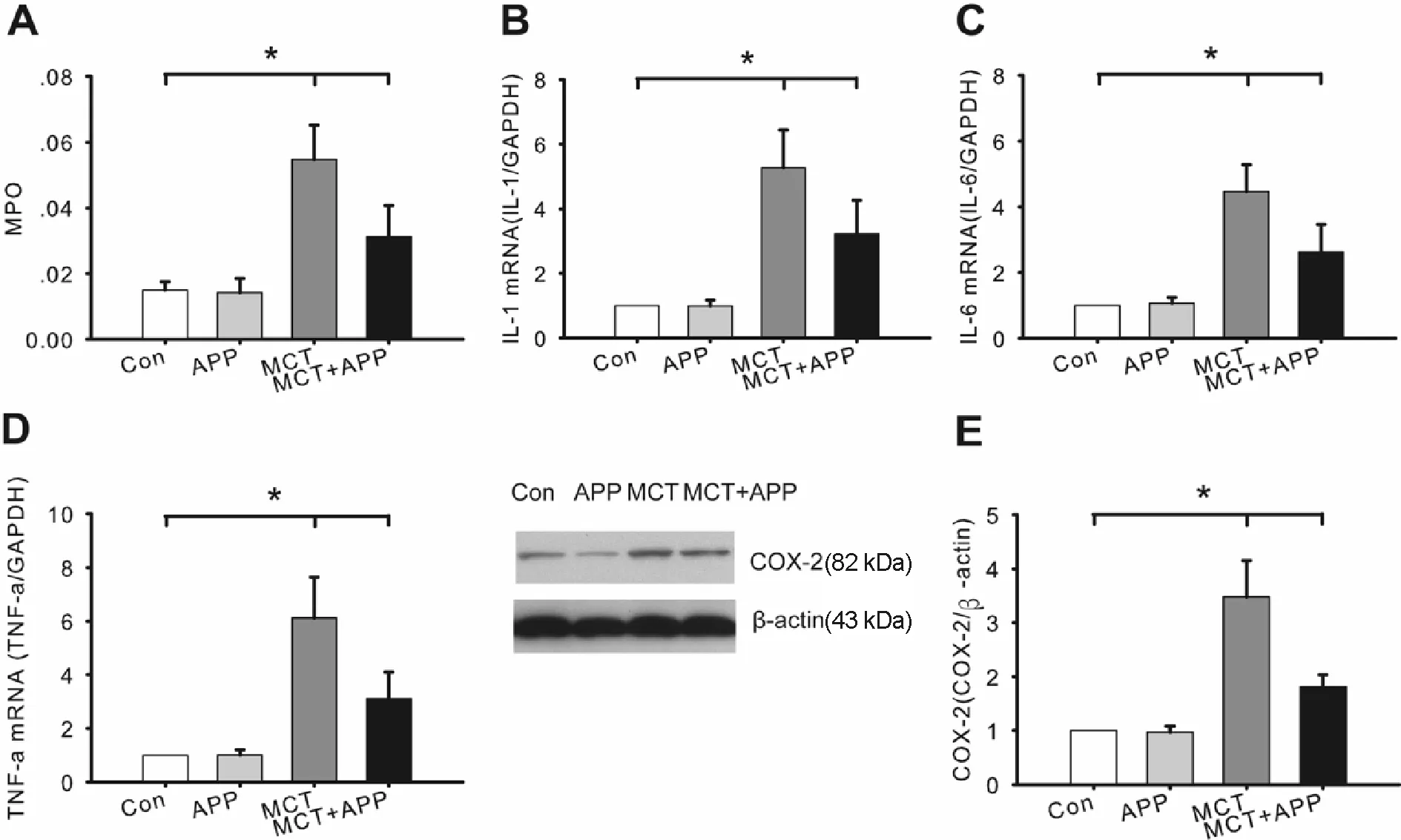
Fig.2The effects of APP on the expressions of MPO, IL-1, IL-6, TNF-α and COX-2 in the lung tissues(n=9)
A,B,C,D: Qrt-PCR results of MPO, IL-1, IL-6 and TNFα expressions in rats; E: Western blot results of COX-2 expression
*P<0.05,**P<0.01vsMCT group
2.6 APP对肺内皮细胞内eNOS表达及NO合成和肺动脉平滑肌细胞内Ca2 +浓度的影响
MCT组的肺内皮细胞NO合成水平(26.887±9.897)μmol/ L显著低于Con组和APP组(55.777±9.823)μmol/ L(P<0.05,图3A)。与MCT组相比,MCT + APP组肺内皮NO合成水平(42.161± 3.948)μmol/ L明显升高(P<0.05,图3A)。同时,四组eNOS表达量显示出同样的结果。MCT组的eNOS表达(0.234±0.0705)显著低于Con组(P< 0.05,图3B),MCT + APP组(0.545±0.154)显著高于MCT组(P<0.05,图3B)。MCT刺激和APP治疗也引起了四组细胞内Ca2 +浓度差异。MCT组的平滑肌细胞内Ca2 +浓度显著高于Con组和APP组(P<0.05,图3C和D)。与MCT组相比,MCT + APP组显著降低(P<0.05,图3C和D)。这些结果表明APP可以缓解MCT造成的内皮细胞eNOS表达下调的效应,同时可以降低肺动脉平滑肌细胞内Ca2+浓度。
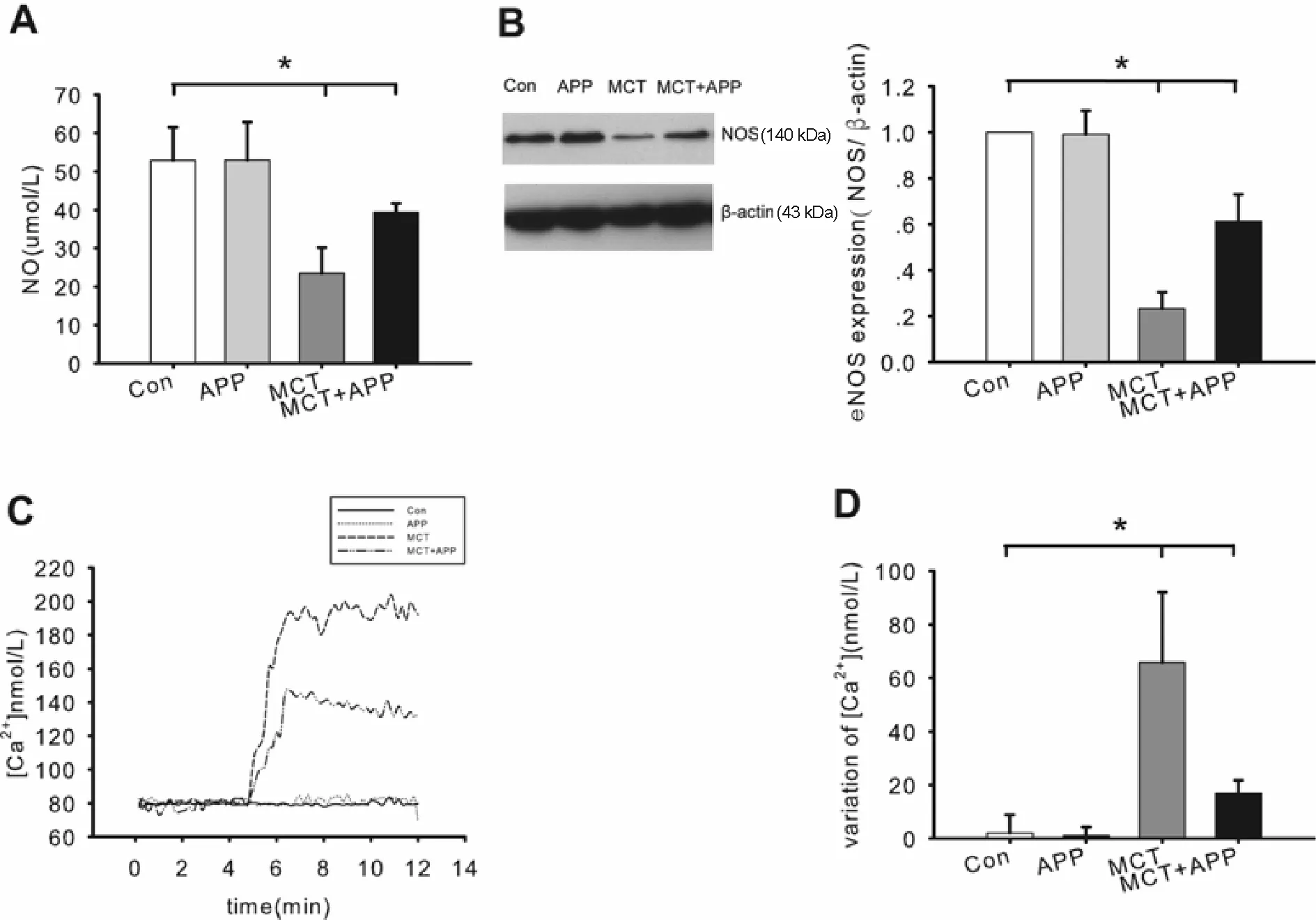
Fig.3The effects of APP on the protein expression of eNOS and concentration of NO in endothelial cells and Ca2 +in pulmonary artery smooth muscle cells(n=9)
A: NO synthesis ofendothelial cells; B: eNOS expression of endothelial cells; C: The curves of intracellular Ca2+concentration varying along with time; D: Intracellular Ca2+concentration levels differed in pulmonary arterial smooth muscle cells
*P<0.05,**P<0.01vsCon group
3 讨论
肺血管的收缩和重构是各种病理类型肺动脉高压发生发展的共同环节[10]。目前研究认为炎症反应会引起肺血管收缩和重构的产生。一方面炎症因子的过度表达会改变平滑肌细胞内代谢通路关键酶的含量,诱导平滑肌细胞过度增殖,血管腔狭窄,导致肺血管阻力升高[11]。另一方面炎症因子的释放,白细胞的聚集诱导内皮损伤和凋亡,上调平滑肌细胞内Ca2 +[12]。胞浆内游离的Ca2 +[(Ca2 +)i]是肺动脉平滑肌细胞(pulmonary artery smooth muscle cells, PASMC)收缩,分化和增殖的关键作用因子,Ca2 +上调会导致血管重构的发生[13],两者相互作用导致肺动脉高压的形成。同时,COX-2作为COX家族的同工酶,其在正常细胞中的含量极低。但在炎症因子的刺激下,COX-2会过度表达并上调炎症反应中关键酶含量和活性。因此COX-2是炎症反应中的关键指标[14]。COX-2也被认为是抗炎药物的治疗靶点[15]。
苹果多酚是一种提取自苹果的多酚类物质,以往研究发现其具有很强的抗炎活性[15]。在我们的实验中,发现苹果多酚不仅可以通过抑制炎症因子COX-2和IL-1,IL-6,TNF-α,MPO 的表达,减轻炎症反应和血管壁内白细胞聚集。还可以通过促进内皮细胞合成eNOS,释放NO,起到缓解血管收缩和保护内皮细胞的作用。保持血管壁内皮细胞的完整,能够通过内皮细胞和平滑肌细胞,胞间信号传导降低平滑肌细胞内Ca2 +含量,抑制平滑肌细胞增殖,从而逆转肺血管重构,改善血液动力学指标。此外,还有实验发现,苹果多酚能够通过NF-κB通路减轻内皮细胞炎症反应[16],介导丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路促进细胞凋亡,于在心血管疾病中,苹果多酚还能够通过抑制ox-LDL诱导MAPK的激活预防早期动脉粥样硬化[17]。
我们的研究发现苹果多酚主要通过调节炎症因子表达和细胞内NO和Ca2 +,保护内皮细胞,抑制平滑肌细胞增殖,来逆转肺血管重构过程,并且没有副作用。目前还有研究指出苹果多酚能够通过代谢途径和其他炎症通路,抑制肺平滑肌细胞增殖,但具体机制尚不清楚,仍有待研究。但其是天然植物提取物,易提取纯化,且无明显毒副作用,具有良好的广泛应用前景。
