心肌梗死大鼠钙敏感受体表达与心肌细胞凋亡的变化
2019-07-03扬国宏宋高臣徐长庆
袁 辉, 扬国宏, 李 姝, 李 丽, 宋高臣, 徐长庆, 孙 健△
( 1. 牡丹江医学院, 黑龙江 牡丹江 157011; 2. 哈尔滨医科大学病理生理教研室, 黑龙江 哈尔滨 150081)
钙敏感受体(calcium sensing receptor,CaSR)是G蛋白耦联受体(G protein-coupled receptor, GPCR) C家族成员。近年来研究证实, CaSR 在心血管系统有功能性表达, 并且参与一些重要病理过程的发生发展, 例如:心肌缺血/再灌注损伤[1]和心肌肥大等[2]。本课题组曾先后观察了不同鼠龄正常大鼠、离体灌流和冠脉结扎复制的大鼠心肌缺血/再灌注损伤模型中的心肌 CaSR 的表达规律[1,3,4],然而CaSR在大鼠心肌梗死不同时期的表达规律,及其对心肌细胞凋亡的影响尚不清楚。因此,本实验拟观察急性心肌梗死(acute myocardial infarction,AMI)后不同时间内CaSR的表达情况,并揭示其对心肌细胞凋亡和相关凋亡蛋白表达的影响。
1 材料与方法
1.1 主要试剂和仪器
超声系统(IE33,荷兰),H - 600 型透射电镜 (日立),荧光定量PCR仪(Exicycler 96,韩国),紫外分光光度计(NANO 2000,America),BL420F生物机能实验系统(成都泰盟),肌酸激酶(CK)和LDH测定试剂盒(南京建成),高纯总RNA快速提取试剂盒(BioTeke),大鼠心肌肌钙蛋白cTnT ELISA试剂盒(USCN),TUNEL凋亡检测试剂盒(Germany),Bax、Bcl-2多克隆抗体 (Santa Cruz, CA, USA),CaSR、caspase-3、caspase-9单克隆抗体(Abcam,英国)。
1.2 急性心肌梗死模型制备
选取健康Wistar大鼠(8周龄),随机分为对照即假手术组(Sham组,冠脉只穿线不结扎)和AMI模型1周、2周和4周组(每组成功存活n=5),腹腔注射10%水合氯醛(3.5 ml/kg)麻醉,AMI组大鼠左前胸去毛消毒,开胸暴露心脏,剪开心包,在左心耳下缘与肺动脉间可见左冠状动脉前降支起始部,在距离主动脉根部约3~5 mm处,以左冠状静脉为标志,用尼龙缝线结扎造成缺血,建立AMI模型。
1.3 心血流动力学检测
分别于实验后第1、2、4 周采用10%水合氯醛实施麻醉,然后将Millar导管沿颈动脉插入至左心室, 测定左心室舒张末期压(left ventricular end diastolic pressure, LVEDP),左心室收缩压(left ventricular systolic pressure, LVSP),左心室内压最大上升速率(+dp/dtmax)和最大下降速率(-dp/dtmax)等血流动力学指标。
1.4 透射电镜观察心肌超微结构
大鼠经耳缘静脉推注10%KCl处死。取各组大鼠心尖区心肌组织,切成约1 mm3的组织块,2.5%戊二醛前固定,1%锇酸后固定,丙酮逐级脱水,石蜡包埋,超薄切片,1%醋酸双氧铀及枸橼酸铅双重染色,H-600A型透射电镜观察。
1.5 Real-Time PCR检测CaSR mRNA表达
取梗死区心肌组织低温充分研磨后,利用TRIzoI提取试剂盒提取各样本总RNA后,进行RNA浓度和纯度检测,接着逆转录合成cDNA。大鼠引物序列(表1)。

Tab. 1 Sequences for primers
Real-Time PCR反应体系20 μl(cDNA 1 μl,上下游引物各0.5 μl,SYBR GREEN mastermix 10 μl,ddH2O 8 μl)。采用相对定量 2- △△ CT法分析数据。
1.6 Western blot检测心肌组织中CaSR、Bcl-2、Bax、caspase-3和caspase-9 蛋白表达
提取梗死区心肌组织蛋白,BCA蛋白浓度测定试剂盒测定蛋白浓度。SDS- PAGE凝胶电泳,转膜,孵育Ⅰ抗anti-CaSR(1∶500),anti-Bcl-2(1∶ 1 000)、anti-Bax(1∶1 000)、anti-caspase-3(1∶ 1 000)和anti-caspase-9(1∶500),4℃过夜。洗膜后加入羊抗兔IgG-HRP II 抗(1∶5 000),ECL发光法测定目的条带,凝胶图像处理系统(Gel-Pro-Analyzer软件)分析目标条带的光密度值。
1.7 TUNEL染色观察细胞凋亡
TUNEL(terminal deoxynucleotidyl transferase mediated dUTP nick-end labelling)染色方法检测心肌细胞凋亡。按试剂盒说明书操作,切片常规脱蜡脱水,过氧化氢封闭,内源性过氧化物酶标记,信号转化和分析。光镜下观察细胞凋亡情况。凋亡的细胞核呈现棕褐色或黑色;正常的细胞核用苏木素复染成蓝色,每张切片随机取 5个高倍视野, 计数细胞总数及凋亡细胞数, 计算凋亡率。凋亡率=(凋亡细胞/全部细胞)×100%。
1.8 统计学处理
2 结果
2.1 AMI 模型组的心电图的变化
结扎左冠状动脉前降支后,左室前壁心肌组织搏动减弱,颜色苍白,此时心电图可见R波振幅升高,ST 段弓背向上抬高(图1),表明AMI 模型建立成功[5]。
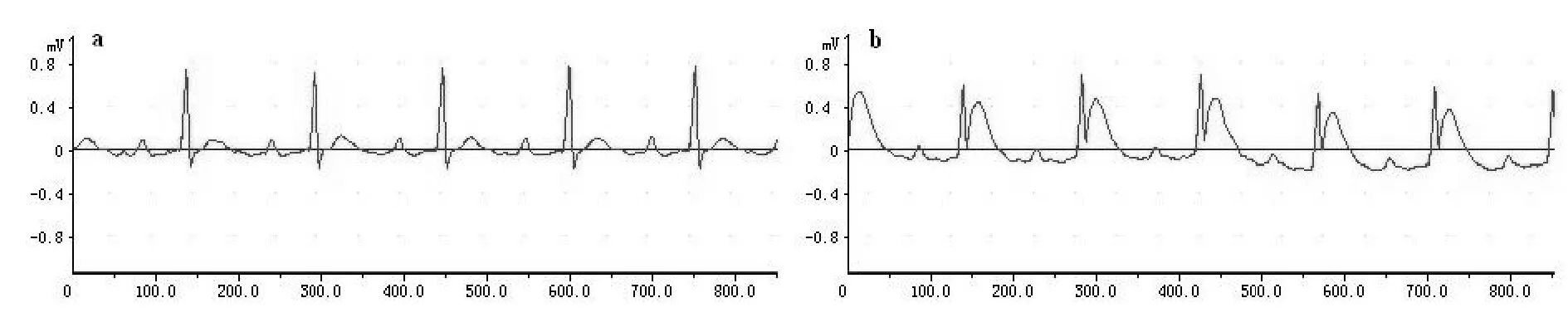
Fig.1Changes of surface electrocardiogram in rats before and after left anterior descending coronary artery ligation
A: The Sham group; b: The AMI group
2.2 AMI 模型组大鼠心肌超微结构变化
大鼠心肌超微结构变化如图2 所示。电镜下可见,AMI组细胞核和线粒体都发生了严重损伤,表现线粒体肿胀,心肌肌节断裂、排列紊乱,肌原纤维溶解;上述结果说明心肌梗死后大鼠心肌细胞发生凋亡,电镜下可见凋亡特征性的形态学改变:细胞体积变小,细胞质浓缩,细胞核内出现许多空泡结构,细胞核裂解为碎块。

Fig.2Ultrastructural changes of myocardial tissue under electron microscope (×15 000)
2.3 AMI 模型组大鼠心血流动力学变化
和Sham 组相比,LVSP、+dp/dtmax、-dp/dtmax均有减少,LVEDP升高(P<0.05或0.01,表2);但不同时间内基本没有变化。

GroupLVSP(mmHg)LVEDP(mmHg)+dp/dtmax(×103mmHg/s)-dp/dtmax(×103mmHg/s)Sham118.2±12.05.8±1.05.1±0.64.1±0.6AMI(1W)87.4±7.5*13.2±1.4**3.0±0.8*2.1±0.3*AMI(2W)86.2±8.7*13.3±1.8**3.3±0.5*2.3±0.4*AMI(4W)87.4±7.5*13.2±1.4**3.0±0.8*2.1±0.3*
LVSP: Left venteicular systolic pressure; LVEDP: Left ventricular end diastolic pressure; +dp/dtmax: Maximum increase rate of left chamber pressure; -dp/dtmax: Maximum falling rate of left chamber pressure
*P<0.05,**P<0.01vssham group
2.4 AMI 模型组大鼠血清CK和LDH活力及cTnT水平的变化
和Sham组相比,AMI组cTnT 水平、CK和LDH活性均升高 (P<0.05或0.01,表3),随着心肌梗死的发展,cTnT 水平和CK活性逐渐降低,LDH变化不明显。

GroupcTnT(pg/ml)CK(U/ml)LDH(U/ml)Sham113.1±5.42.4±0.91.3±0.0AMI(1W)434.5±41.8**5.7±1.1**2.3±0.2**AMI(2W)319.4±7.6**##5.5±1.5**1.9±0.1**##AMI(4W)239.8±8.0**##△△4.9±0.7**2.0±0.2**#
CTnT: Troponin T; CK: Creatine kinase; LDH: Lactic dehydrogenase
**P<0.01vssham group;##P<0.01vsAMI-1W;△△P<0.01vsAMI-2W
2.5 AMI 模型组大鼠心肌组织细胞凋亡的变化
TUNEL检测结果显示(图3),造模后1、2、4周Sham组心肌细胞凋亡很少(3.55%±1.20%)、 (5.17%±1.94%)、(4.62%±1.73%);心梗后不同时间心肌细胞凋亡明显增加分别为:(26.48%± 5.22%)、(34.82%±6.88%)、 (41.59%± 7.43%),差异有显著性(P<0.01)。
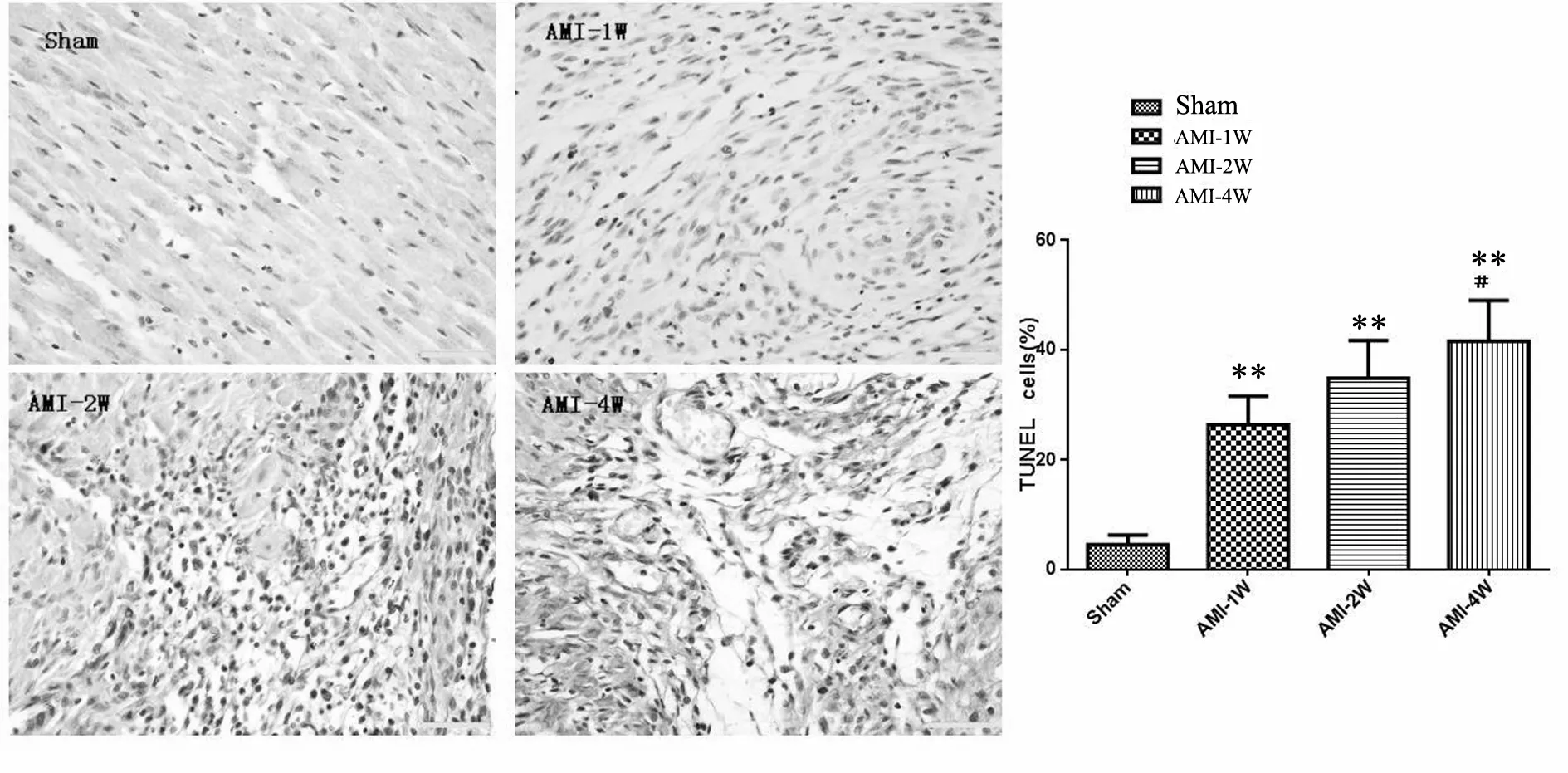
Fig.3Results of TUNEL staining in rat cardiomyocytes and statistical analysis of apoptosis indexes (×400)
**P<0.01vssham group;#P<0.05vsAMI-1W
2.6 AMI 模型组大鼠心肌组织CaSR mRNA和CaSR蛋白表达的变化
如图4示:与Sham组相比, 随着时间延长,AMI组大鼠心肌组织CaSR mRNA和CaSR 蛋白表达均明显增加,第1、2、4周相比差异显著(P< 0.05)。
2.7 AMI 模型组大鼠心肌组织Bcl-2、Bax、caspase-3、caspase-9蛋白表达的变化
Western blot检测术后不同时间大鼠各组心肌组织Bcl-2、Bax、caspase-3、caspase-9蛋白的表达(图5):术后第1、2和4周时和Sham组相比,AMI组Bcl-2蛋白表达均减少(P<0.01),而促凋亡蛋白Bax、caspase-3、caspase-9的表达随着时间的延长逐渐增多,caspase-9在第4周时有所下降,但和第1、2周相比无统计学意义(P>0.05)。

Fig.4The changes of CaSR protein and mRNA by Western blot and quantitative real-time PCR after AMI from 1 week to 4 weeks
A: The changes of CaSR mRNA by quantitative real-time PCR; B: The changes of CaSR protein by Western blot; C: Quantitative analysis of the Western blot result
**P<0.01vssham group;##P<0.01vsAMI-1W;△△P<0.01vsAMI- 2W

Fig.5The expressions of Bcl- 2, Bax, cleved caspase-3 and cleved caspase-9 protein in rat cardiac tissue from different time
Bcl- 2: B Cell Leukemia 2; Bax: Bcl-2 associated X protein
*P<0.01vssham group;##P<0.01vsAMI-1W;△P< 0.05vsAMI-1W
3 讨论
钙敏感受体(CaSR)是调节钙代谢的重要因素,还参与细胞增殖、分化等的调节。自2003年Wang等[3]首次证实在大鼠心肌组织存在CaSR表达后,本课题组曾先后证实CaSR参与了一些重要病理过程的发生发展,如2015年白淑芝等[6]研究发现大鼠糖尿病性心肌病进展过程中 CaSR 的表达逐渐降低,并可能导致钙稳态紊乱参与糖尿病心肌病的发生;2012年Guo J等[7]研究发现动脉粥样硬化大鼠心肌 CaSR 的表达增加导致对心肌梗死的敏感性增加。但 CaSR 在心肌梗死后不同时期的表达变化规律还不清楚。本研究旨在观察CaSR在心肌梗死后不同时期的表达变化规律,及其对心肌细胞凋亡的影响。
临床实践表明,心肌损伤过程中,常伴有心电图和血清酶谱的变化,其中 ST 段抬高是心肌缺血的典型表现;而血清心肌酶水平是心肌细胞受损程度的重要标志,包括血清 LDH、CK、CK-MB 等;其中尤以肌钙蛋白特别是 cTnT 表达水平敏感性和特异性最高,是目前理想的心肌梗死标志物[8]。
本研究显示,AMI组心电图呈缺血样改变,S-T 段明显上抬,此时大鼠左室前壁心肌组织搏动减弱,颜色苍白,出现心肌梗死变化。且模型成功后不同时间均伴有血清酶谱 LDH、CK 和肌钙蛋白c TnT 表达水平的升高,心功能各指标LVSP、-dp/dtmax、+dp/dtmax的减少和LVEDP的增加。这些均表明本实验成功复制了大鼠心肌梗死模型。
为了观察心肌梗死后 CaSR 在不同时间内的表达变化,实验中分别采用RT-PCR和Western blot技术, 观察了CaSR mRNA和蛋白在AMI模型成功后第1、2、4周的表达情况。结果发现:随着心肌梗死的发展,大鼠心肌组织中CaSR mRNA和蛋白表达均逐渐增多,提示心肌 CaSR的表达增加参与了心肌梗死的发生发展。
电镜下细胞超微结构的观察是迄今为止判断凋亡最经典、最可靠的方法,本实验电镜观察结果显示,AMI组大鼠心肌细胞中细胞核和线粒体都发生了严重损伤,表现为心肌肌节纤维排列紊乱,肌丝溶解、断裂;线粒体肿胀;染色质浓缩、沿核膜呈周边性排列,形成大小和形状不一的碎片及块状;本实验还应用TUNEL法检测了不同时间各组大鼠心肌细胞凋亡情况,并计算凋亡指数。结果显示,与Sham 组相比,随着时间的延长,AMI组大鼠的心肌细胞凋亡指数显著增高,上述结果说明心肌梗死后心肌损伤可以引起大鼠心肌细胞凋亡,发生凋亡特征性的形态学改变。
研究证实,细胞凋亡是心肌缺血损伤中心肌细胞死亡的重要方式之一[9]。Caspase 家族是执行细胞凋亡作用的一组半胱氨酸蛋白酶,其成员 Caspase-3 是整个凋亡级联反应中的标志酶。Caspase-3 通过对蛋白激酶、核酸酶及细胞骨架的裂解,直接使细胞发生凋亡,被认为是执行死亡蛋白酶[10];细胞凋亡有两条经典途径,其一是细胞外的死亡受体途径,其中涉及多种凋亡调控基因如促凋亡基因Bax和抗凋亡基因Bcl-2等,最终作用于Caspase3,使其活化后促发下游基因的活化,最终导致细胞凋亡的发生[11,12]。经过实验,我们发现,各时间点AMI组抑制凋亡的相关蛋白Bcl-2表达减少,而与促进凋亡的相关蛋白表达Bax,caspase-3和caspase-9则增多;且有明显时间差异。有研究证实[7]活化CaSR 的信号,通过一系列的G 蛋白,能调节细胞内钙和MAPK信号途径进而激活诱导细胞凋亡。本研究结果显示在心肌梗死发生发展过程中,心肌组织中CaSR表达逐渐增多,但是是否也通过MAPK信号传导途径调控细胞凋亡相关蛋白如Bax,caspase-3的表达,从而调控心肌细胞凋亡的发生,我们将在进一步研究中探讨。
总之,我们的结果表明随着大鼠急性心肌梗死时间的延长,心肌组织中CaSR表达逐渐增多,通过某些信号传导途径调节凋亡相关蛋白的表达,从而调控了细胞凋亡的发生,参与心肌梗死的发生发展过程。但其具体机制还需我们在今后的研究中进一步探讨。
