髓样分化蛋白2基因沉默对高糖诱导的大鼠心肌细胞增殖抑制、凋亡及炎症反应的影响*
2019-07-03林中民陈国荣张泉波项兰婷曹琼洁温州医科大学附属第一医院病理科温州医科大学附属眼视光医院省部共建眼视光学和
林中民, 陈国荣, 张泉波, 王 芳, 项兰婷, 曹琼洁( . 温州医科大学附属第一医院病理科, 2. 温州医科大学附属眼视光医院 省部共建眼视光学和
视觉科学国家重点实验室, 浙江 温州 325000)
糖尿病心肌病(diabetic cardiomyopathy, DCM)是糖尿病患者的主要心血管并发症之一[1],临床上主要依靠控制血糖、降血压来控制糖尿病心肌病病程,作用有限。近年来越来越多的证据显示炎症可能单独或作为高血糖的下游环节在糖尿病心肌病的发病机制中起关键作用[2, 3]。MD2是Toll样受体4(Toll-like receptor 4 , TLR4)的辅助蛋白,是LPS-TLR4炎症反应的直接介导物。TLR4/MD2-LPS形成三元复合物激活下游信号通路:MAPKs/NF-κB炎症因子转录途径和干扰素-β(IFN-β)转录途径[4],调控下游炎症因子、趋化因子和黏附分子等的转录和表达[5]。MD2还可以结合其他内源性配体,如HMGB1[6],SAA3[7]和胆固醇[8],以激活TLR4促炎信号通路,在多种慢性炎症疾病发生发展过程中也起重要作用,如糖尿病并发症、肥胖和动脉粥样硬化等[9-11]。MD2在心肌炎症反应中的作用未见报道,但慢性炎症作为应答组织或胞内应激损伤的常见病理反应,在不同器官或组织的免疫防御机制是相通的。今后,阻断炎症反应相关靶点,如靶向基因沉默等方法有望成为DCM治疗或联合治疗的重要策略。所以我们提出假设MD2基因沉默能干扰高糖/高血糖诱导的心肌炎症反应,对DCM发生发展起重要作用。
本课题旨在体外培养大鼠心肌细胞系H9C2来明确高糖对细胞的损伤,进一步研究MD2基因沉默对高糖处理后的大鼠心肌细胞增殖、凋亡及炎症因子水平的影响,并初步探讨其可能机制,或能为治疗糖尿病心肌病提供新的思考和方案。
1 材料与方法
1.1 材料与设备
大鼠心肌细胞系H9C2购买自中国科学院典型培养物保藏委员会细胞库(上海)。DMEM培养基、胎牛血清FBS、0.05% Trypsin-EDTA、Lipo-fectamineTMRNAi MAX 转染试剂、Trizol试剂、power upTMSYBR green master mix均购自美国Thermo Fisher Scientific公司;D-葡萄糖和D-甘露醇购自美国Sigma公司;siRNA由中国广州锐博生物科技有限公司合成;M-MLV 逆转录试剂盒、细胞增殖实验(MTS法)试剂盒购自美国Promega公司;一抗抗体均购于美国Cell Signaling Technolgy公司;硝酸纤维素膜购于德国GE healthcare公司;Cycletest Plus DNA Reagent试剂盒、Annexin V-FITC/PI细胞凋亡检测试剂盒均购自美国BD公司;7500型荧光实时定量PCR仪购自美国ABI公司;流式细胞仪购于美国BD公司;Axiovert 200倒置相差荧光显微镜购自德国Carl Zeiss公司。
1.2 细胞培养
H9C2细胞培养于含10% FBS、1×105U/L 青霉素和100 mg/L链霉素的低糖(5.5 mmol/L葡萄糖)DMEM培养基中,于37℃、5% CO2培养箱中培养,待细胞接近80% 融合时用0.05% 胰蛋白酶消化传代。倒置相差荧光显微镜下观察细胞及图像记录。
1.3 脂质体转染小干扰RNA(siRNA)
将对数生长期的H9C2接种于多孔培养板,用阳离子脂质体介导的方法将终浓度为50 nmol/L的MD2基因小干扰RNA(si-MD2)按组别转染入细胞,以相同方法转染一段长度和结构都与siRNA类似的随机序列寡核苷酸双链作为阴性对照(negative control,NC)。具体转染步骤根据LipofectamineTMRNAi MAX 转染说明书。si-MD2序列:5’-CCAATGGATTTGTGCATGTTT-3’ 和5’-ACATGCAC AAATCCATTGGTT-3’。
1.4 实验分组
实验共分为4组,LG组: 33 mmol/L甘露醇;HG组: 33 mmol/L D-葡萄糖;HG + NC组: 50 nmol/L NC + 33 mmol/L D-葡萄糖;HG + si-MD2组: 50 nmol/L si-MD2 + 33 mmol/L D-葡萄糖。H9C2细胞按1.3方法转染siRNA 24 h后,加入终浓度为33 mmol/L的D-葡萄糖刺激48 h,对照组加入33 mmol/L的 D-甘露醇用于排除渗透压作用干扰。
1.5 细胞 RNA提取及RT-qPCR
Trizol试剂法分别提取4组细胞的总RNA,逆转录合成 cDNA后进行RT-qPCR检测各细胞中MD2、肿瘤坏死因子α(tumor necrosis factor alpha, TNF-α)、白介素1β(interleukin 1β, IL-1β)、白介素6(interleukin 6, IL-6) 的mRNA水平。以GAPDH为内参,用2-ΔΔCt法分析目的基因相对表达量,计算公式为: ΔCt=Ct目的基因-Ct内参, ΔΔCt=ΔCt实验组-ΔCt对照组, 相对表达量=2-ΔΔCt。内参GAPDH的上游引物为5' TATGACTCTACCCACGGCAAG 3',下游引物为5' ATACTCAGCACCAGCATCACC 3';MD2的上游引物为5' TATTTACTGAATCTGAGAGGC 3',下游引物为5' GAATGAACTCAACATGCAC 3'; TNF-α的上游引物为5' TACTCCCAGGTTCTCTTCAAGG 3',下游引物为5' CTCCAGCTGCTCCTCCGCTTG 3';IL-1β的上游引物为5' CACCTCTCAAGCAGAGCACAG 3',下游引物为5' GGGTTCCATGGTGAAGTCAAC 3';IL-6的上游引物为5' TGGAGTTCCGTTTCTACCTG 3',下游引物为5' CTTAGCCACTCCTTCTGTGA 3'。RT-PCR 扩增条件为:95℃预变性10 min;95℃变性15 s,60℃退火延伸60 s,共40个循环,反应体系为20 μl。
1.6 细胞增殖实验
对数生长期的H9C2细胞以3×103cells/well均匀接种到96孔板中,每组设6个复孔。按上述方法处理细胞48 h后,弃去培养基,于每孔中加入85 μl无血清F12培养液和15 μl MTS混合液,于37℃孵育2 h后,用酶标仪在490 nm波长下读取吸光度(A),计算相对细胞数目= 实验组A值/对照组A值×100%。
1.7 流式细胞术检测细胞周期及细胞凋亡
将上述4个组别的细胞用0.05% 胰蛋白酶消化并收集,按Cycletest Plus DNA Reagent试剂盒和Annexin Ⅴ-FITC细胞凋亡检测试剂盒说明书操作,然后用流式细胞仪检测细胞周期变化情况及细胞凋亡水平,右上与右下两个象限百分率之和即是细胞凋亡率。
1.8 Western blot法检测细胞内相关蛋白的表达情况
将上述4个组别的细胞用RIPA裂解液裂解,提取各组细胞的总蛋白。蛋白经SDS聚丙烯酰胺凝胶电泳分离后转移至硝酸纤维素膜上,经5% 脱脂奶粉-PBST封闭液封闭3 h后,按1∶1 000稀释一抗抗体,于 4℃孵育过夜,经PBS洗脱后再用1∶5 000的带有荧光基团标记的二抗室温孵育2 h,最后在Odyssey Licor双色红外激光成像仪上进行曝光成像,然后通过image pro plus软件计算灰度值,计算目的蛋白的相对表达量=目的蛋白的灰度值/内参GAPDH的灰度值。
1.9 统计学处理
2 结果
2.1 siRNA转染后细胞中MD2水平的变化
为了研究MD2基因沉默对高糖处理后的心肌细胞的影响,我们设计了MD2的siRNA用于转染细胞以求达到基因沉默的目的。结果如图1和表1所示,转染si-MD2后,细胞中MD2 mRNA和蛋白水平均显著下降(P<0.01),说明通过小 RNA 干扰技术达到MD2 基因沉默的效果。

Fig.1The protein expression levels of MD2 in the H9C2 cells tested by Western blot
Mock: Blank control; NC: Negative control; si-MD2: MD2 siRNA


GroupmRNA levelProtein levelMock1.01±0.010.59±0.03 NC0.97±0.110.50±0.03 si-MD20.32±0.04**0.08±0.01**
Mock: Blank control; NC: Negative control; si-MD2: MD2 siRNA
**P<0.01vsNC group
2.2 MD2基因沉默对高糖处理后炎症因子TNF-α、IL-1β、IL-6的表达的影响
RT-qPCR检测4组H9C2细胞内炎症因子TNF-α、IL-1β、IL-6的表达水平。HG 组TNF-α、IL-1β、IL-6的mRNA相对水平与LG组相比显著升高(P<0.01);相较HG + NC组,HG + si-MD2组的TNF-α、IL-1β、IL-6 mRNA相对水平显著下调(P< 0.05,表2)。


GroupTNF-αIL-1βIL-6LG1.04±0.031.05±0.061.02±0.02HG2.38±0.48**3.56±0.45**2.19±0.10**HG + NC2.88±0.844.05±0.292.36±0.22HG + si-MD21.20±0.06#1.48±0.13##1.32±0.09##
TNF-α: Tumor necrosis factor alpha; IL-1β: Interleukin 1β; IL-6: Interleukin 6
**P<0.01vsLG group;#P<0.05,##P<0.01vsHG + NC group
2.3 MD2基因沉默对高糖处理后的心肌细胞增殖能力的影响
MTS实验结果显示HG组的相对细胞数目为(85.19±0.65)%,与LG组(100%)相比明显减少 (P<0.01);而HG + si-MD2组的相对细胞数目为 (94.73±1.22) %,显著高于HG + NC组的(80.89±0.74)% (P<0.01)。结合显微镜对细胞状态的图像记录(图2)可以看出,高糖处理抑制心肌细胞的增殖,而MD2基因沉默可以促进高糖处理后的心肌细胞增殖。

Fig.2The effects ofMD2 gene silencing on the proliferation of H9C2 cells treated with high glucose. Photographs of cells following transfection 48 h were taken by optical microscope (uncolored ×200)
LG: Low glucose; HG: High glucose; NC: Negative control; si-MD2: MD2 siRNA
2.4 MD2基因沉默对高糖处理后的心肌细胞细胞周期的影响
流式细胞术结果显示,HG组细胞滞留在G0/G1的细胞数(54.96±0.37)% 较LG组(41.73± 0.61)% 明显增多,而S期细胞从LG组的(46.57± 0.94)% 减少到(31.60±1.13)% (P<0.01)。MD2基因沉默后,HG + si-MD2组滞留在G0/G1的细胞数为 (45.14±1.59) %,显著少于HG + NC组的(54.42±1.31)% (P<0.01),而S期细胞从HG + NC组的(32.44±1.07)% 增多到(39.71±1.12)% (P<0.01,图3)。

Fig.3The effects ofMD2 gene silencing on the cell cycle of H9C2 cells treated with high glucose. The most representative results in three independent experiments are depicted
LG: Low glucose; HG: High glucose; NC: Negative control; si-MD2: MD2 siRNA
2.5 MD2基因沉默对高糖处理后的心肌细胞凋亡率的影响
流式细胞术分析发现HG 组的细胞凋亡率为(8.30±0.25)%,显著高于LG组的(3.86±0.36)% (P<0.01);与HG + NC组的(7.65±1.04)% 相比,HG + si-MD2组的细胞凋亡率为(5.78±0.22)%,显著下降(P<0.01,图4)。结果说明高糖诱导心肌细胞凋亡,而MD2基因沉默可以减少高糖诱导的心肌细胞凋亡。

Fig.4The effects ofMD2 gene silencing on the apoptotic rate of H9C2 cells treated with high glucose. The most representative results in three independent experiments are depicted
LG:Low glucose; HG: High glucose; NC: Negative control; si-MD2: MD2 siRNA
2.6 MD2基因沉默对高糖处理后心肌细胞中Cleaved Caspase-3蛋白水平的影响
Western blot实验结果显示高糖处理的心肌细胞中凋亡信号分子Cleaved Caspase-3蛋白相对表达量为(0.119±0.004),较低糖组的(0.05±0.007)显著升高(P<0.01) ;与HG + NC组的(0.141± 0.006)相比,HG + si-MD2组的Cleaved Caspase-3蛋白相对表达量为 (0.096±0.006),显著下降(P< 0.01,图5)。
2.7 MD2基因沉默对高糖处理后的ERK1/2、P38 MAPK、JNK蛋白磷酸化水平的影响
Western blot实验结果显示:与LG组相比,HG组细胞中ERK1/2、P38 MAPK、JNK蛋白的磷酸化水平明显升高(P<0.01);而HG + si-MD2组细胞中ERK1/2、P38 MAPK、JNK蛋白的磷酸化水平与HG + NC组相比明显下降(P<0.01,图6,表3)。说明MD2基因沉默可以抑制高糖诱导的ERK1/2、P38 MAPK、JNK蛋白磷酸化。

Fig.5The effects ofMD2 gene silencing on Cleaved Caspase-3 protein expression level of H9C2 cells treated with high glucose
LG:Low glucose; HG: High glucose; NC: Negative control; si-MD2: MD2 siRNA

Fig.6The effects ofMD2 gene silencing on phosphorylation of ERK1/2, P38 MAPK and JNK protein of high glucose-induced H9C2 cells
LG:Low glucose; HG: High glucose; NC: Negative control; si-MD2: MD2 siRNA
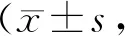

Groupp-ERK1/2/ERK1/2p-P38 /P38p-JNK/JNKLG0.31±0.020.66±0.020.19±0.01HG0.96±0.04**0.93±0.03**1.05±0.03**HG + NC1.03±0.010.93±0.020.88±0.06HG + si-MD20.55±0.02##0.61±0.03##0.20±0.01##
**P<0.01vsLG group;##P<0.01vsHG + NC group
3 讨论
糖尿病心肌病发病机理复杂,独立于高血压病、冠状动脉疾病和其它已知重大心脏瓣膜疾病[12]。近些年研究发现,慢性炎症反应以炎症标志物升高为特征,成为糖尿病心肌病的重要病理因素之一[13]。高糖能激活组织或胞内的损伤应激相关信号通路,直接诱导心肌细胞中炎症因子、趋化因子和黏附分子的分泌增加[14]。因此阻断炎症反应及其相关靶点有望成为今后DCM 治疗的重要策略。已有研究显示汉黄芩素在STZ糖尿病小鼠中表现出抗炎和抗氧化应激的特性,可以通过抑制炎症和氧化应激来减轻高血糖诱导的心肌细胞损伤[15]。Pan等人的研究发现抗炎化合物姜黄素[5]可以通过抑制NF-κB激活、减少炎症因子的产生而作为糖尿病心肌病的潜在治疗剂。
TNF-α、IL-1β、IL-6-是机体炎症反应和免疫应答的重要炎症因子,能激活细胞内信号通路,引起细胞异常增殖、分化及合成多种炎症因子等一系列生理生化改变。本研究证实高糖处理48 h的H9C2细胞内上述炎症因子表达上调,细胞增殖能力下降。细胞周期检测结果表明,高糖处理导致H9C2细胞滞留在G0/G1期,这可能是H9C2细胞增殖受到抑制的原因之一。而MD2基因沉默显著抑制高糖刺激的 H9C2 细胞内TNF-α、IL-1β、IL-6的表达,明显减少滞留在G0/G1期的细胞,促进高糖处理后的心肌细胞增殖。已有报道MD2小分子抑制剂可以阻断MD2与TLR4的结合,显著减轻LPS诱导的细胞炎症反应[16]。Wang等人的工作发现饱和棕榈酸能通过直接结合TLR4辅助蛋白MD2诱导心肌炎性损伤[17]。此外,Fang等人的最新研究表明MD2通过激活炎症途径中的JNK / ERK和NF-κB炎症通路,在肥胖诱导的心脏肥大发挥至关重要的作用[18]。我们推测MD2表达下调可抑制炎症信号通路,减轻高糖所致的心肌细胞炎症损伤,使细胞活性得到明显提高,从而促进高糖处理后的心肌细胞增殖。
无论在糖尿病患者和糖尿病动物模型中,心肌细胞凋亡都是持续高血糖的关键病理结果[19]。细胞凋亡是机体自身进行的一种程序性死亡,在多种心血管疾病发生发展过程中都伴有心肌细胞凋亡[20]。本研究发现MD2基因沉默可以减少高糖诱导的心肌细胞凋亡,显著降低细胞中Caspase-3 活化水平。可能MD2基因沉默通过抑制Caspase-3的活性,从而抑制高糖诱导的细胞凋亡。
丝裂原活化蛋白激酶 MAPK信号通路是涉及了多级蛋白激酶的级联反应,参与了糖尿病心肌病最重要的细胞损伤和炎症反应的病理过程[21-23]。其家族成员ERK1/2[24, 25], JNK[25]和p38 MAPK[26]能够被多种胞外刺激激活,将信号从细胞膜表面受体转导至细胞核,调控着细胞周期、细胞增殖、细胞凋亡和炎症等多种生物学反应。所以我们通过Western blot检测ERK1/2、P38 MAPK、JNK蛋白的磷酸化水平,结果显示MD2基因沉默可以抑制高糖诱导的ERK1/2、P38 MAPK、JNK蛋白激活。
综上所述,MD2基因沉默可能通过抑制ERK、P38 MAPK和JNK信号通路的激活来减少高糖诱导的大鼠心肌细胞炎症细胞因子表达,减少细胞凋亡,促进细胞增殖。本研究首次探索了MD2基因沉默对高糖诱导的心肌细胞损伤、炎症发生过程的影响及作用机制,或能为有效预防和治疗糖尿病心肌病提供新的思考和方案。
