基于无机载体的先交联后吸附固定化脂肪酶的方法
2019-07-02林海蛟张云孙爱君黄锦煜胡云峰
林海蛟,张云,孙爱君,黄锦煜,胡云峰
(1.中国科学院南海海洋研究所∥中国科学院热带海洋生物资源与生态重点实验室, 广东 广州 510301; 2.南方医科大学口腔医院, 广东 广州 510280; 3.中国科学院大学, 北京 100049)
脂肪酶(lipase, EC 3.1.1.3)是一种重要的酯水解工业用酶,能够将甘油三酯水解成甘油和脂肪酸.脂肪酶的来源广泛,存在于动物、植物和微生物中.脂肪酶在食品、农业和医药等领域有广泛应用,展现出很大的工业应用价值[1-4].但是,在实际应用中,游离脂肪酶对环境非常敏感,具有不稳定性和易变性[5],而且脂肪酶的价格一般很高,游离脂肪酶不易回收,这些缺陷使得脂肪酶的工业应用受到很大限制.
发展酶的固定化技术是为了克服游离脂肪酶的缺陷.常见的固定化方法有吸附法、包埋法、交联法及共价结合法等.这4种方法各具优缺点,因此单独使用某一种固定化方法达不到最优的固定化效果.本实验采用先交联后吸附的固定化方法来固定化脂肪酶.交联法是利用双功能或多功能试剂在酶分子间或者酶分子与载体间发生交联反应而凝集成网状结构的一种方法[6-7].吸附法是通过酶分子与载体表面以范德瓦耳斯力结合在一起的一种固定化方法,虽然结合力较弱但对酶的损害很小[7-8].因此,交联法和吸附法结合进行固定化脂肪酶,能够达到互补其短的效果.
在酶的固定化制剂的研究中,固定化载体的选择是一个重要的因素[9-10].固定化载体的种类繁多,有无机载体、有机载体、纳米载体等[10].相比其他载体,无机载体具有无毒、稳定性好、价格低廉、来源丰富等优点.在无机载体中,硅藻土尤为突出,具有价格低廉和性质稳定等优点.比如,高贵等[11]利用硅藻土来吸附固定化脂肪酶;杨艳红等[12]以硅藻土为载体,利用吸附法固定化中性脂肪酶;顾旭炯等[13]以硅藻土为载体,利用吸附法同时固定糖化酶和α-淀粉酶双酶体系.此前,研究人员大多使用吸附载体先对工业酶进行吸附,再使用交联剂对吸附在载体上的工业酶进行交联以提高固定化酶的稳定性,但是这种方法中对工业酶的吸附主要是依赖吸附载体对酶的吸附能力.
在交联法的使用当中,通常的方法是在酶分子与载体吸附或包埋固定化之后再进行交联固定化.比如,徐珊等[14]以海藻酸钠为载体包埋固定化脂肪酶,再用乙二醇缩水甘油醚交联剂进行交联;钱明华等[15]先利用大孔吸附树脂吸附脂肪酶,再用环氧交联剂聚乙二醇二缩水甘油醚进行交联;许超群等[16]先利用壳聚糖吸附黑曲霉β-葡萄糖苷酶,再以戊二醛为交联剂进行交联.然而,对于先对酶进行交联再进行吸附固定化的研究较少.可能原因是戊二醛等化学交联剂的化学交联反应相对激烈,酶分子直接与交联剂接触可能导致酶活性损失较多.
本实验室曾利用硅藻土先吸附后交联法固定化脂肪酶[17],此方法先用硅藻土载体吸附海洋脂肪酶,吸附结束后酶分子已经被固定在硅藻土的孔隙中,此时进行化学交联能进一步增加酶分子与载体的结合稳定性.本研究是在酶分子与载体吸附之前,先利用较为温和的环氧双功能交联剂对脂肪酶进行交联,避免造成酶活性损失较大,同时又保证交联剂促使酶分子的交联,使酶分子之间以稳定的共价键形式结合在一起,提高了吸附前酶聚集的效率.
因为吸附与交联先后顺序存在差异,本研究对先交联后吸附法制备固定化脂肪酶的工艺技术进行了较为系统的研究.此先交联后吸附的固定化方法能够给后续酶的固定化研究提供参考.
1 材料与方法
1.1 材料与仪器
材料:海洋(假丝酵母)脂肪酶(上海鼓臣生物有限公司)、硅藻土、聚乙烯醇PVA(天津市大茂化学试剂厂)、橄榄油(上海麦克林生化科技有限公司)、无水乙醇、异辛烷(天津市津东天正精细化学试剂厂)、新戊二醇二缩水甘油醚(上海麦克林生化科技有限公司).
仪器:PB-10酸度计(德国Sartorus公司)、Allegra X-30R Centrifuge型离心机(Beckman, Coulter)、移液枪(吉尔森公司)、DJS-2012R型恒温摇床(上海实维实验仪器技术有限公司)、电热鼓风箱(上海一恒科学仪器有限公司)、涡旋振荡器(Tomos)、DK-8D水浴锅(上海一恒科学仪器有限公司)、SCIENTZ-IID 型超声破碎仪(宁波新芝生物公司)、超声清洗仪(宁波新芝生物公司).
1.2 实验方法
1.2.1 脂肪酶活力的测定
酶活力:在测定条件(40 ℃,pH 7.0)下,每s催化1 mol底物转化为脂肪酸所需的酶量[18].
相对酶活力:在同一组实验中,设定酶活力最高的一组为100%,其余组别的酶活力与之相比,用百分比表示[17].
酶活力的测定:采用改进铜皂分光光度法[19-20].
1.2.2 固定化酶活力回收率[20-23]
酶活力回收率=

1.3 脂肪酶交联实验方法
1.3.1 交联剂的筛选
将脂肪酶粉剂溶解于柠檬酸-柠檬酸钠缓冲液,配制成质量浓度为2 g/mL的脂肪酶酶液.离心后取10 mL置于50 mL的离心管中,分别加入戊二醛、乙二醇缩水甘油醚、新戊二醇二缩水甘油醚和聚乙二醇二缩水甘油醚4种交联剂,放在恒温摇床上交联一定时间.交联结束后加入硅藻土载体吸附,再继续放在恒温摇床中固定化.吸附结束后将固定化酶抽滤、常温烘干、测定酶活力.
1.3.2 交联剂质量分数优化
在10 mL酶液中加入质量分数分别为0、0.1%、0.5%、1.0%、1.5%、2.0%、2.5%的新戊二醇二缩水甘油醚.放在恒温摇床交联一定时间,吸附条件不变,吸附结束后将固定化酶抽滤、常温烘干、测定酶活力.
1.3.3 交联pH优化
配制浓度为0.02 mol/L的柠檬酸-柠檬酸钠缓冲液,调节pH分别为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5.将质量为0.1 g酶粉剂溶解于上述系列缓冲液,加入质量分数为1.0%的新戊二醇二缩水甘油醚交联剂,放在恒温摇床交联一定时间,吸附条件不变,吸附结束后将固定化酶抽滤、常温烘干、测定酶活力.
1.3.4 交联温度优化
将脂肪酶溶解于pH 5.0的柠檬酸-柠檬酸钠缓冲液中,加入质量分数为1.0%的新戊二醇二缩水甘油醚的交联剂,分别在20、25、30、35、40、45、50、55 ℃的恒温摇床中交联一定时间,吸附条件不变,在吸附结束后将固定化酶抽滤、常温烘干、测定酶活力.
1.3.5 交联时间优化
将脂肪酶溶解于pH 5.0的柠檬酸-柠檬酸钠缓冲液中,加入质量分数为1.0%的新戊二醇二缩水甘油醚,在35 ℃的恒温摇床中分别交联1、2、4、6、8 h,吸附条件不变,吸附结束后将固定化酶抽滤、常温烘干、测定酶活力.
1.3.6 交联正交实验
在单因素实验的基础上选择对固定化影响较大的因素设计3水平4因素的正交实验,以相对酶活力为指标,正交实验的因素与水平见表1.
表1 交联正交实验因素与水平
Table 1 Cross-linking orthogonal experimental factors and levels

pHθ/℃w/%t/h14.5300.1125.0350.5235.5401.03
1.4 脂肪酶吸附实验方法
1.4.1 吸附温度优化
交联固定化结束后,加入硅藻土载体,分别在20、25、30、35、40、45、50、55 ℃的恒温摇床中吸附一定时间.吸附结束后将硅藻土取出,抽滤、烘干、测定酶活力.
1.4.2 吸附载体量优化
交联固定化结束后,分别加入质量为0.5、1.0、1.5、2.0、2.5、3.0 g的硅藻土载体,在35 ℃的恒温摇床中吸附一定时间,其他条件与1.4.1同.
1.4.3 吸附时间优化
交联固定化结束后,加入质量为1.5 g的硅藻土载体,在35 ℃的恒温摇床中分别吸附1、2、4、6、8 h,其他条件与1.4.2同.
1.4.4 吸附正交实验
在单因素实验的基础上选择对固定化影响较大的因素设计3水平4因素的正交实验,以相对酶活力为指标,正交实验的因素与水平见表2.
表2 吸附正交实验因素与水平
Table 2 Adsorption orthogonal experimental factors and levels

θ/℃m/gt/h1301.042351.553402.06
1.5 固定化酶的酶学性质鉴定
1.5.1 最适反应温度
保持反应缓冲液不变,分别在不同的温度(25 ℃~55 ℃,每隔5 ℃设一个梯度)下测定固定化酶与游离酶的酶活力.
1.5.2 最适反应pH
用浓度为0.05 mol/L的磷酸钠缓冲液分别设置5.0、5.5、6.0、6.5、7.0、7.5、8.0的pH梯度,在40 ℃下测定固定化酶和游离酶的最适反应pH.
1.5.3 热耐受性
分别将固定化酶和游离酶在不同的温度环境(30 ℃~70 ℃,每隔10 ℃设置一个梯度)放置3 h,再测定酶活力,探究固定化酶和游离酶对热的耐受性.
1.5.4 pH耐受性
分别将固定化酶和游离酶在不同的pH环境(5.0~9.0,每隔1.0设置一个梯度)放置3 h,再测定酶活力,探究固定化酶和游离酶对酸碱的耐受性.
1.5.5 储存稳定性
将制备好的固定化酶抽滤、烘干,放置在4 ℃冰箱保存.每隔一定时间测定其酶活力,以第1次测得的酶活力为100%,探究固定化酶的储存稳定性.
1.5.6 操作稳定性
将制备好的固定化酶抽滤、烘干,准确称取质量0.1 g,在40 ℃,pH 7.0的条件下连续反应6次,以第1次测得的酶活力为100%,探究固定化酶的操作稳定性.
2 结果与分析
2.1 固定化条件对交联效果的影响
2.1.1 交联剂的筛选
本实验选择了戊二醛、新戊二醇二缩水甘油醚、聚戊二醇二缩水甘油醚和乙二醇缩水甘油醚4种交联剂进行筛选,设置不添加任何交联剂的空白组作为对照.结果显示以新戊二醇二缩水甘油醚为交联剂时,固定化效果最好,因此选择新戊二醇二缩水甘油醚作为后续实验的交联剂.在这4种交联剂中,由于戊二醛具有一定毒性,与酶的交联反应剧烈,对酶蛋白活性的损害比较大,因此比空白组酶活力低.其余3种交联剂属于新型环氧交联剂,环氧基团与酶的交联反应相对温和可控,对酶的活性损害较小.
本实验结果显示所筛选出的最佳交联剂为新戊二醇二缩水甘油醚,而此前先吸附后交联实验中筛选出的最佳交联剂为乙二醇缩水甘油醚[17].可能原因是新戊二醇二缩水甘油醚和乙二醇缩水甘油醚相比,与脂肪酶发生的化学反应更有利于脂肪酶的共价交联聚集和酶活力的保留.
2.1.2 交联剂质量分数优化
使用质量分数分别为0.1%、0.5%、1.0%、1.5%、2.0%、2.5%的新戊二醇二缩水甘油醚,交联吸附后测定酶活力.随着交联剂质量分数增加,固定化效果逐渐提升,在质量分数为1.0%时达到最佳固定化效果;之后随着质量分数增加酶活力呈下降趋势,因此最适交联剂质量分数为1.0%(图1A).新戊二醇二缩水甘油醚交联剂在低剂量时,酶分子之间结合较弱.随着交联剂质量分数升高酶分子之间结合逐渐增强,在交联剂质量分数过高时,交联反应比较激烈[18],过高的交联剂质量分数加剧了酶活力损失,导致酶活力下降.
2.1.3 pH对交联固定化的影响
使用柠檬酸-柠檬酸钠缓冲液进行pH对脂肪酶交联固定化影响实验.随着pH的增大酶活力也逐渐增大,在pH 5.0时达到最高值,之后酶活力随着pH增大而下降.说明强酸性环境对海洋脂肪酶的交联固定化有很大的影响(图1B).
2.1.4 温度对交联固定化的影响
随着交联温度升高,固定化脂肪酶的酶活力也逐渐提升,35 ℃时达到最高值;之后酶活力随着温度升高而缓慢下降(图1C).温度从低温逐渐升高时,酶分子的热运动逐渐变快[22];但是过高的温度会使蛋白质变性,当温度升高到35 ℃之后,酶蛋白的结构和功能受到影响,因此酶活力下降.
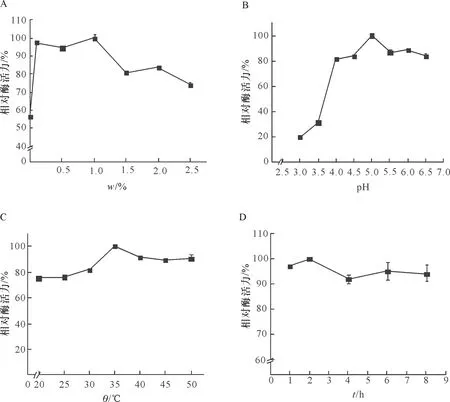
A: 交联剂质量分数对脂肪酶固定化的影响;B: pH对脂肪酶固定化的影响;C: 交联温度对脂肪酶固定化的影响;D: 交联时间对脂肪酶固定化的影响.A: Effect of crosslinker’s concentration on the immobilization of lipase; B: Effect of pH on the immobilization of lipase; C: Effect of temperature on the immobilization of lipase; D: Effect of immobilizing time on the immobilization of lipase.
2.1.5 时间对交联固定化的影响
随着交联时间的增加酶活力逐渐增大,在2 h时达到最大值,之后酶活力随时间增加而下降(图1D).随着交联的进行,交联剂逐渐发挥作用使酶分子发生联结,在2 h时达到峰值.随后继续交联可能会使已经联结的酶分子分离或失活,从而导致酶活力下降.
2.1.6 交联正交实验结果
设置4因素3水平的正交表,得出最佳交联pH是5.5,最佳交联温度是35 ℃,最佳交联剂质量分数是0.5%,最佳交联时间是2 h.主次影响因素:pH≻温度≻时间≻质量分数(表3).
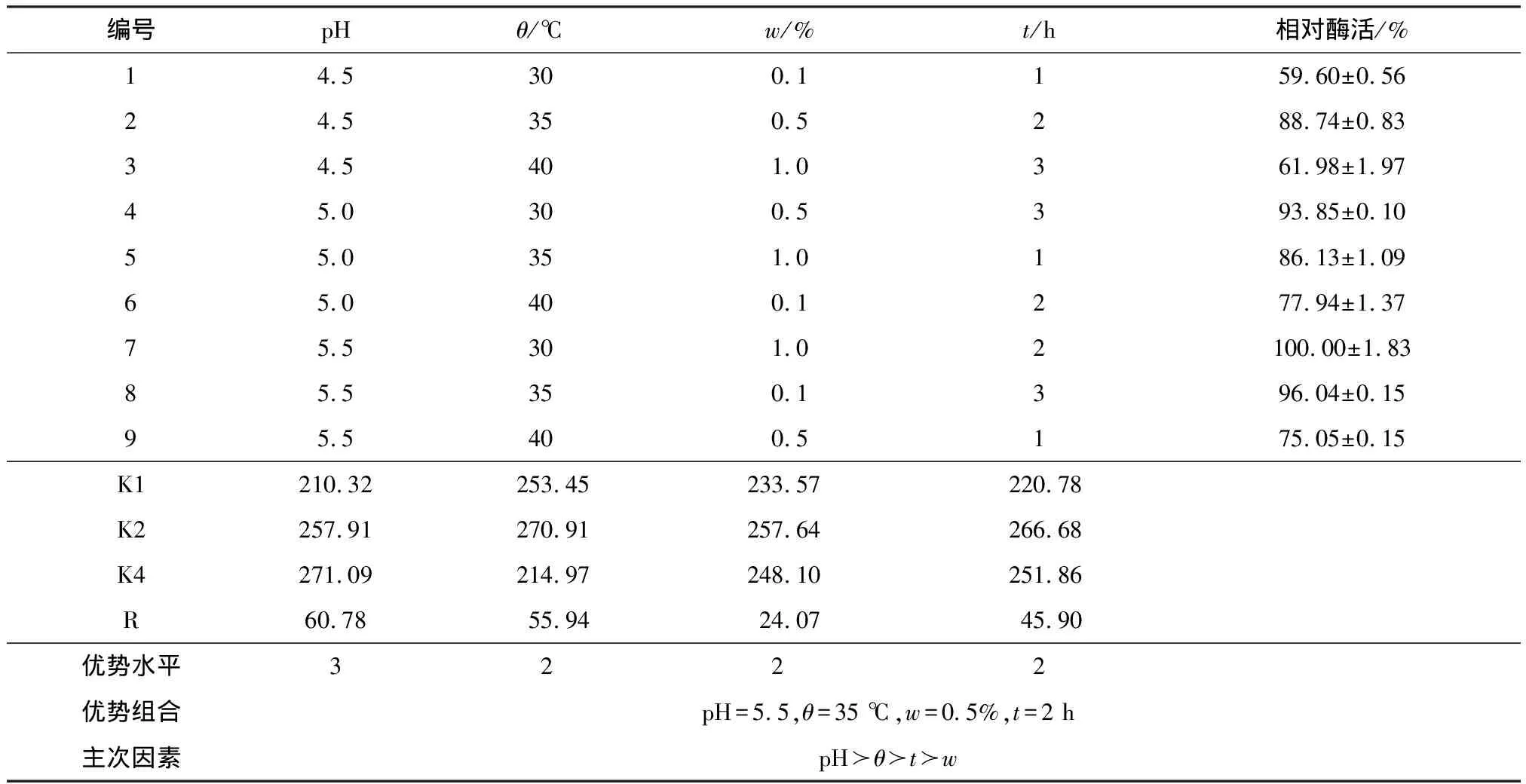
表3 交联正交实验结果与分析Table 3 Cross-linked orthogonal experiment results and analysis
2.2 脂肪酶吸附实验
2.2.1 温度对吸附固定化的影响
随着温度升高固定化酶的酶活力逐渐提升,在35 ℃达到最大值后逐渐下降(图2A).温度对吸附的影响机理与对交联的影响相似,在一定范围内,温度升高时酶分子的热运动变快,吸附效果也逐渐提升.35 ℃后,温度提升可能会使蛋白质变性或者酶从载体上脱落,从而导致吸附效果下降,因此最适吸附温度为35 ℃.
2.2.2 载体质量对吸附固定化的影响
随着载体质量的增加固定化酶的酶活力逐渐提升,在质量为1.5 g时达到最大值后快速下降,因此最适载体质量为1.5 g(图2B).等体积等浓度的酶液中加入不同质量的载体,载体所吸附的酶分子浓度也不相同,亦相当于加入不同浓度的酶液进行吸附固定化.载体质量较少时,单位质量载体所吸附的酶分子过多,造成硅藻土载体孔隙堵塞;载体质量过多时,单位质量载体所吸附的酶分子又过少,所以酶活力开始下降.
2.2.3 时间对吸附固定化的影响
随着吸附时间的增长酶活力逐渐增大,在6 h达到最高,之后下降(图2C).随着吸附时间的延长,硅藻土的孔隙吸附的酶分子逐渐增多,酶活力增强;而当硅藻土载体过长时间浸泡在酶液中,孔隙吸附的酶分子饱和导致阻塞,酶促反应使酶分子不能充分展开,所以酶活力降低.
2.2.4 吸附正交实验
设置3因素3水平的正交表,得出最佳吸附温度是40 ℃,最佳吸附载体质量是1.5 g,最佳吸附时间是5 h(表4).主次影响因素:温度≻载体质量≻时间.综合交联和吸附最优结果,在该条件下固定化酶的酶活力为1.89 μkat,酶活力回收率为72.89%.

A: 温度对脂肪酶吸附固定化的影响;B: 载体质量对脂肪酶吸附固定化的影响;C: 吸附时间对脂肪酶吸附固定化的影响.
A: Effect of temperature on the immobilization of lipase; B: Effect of quality of kieselguhr on the immobilization of lipase; C: Effect of immobilizing time on the immobilization of lipase.

图2 吸附条件对吸附固定化的影响
2.3 酶学性质鉴定
2.3.1 最适反应温度
固定化酶和游离酶分别在25、30、35、40、45、50、55 ℃的温度下测定酶活力,以便测得其最适反应温度.随着反应温度的升高,固定化酶与游离酶的酶活力都逐渐升高,而且都在45 ℃时达到峰值.但是游离酶在最适反应温度45 ℃之前酶活力波动较大,温度超过45 ℃后酶活力急速下降.而固定化酶在25 ℃~45 ℃时酶活力受温度影响较小,超过45 ℃后酶活力下降幅度小.特别是在55 ℃的高温下反应固定化酶能维持80%的酶活力,而该温度下游离酶的酶活力下降到70%左右.因此,相比游离酶,固定化酶的热稳定性有所提高(图3A).
2.3.2 最适反应pH
固定化酶和游离酶液分别在pH为5.0、6.0、7.0、8.0、9.0的条件下测定酶活力.固定化酶的最适反应pH为8.0,而游离酶最适反应pH为6.5.相比游离酶,固定化酶的最适反应pH提高了1.5.游离酶的酶活力变化在65%~100%的范围内,说明游离酶对pH比较敏感,在不同pH环境中反应不稳定.而固定化酶的酶活力变化范围在95%~100%内,说明固定化酶在不同pH环境中反应比较稳定(图3B).
2.3.3 热耐受性
固定化酶和游离酶分别在30、40、50、60、70 ℃的环境中放置3 h,再分别测定剩余的酶活力.环境温度越高,固定化酶和游离酶剩余的酶活力越低.在30 ℃~60 ℃的环境中,两者的酶活力稳步下降;但是当温度超过60 ℃时,游离酶的酶活力急剧下降,而固定化酶的酶活力下降相对缓慢.因此固定化酶的高温热耐受性比游离酶有所提高(图3C).
2.3.4 pH耐受性
固定化酶和游离酶分别在pH为5.0、6.0、7.0、8.0、9.0的环境中放置3 h,再分别测定剩余的酶活力.在pH 5.0~8.0,固定化酶剩余的酶活力明显比游离酶高.因此,在酸性和中性反应环境中,固定化酶的pH耐受性比游离酶好(图3D).
2.3.5 储存稳定性
将固定化酶储存于4 ℃冰箱,每隔一定时间测定其酶活力.固定化酶在4 ℃冰箱储存稳定性较好,虽然随着储存时间增长酶活力有些许下降,但是下降趋势平缓,第42天时保持90.26%的酶活力,2个月后剩余87%以上的酶活力(图3E).因此本研究中制备的固定化酶在低温条件下具有较好的稳定性,酶活性损失较小.
2.3.6 操作稳定性
将固定化酶进行连续反应,测试其机械稳定性.随着操作次数增加,酶活力逐渐降低,第4次操作后酶活力能保留83%,第5次后保留60%以上(图3F).因此本实验制备的固定化酶有较好的操作稳定性.
3 讨论
本研究中,先使用新型双环氧试剂新戊二醇二缩水甘油醚对脂肪酶进行交联固定化,而后使用硅藻土载体进行吸附固定化.通过正交实验,确定了最佳交联固定化工艺条件:最佳交联pH 5.5,最佳交联温度35 ℃,最佳交联剂质量分数0.5%,最佳交联时间2 h.最佳吸附固定化工艺条件:最佳吸附温度40 ℃,最佳吸附载体质量1.5 g,最佳吸附时间5 h.在此工艺条件下,所制备的固定化脂肪酶活力为1.89 μkat,酶活力回收率为72.89%.
在获得交联-吸附最佳条件后,利用该条件制备出固定化脂肪酶,并对脂肪酶的性质进行鉴定.得出:①所制备的固定化酶与游离酶的最适反应温度都是45 ℃.热稳定性基本接近,但是在温度高于60 ℃时,固定化酶的热稳定性明显高于游离酶.②固定化酶的最适pH为8.0,而游离酶的最适pH为6.5,最适反应pH提高1.5.此外,固定化酶的pH稳定性比游离酶有了大的提高,在pH 5.0~8.0下保持很好的稳定性.③固定化酶在4 ℃冰箱保存60 d,依然保持87%以上的酶活力,说明该固定化酶有良好的储存稳定性.④固定化酶连续操作5次后保持60%以上的酶活性,而游离酶只能操作1次,说明该固定化酶具有较好的操作稳定性.
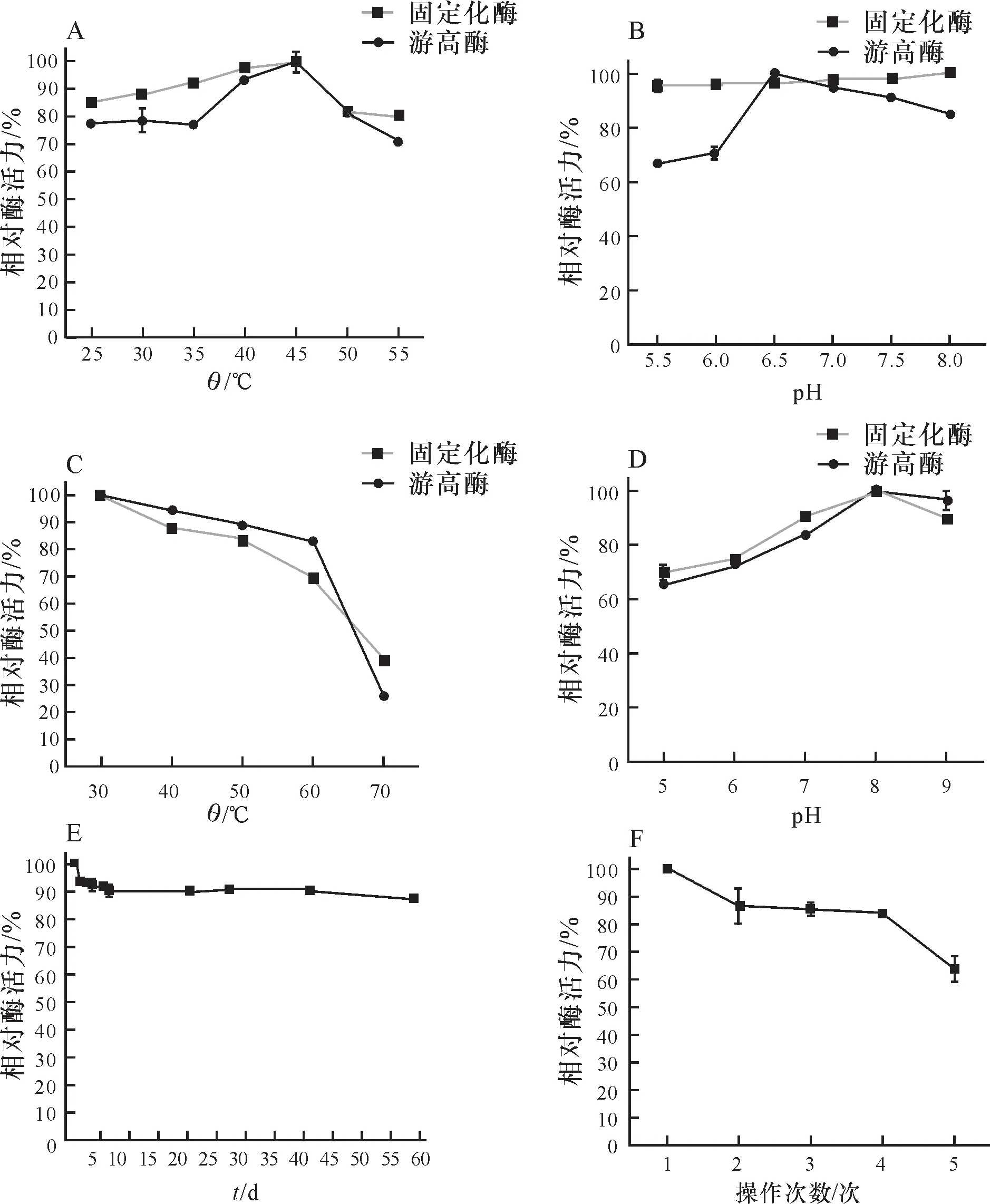
A:最适反应温度;B:最适反应pH;C:热耐受性;D:pH耐受性;E:储存稳定性;F:操作稳定性.
本研究是使用交联-吸附相结合的实验方案,相比于单一固定化方法,交联法和吸附法的结合克服了各自的缺点同时又发挥了各自的优点.同时,本研究选择了新型的环氧交联剂-新戊二醇二缩水甘油醚.此前的固定化工作中,通常选用戊二醛作为双功能交联剂[25-27],但是戊二醛与酶蛋白的交联反应非常剧烈而且不可控,对酶蛋白活力的损害较大[14].相比戊二醛,新型的环氧交联剂与酶蛋白的交联反应较为温和,条件更为可控.在此次交联剂种类筛选实验中,也证明了使用新型的环氧交联剂效果明显优于戊二醛.
本研究采用先交联后吸附的固定化方法,所制备的固定化酶的回收率为72.89%,高于先吸附后交联的固定化方法.比如,本实验室曾利用硅藻土先吸附后交联海洋脂肪酶[17],酶活力回收率为67.31%;孙玉英等[28]使用吸附-交联法固定化混合酶,酶活力回收率为65.00%;鱼园等[29]以硅藻土为载体吸附固定化磷脂酶D,酶活力回收率为65.00%.
综上所述,本研究对先交联后吸附法制备固定化脂肪酶的工艺技术和所制备的固定化酶的性质进行了系统的研究,为后续的基于硅藻土的交联-吸附法固定化工业酶研究提供了参考,相较于先吸附后交联的固定化方法具有一定的优势,有较好的工业应用前景.
