FOXA1、GATA-3与ER在乳腺癌中的表达及预后意义
2019-07-02张继君陶丽丽赵夫娟刘薇薇吴畅
张继君, 陶丽丽, 赵夫娟, 刘薇薇, 吴畅
(1.深圳市南山区人民医院 病理科, 广东 深圳 518000; 2. 北京大学深圳医院 病理科, 广东 深圳 518036)
在大多数乳腺癌中,雌激素受体(estrogen receptor,ER)通过与其他调控元件结合并诱导肿瘤的转录,发挥驱动生长的作用.与缺乏ER表达的乳腺癌患者相比,表达ER的乳腺癌患者具有更长的无病生存期和总体生存率[1],ER是乳腺癌最为重要的预后及预测因素,ER信号通路也被认为是乳腺癌治疗的重要靶点.
根据早期乳腺癌的国际治疗指南,ERα和(或)孕酮受体(progesterone receptor,PR)表达的患者应该接受辅助内分泌治疗.然而,ERα的表达与激素反应之间的联系远没有预期的完美,大约30% ER阳性的肿瘤患者对激素治疗无效,而5%~15%ER阴性的乳腺癌患者却对内分泌治疗有异常反应[2].
叉头框架蛋白A1(forkhead-box protein A1, FOXA1)最早被称为肝细胞核因子3a(HNF3a),是FOX家族转录因子成员之一[3],能够与非转录状态的染色体结合,同时提高其他转录起始因子的基因表达水平及转录效率,从而调节其下游基因的表达[4].最近的乳腺癌Meta分析表明,高水平的FOXA1与ER和PR阳性肿瘤呈正相关[5-6].
GATA结合蛋白3(GATA-3)是GATA家族转录因子之一,这些核蛋白识别靶基因启动子中的G-A-T-A核苷酸序列,激活或抑制这些靶基因[7].GATA-3是参与乳腺上皮细胞腔内分化的基因[8],在T细胞发育过程中发挥重要作用[9].在乳腺中GATA-3在腔上皮的分化和随后分化的上皮细胞导管树的形成中起着核心作用[10],这种蛋白可能也参与了乳腺肿瘤的发生[11].
2004年,Lacroix等[12]通过对乳腺癌组织及其细胞株的DNA微阵列分析,描述了ERα、FOXA1和GATA-3之间可能存在的密切联系和相互作用.FOXA1和GATA-3的基因序列在ESR1结合区富集[13].乳腺癌表达谱分析结果发现GATA-3和FOXA1这两种转录因子与ESR1有功能联系[14].FOXA1和GATA-3在ESR1阴性细胞中的过表达在一定程度上能使其雌激素应答,显示其影响ESR1结合的能力[15], ERα、FOXA1和GATA-3三者共同作为乳腺肿瘤的潜在参与者,调控许多细胞的谱系和分化.然而,FOXA1、GATA-3在乳腺癌细胞中介导ESR1的作用机制尚不清晰,该领域的探讨较少见,本研究在蛋白质表达水平进一步分析ER与FOXA1及GATA-3之间的关系,并根据这3种生物标志物探讨其临床病理特征及其预后意义.
1 材料和方法
1.1 材料
收集2014年5月至2017年8月深圳市南山区人民医院有较完整标本及临床资料的138例原发性非特殊型浸润性乳腺癌,所有病例经过病理确诊.原档案中包括免疫组化ER、PR、Her-2、Ki-67等,以及其他临床信息.根据美国临床肿瘤学会(ASCO)发布的检测指南来评估ER、PR、Her-2的表达情况.ER和PR检测指南(2010)的阳性标准:≥1%的肿瘤细胞核阳性,即判断为阳性.Her-2的判读指南(2013)标准:0为无染色或者≤10%的浸润性癌细胞呈现不完整的、微弱的细胞膜染色;1+为>10%浸润性癌细胞呈现不完整的、微弱的细胞膜染色;2+存在两种情况,第1种模式为>10%浸润性癌细胞呈现不完整的和/或弱至中等强度的细胞膜染色,第2种模式为≤10%的浸润性癌细胞呈现强且完整的细胞膜染色;3+为>10%的浸润性癌细胞呈现强且完整的细胞膜染色.0及1+为阴性;3+为阳性;对于2+的病例用荧光原位杂交(fluorescence in situ hybridization,FISH)进一步检测.138例非特殊型浸润性乳腺癌患者年龄为25~81岁,平均(48.7±0.86)岁;肿瘤直径0.5~8 cm(其中1例肿瘤直径无法测量),平均(2.48±0.11)cm,其他病理特征及肿瘤参数详见表1.
表1 138例浸润性乳腺癌的病理特征和肿瘤参数
Table 1 Patient characteristic and tumour parameters of 138 cases of breast cancer

n(%)n(%) 32(23.2) 99(71.7) 7(5.1) Ⅰ16(11.6) Ⅱ73(52.9) Ⅲ49(35.5)(ERα) 108(78.2) 30(21.7) 0(0.0)(Her-2) 30(21.7) 104(75.4) 4(2.9)/ 74(53.6) 1~336(26.1) 4~912(8.7) >1012(8.7) 4(2.9)Nottingham (NPI) <3.466(47.8) 3.4~5.451(37.0) >5.415(10.9) 6(4.3)(PR) 84(60.9) 54(39.1) 0(0.0)
1.2 方法
所有标本均采用体积分数为10%的中性福尔马林固定,经脱水、石蜡包埋,4 μm厚度切片及免疫组化EnVision两步法检测.FOXA1和GATA-3均为鼠抗人单克隆抗体,购于福州迈新公司.具体操作步骤均按照试剂盒说明书进行,其中GATA-3为即用型试剂,FOXA1为浓缩液抗体,稀释体积比为1∶100.正常乳腺组织作为FOXA1的阳性对照;膀胱尿路上皮癌作为GATA-3的阳性对照.磷酸缓冲盐溶液(phosphate buffer saline,PBS)代替一抗作为空白对照,采用二氨基联苯胺(diaminobenzidine,DAB)显色,苏木精对比染色.
1.3 结果判定
FOXA1、GATA-3和ER蛋白均在癌细胞的细胞核表达,其中FOXA1、GATA-3的评分方法参照Thorat等[16]所采用的半定量评分系统.在这个评分系统中,阳性表达的百分率被分成11个等级,即0=无肿瘤细胞核表达;1=1%~10%阳性肿瘤细胞核;2=11%~20%阳性肿瘤细胞核……,直到最高分值10=91%~100%阳性肿瘤细胞核.强度评分如下:1+为弱染色;2+为中等染色;3+为强染色.最终得分为阳性表达及强度得分之积,总分0~3为阴性,4~30为阳性.
1.4 统计学处理

2 结果
2.1 FOXA1、GATA-3 和 ER在乳腺癌组织与癌旁正常乳腺组织均有表达
在138例乳腺癌标本中,仅对那些在细胞核清晰表达FOXA1和GATA-3蛋白的病例进行免疫组化分类.免疫组化染色积分≥4分为阳性,FOXA1和GATA-3的总体阳性率分别为40.6%(56/138)和66.7%(92/138).FOXA1、GATA-3、ER在癌组织和部分邻近的正常导管上皮细胞中均有表达,但正常导管上皮细胞表达率明显低于癌组织(图1A、B和C).选择3张具有代表性的病例展示3种蛋白分别在乳腺癌各亚型中表达情况(图2),其中包括管腔型(图2, A1~A8)、基底样亚型(图2,B1~B8)和Her-2过表达亚型(图2,C1~C8).

A: FOXA1在正常乳腺组织及癌组织中表达;B:GATA-3在正常乳腺组织及癌组织中表达;C: ER在正常乳腺组织及癌组织中表达.
A: FOXA1 expression in normal breast and cancer tissues;B: GATA-3 expression in normal breast and cancer tissues;C: ER expression in normal breast cancer tissues.
图1 FOXA1、GATA-3和ER在正常乳腺组织及乳腺癌组织中的表达(×20)
Fig.1 FOXA1, GATA-3 and ER expression in normal breast tissues and breast cancer tissues(×20)
2.2 FOXA1和GATA-3与病理参数的关系
FOXA1的表达与肿瘤大小(r=-0.255,P=0.003)、诺丁汉预后指数(r=-0.284,P=0.001)、组织学分级(r=-0.406,P=0.000)均呈负相关;GATA-3的表达也与肿瘤大小(r=-0.215,P=0.012)、诺丁汉预后指数(r=-0.237,P=0.006)、组织学分级(r=-0.420,P=0.000)呈负相关(表2).
2.3 FOXA1和GATA-3与乳腺癌分子分型的关系
根据2013年St Gallen国际会议专家组[17]确认的乳腺癌免疫组化分类法,将乳腺癌分为4种分子亚型:管腔A型(ER阳性,且PR阳性细胞数比例≥20%;Her-2阴性,Ki-67低表达);管腔B型(分为两类,一类为ER阳性,PR阳性细胞数比例<20%,Her-2阴性,Ki-67高表达;另一类为ER阳性,PR<20%,Her-2阳性);Her-2过表达型(ER和PR均阴性,Her-2阳性);三阴型(ER、PR和Her-2均为阴性).FOXA1与GATA-3在4组乳腺癌中表达存在差异,而且FOXA1与GATA3在管腔A型乳腺癌中的表达率均明显高于其他各组(P<0.05)(表3).
2.4 FOXA1和GATA-3与乳腺癌其他分子标记的关系
通过对这两种转录因子与其他重要的免疫组织化学标记物的评价,发现这两种转录因子与基底样表型标记有很强的负相关,GATA-3的表达与CK 5/6呈负相关(r=-0.413,P=0.000),与另一个基底样表型标记EGFR呈负相关(r=-0.515,P=0.000);FOXA1的表达与CK 5/6呈负相关(r=-0.268,P=0.002),与另一个基底样表型标记EGFR呈负相关(r=-0.330,P=0.000).EGFR阳性组中FOXA1与GATA-3的表达率显著低于EGFR阴性组FOXA1与GATA-3的表达率(P<0.01)(表4).

(A1, B1, C1) :分别代表3种亚型乳腺癌的HE染色;(A7, A8):FOXA1和GATA-3在luminal A型乳腺癌中强表达;(B7, B8, C7, C8):FOXA1、GATA-3在基底细胞亚型和Her-2过表达型乳腺癌中不表达.
(A1, B1, C1) Haematoxylin-eosin stainings from the three subtypes invasive breast tumours;(A7,A8)Strong expression of FOXA1 and GATA-3 in the luminal A invasive tumour;(B7, B8, C7, C8): Negative expression of FOXA1 and GATA-3 in basal-like subtype and Her-2-overexpressing subtype tumour.
图2 FOXA1和GATA-3在各亚型乳腺癌组织中的表达差异(×20)
Fig.2 Immunohistochemistry panel showing differential expression pattern of FOXA1 and GATA-3 in the three subtypes invasive breast tumours(×20)
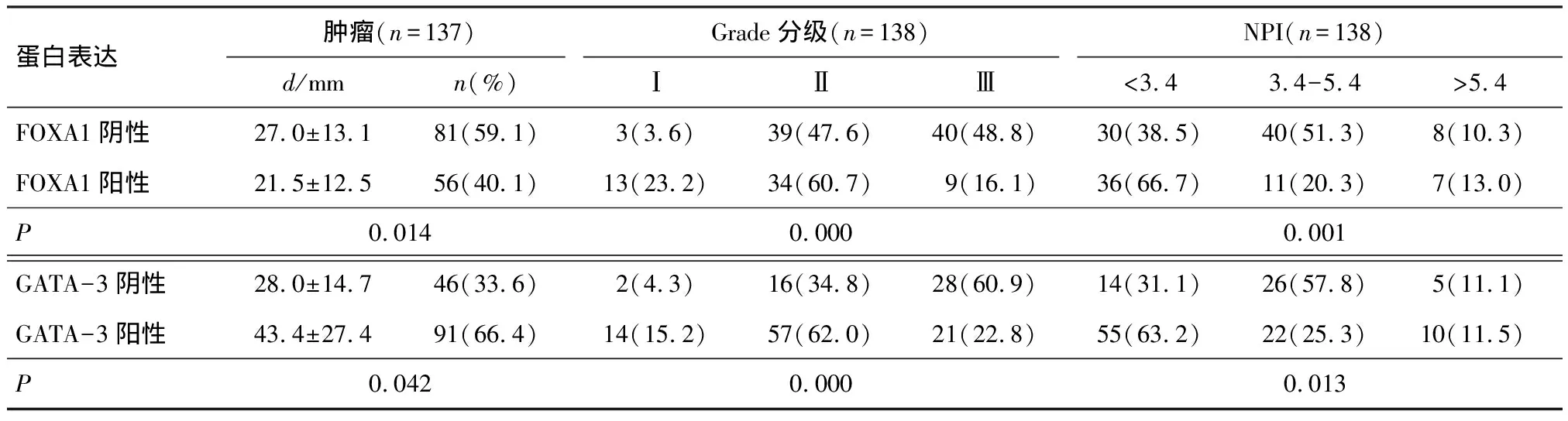
表2 FOXA 1和GATA 3表达与浸润性乳腺癌临床病理特征的关系
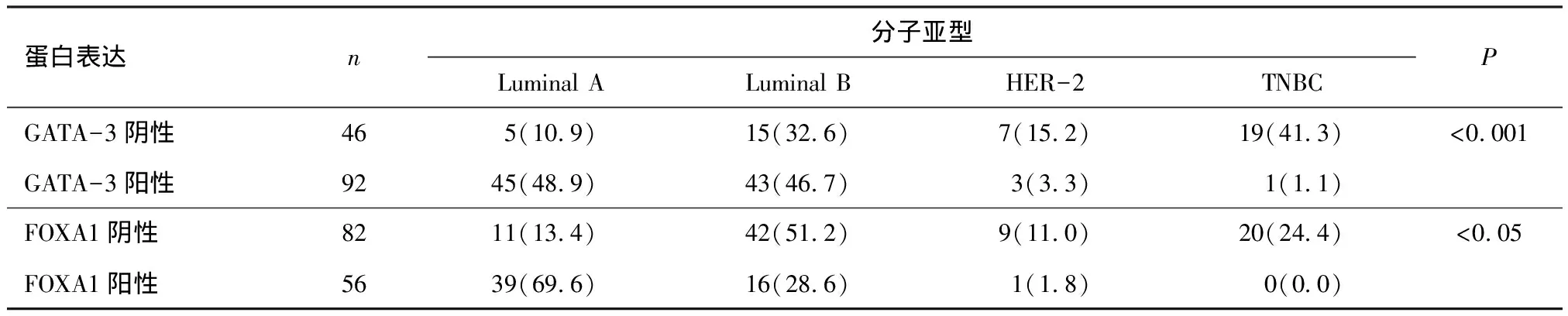
表3 FOXA1和GATA3表达与乳腺癌分子分型的关系Table 3 Association between FOXA1 and GATA3 expression and the molecular subtypes of breast cancer
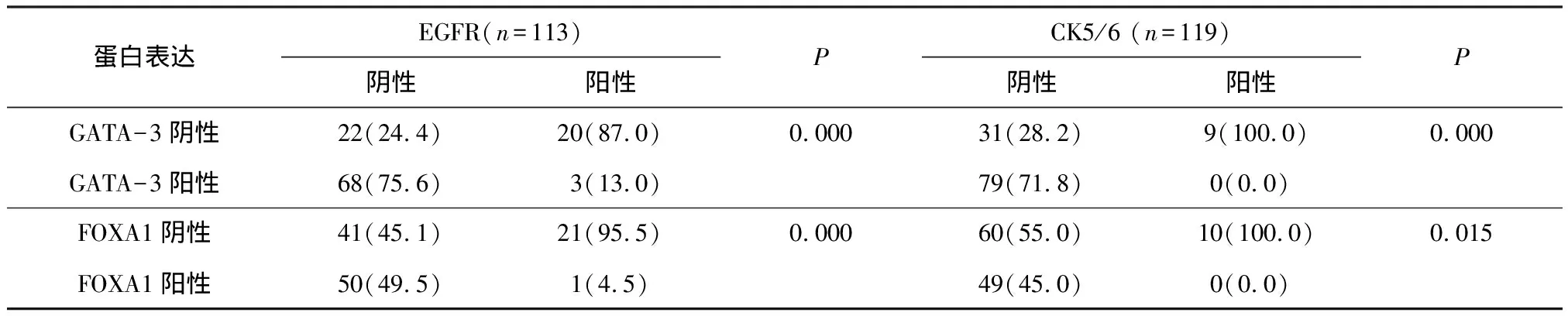
表4 FOXA1和GATA3表达与乳腺癌其他分子标记的关系Table 4 Association between FOXA1 and GATA3 expression and the other markers in infiltrative breast carcinomas n(%)
2.5 FOXA1与GATA-3染色在ER/PR阳性乳腺癌中的表达高于ER/PR-乳腺癌
GATA-3和FOXA1在乳腺癌不同亚型中的表达率存在差异.在ER+乳腺癌中GATA-3与FOXA1表达率显著高于ER-乳腺癌中GATA-3与FOXA1表达率(P=0.000),在PR+乳腺癌中GATA-3与FOXA1表达率也显著高于PR-乳腺癌中GATA-3与FOXA1表达率(P=0.000).FOXA1与ER表达(r=0.394,P=0.000)、PR表达(r=0.236,P=0.005)均直接相关;GATA3与ER表达(r=0.635,P=0.000)、PR表达(r=0.477,P=0.000)也直接相关(表5).
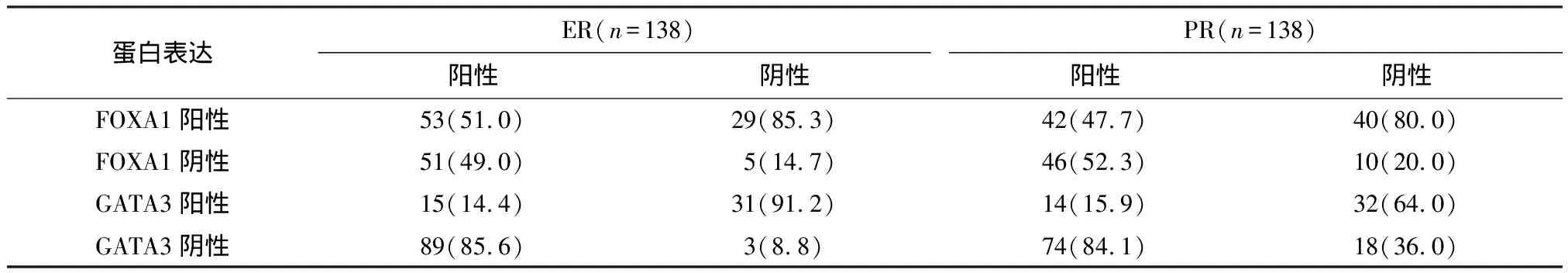
表5 FOXA1与GATA-3染色在ER/PR+乳腺癌中的表达高于ER/PR-乳腺癌
2.6 FOXA1与GATA-3在乳腺癌中的相互关系
FOXA1与GATA-3两者表达存在直接相关(r=0.560,P<0.01)(表2).GATA-3阳性/FOXA1阳性组乳腺癌53例,GATA-3阳性/FOXA1阴性组乳腺癌39例,两组内乳腺癌各分子亚型所占比例不同,前一组Lumnial A型所占比例最高,后一组Luminal B型所占比例最高(P<0.01)(表6);前一组21例淋巴结转移(39.6%,21/53),11例脉管内癌栓(20.8%,11/53);后一组19例淋巴结转移(48.7%,19/39),11例脉管内癌栓(28.2%,11/39).统计分析结果表明,GATA-3阳性/FOXA1阳性组的淋巴结转移率及脉管内癌栓检出率均明显低于GATA-3阳性/FOXA1阴性组(P<0.01)(表7).

表6 GATA-3阳性/FOXA1阳性组与GATA-3阳性/FOXA1阴性组乳腺癌各分子亚型情况

表7 GATA-3阳性/FOXA1阳性组与 GATA-3阳性/FOXA1阴性组脉管浸润与淋巴结转移的比较
3 讨论
全基因表达谱研究表明高水平的FOXA1常与ER的表达有关[18].FOXA和GATA家族成员对于激素驱动的癌症是至关重要的.在乳腺癌中GATA-3和FOXA1是决定ESR1阳性乳腺癌的基因[18],并且有证据表明GATA-3和FOXA1可以部分恢复ER阴性细胞中的ER通路的功能[15].FOXA1、GATA-3和ER三者形成乳腺管腔细胞生长、分化和激素依赖所需的转录回路[19-20],强调它们在乳腺癌中表达对肿瘤的预后及预测均有较高的价值.研究乳腺癌患者ER、FOXA1和GATA-3的表达有助于更好地理解ER、FOXA1和GATA-3之间的关系.
FOXA1是一种相对较新的标记物,在诊断病理学中尚未得到广泛应用.目前已有较多研究表明FOXA1表达与ER的表达及乳腺癌的预后密切相关[16, 21].有研究证实FOXA1在约40%的乳腺癌中表达,在ER阳性的乳腺癌中阳性率高达80%[22].本研究的数据显示FOXA1在乳腺癌中阳性率为40.6%(56/138),此数据与文献报道数据吻合,但是FOXA1在ER阳性乳腺癌中阳性率却相对较低49.0%(51/104),分析其原因发现在138例乳腺癌样本中Luminal A型仅36.2%,而文献[22]的202例乳腺癌中Luminal A型61.9%,FOXA1在Luminal A型乳腺癌中阳性率高达78%,此数据与其他研究相一致,因此,有理由认为FOXA1可以作为Luminal A亚型的临床标志.
乳腺组织中GATA-3主要表达于乳腺管腔上皮细胞,在乳腺癌中的表达频率较高,可作为转移癌乳腺起源的潜在标志[23-24].本研究数据表明66.7%的乳腺癌中检测到GATA-3,其阳性率与之前报道阳性率大致相似[24],本研究的数据还显示GATA-3在ER+乳腺癌中的高敏感性,在ER+乳腺癌中阳性率高达85.6%.GATA-3对三阴性乳腺癌的敏感性较低5%,而且该数据低于其他研究报告,有报道GATA-3在三阴性乳腺癌的阳性率高达43%[25].
研究发现正常乳腺及浸润型乳腺癌组织中FOXA1和GATA-3的染色模式与ER的染色模式均非常相似,都在肿瘤细胞细胞核表达,也在正常乳腺管腔上皮呈马赛克式表达,这一现象表明这3种跨功能蛋白的细胞定位是一致的.FOXA1在管腔A亚型乳腺癌中阳性率高达78%,支持FOXA1在管腔A型ER通路中发挥巨大作用这一理论[26-27].本研究显示GATA-3在管腔A型甚至在ER+乳腺癌(包括管腔A型和管腔B型)中均有较高表达率,分别为90%、74%.FOXA1表达和GATA-3表达是ERα阳性状态的重要预测因子.
本研究还表明FOXA1、GATA-3的表达与临床病理特征(即肿瘤大小、肿瘤分级、诺丁汉预后指数)均呈负相关,与ERα、PR的表达及Luminal A亚型均直接相关,而且FOXA1、GATA-3均与乳腺癌基底细胞亚型的免疫标记(即CK5/6和EGFR)呈负相关.这些结果都充分说明ER、FOXA1与GATA-3之间的强关联和相互作用.然而,FOXA1与GATA-3两者在ER阴性乳腺癌(包括Her-2过表达型及三阴型)中的敏感性和特异性均较低,Her-2过表达型乳腺癌及三阴型乳腺癌中新型免疫标记物有待于进一步发现及研究.
通过分析GATA-3与FOXA1之间的相互关系,不仅发现这两个蛋白与乳腺癌直接相关;还发现FOXA1是一个更为重要的生物调控因子,因为在GATA-3阳性的乳腺癌中,FOXA1表达的乳腺癌主要为Luminal A型,而FOXA1不表达的乳腺癌主要为Luminal B型,这点表明FOXA1可以作为管腔亚型乳腺癌相关的肿瘤标志物.另外在GATA-3阳性的乳腺癌中,FOXA1表达的乳腺癌具有更低的淋巴结转移率和脉管癌栓检出率,这点不仅证明FOXA1表达的乳腺癌患者具有更好的生存预后,还提示FOXA1可以作为GATA-3阳性乳腺癌的危险度分层指标,因此有必要依据FOXA1表达情况将GATA-3阳性的乳腺癌分为两个亚组(即FOXA1阳性组与阴性组),为临床提供更为客观、准确的证据来指导临床治疗及预后评估.
本研究结果显示,GATA-3和FOXA1在乳腺癌中的表达具有较高的敏感性和特异性,尤其是在ER+乳腺癌中,并且证实了FOXA1、GATA-3均直接与管腔A型乳腺癌密切相关,同时与基底样型乳腺癌成负相关.FOXA1与GATA-3都是乳腺癌重要的、强有力的腔内分化标志物,GATA-3的敏感性比FOXA1更强(分别为90%和78%).本研究结果还提示有必要将FOXA1、GATA-3和ER作为一个整体用于乳腺癌的分型研究和乳腺癌患者预后的预测.综上,ER与FOXA1、GATA-3在乳腺癌中的紧密联系,可以作为浸润性乳腺癌准确分型及预后良好的重要指标.
