二甲双胍通过三羧酸循环途径对巨噬细胞线粒体功能的影响
2019-07-02冀东黄晓晨朱长太
冀东,黄晓晨,朱长太
(1.上海海洋大学 水产与生命学院; 2.上海市第六人民医院 东院输血科, 上海 201306)
炎症是机体受到外界刺激时所产生的损伤和抗损伤的双重反应,过度或持续的炎症反应可引起组织损伤和机能障碍[1],如癌症、动脉粥样硬化、败血症等[2].巨噬细胞作为天然免疫中的重要组成部分,在组织损伤修复、炎症与感染以及代谢等方面发挥着重要作用[3].巨噬细胞受到环境的影响被激活后主要分为2种类型:经典活化型(M1)和替代活化型(M2).M1主要由γ干扰素和Toll样受体信号通路激活引起,分泌促炎炎性因子,发挥着抗感染等作用;而M2主要由白细胞介素IL-4和IL-13刺激引起,分泌抑炎炎性因子,发挥着促进肿瘤、损伤修复等作用[4].线粒体作为细胞代谢的重要场所,对巨噬细胞发挥着重要的调控作用.线粒体是机体主要的代谢细胞器,也是体内关键代谢通路的集成者,这些代谢通路包括氧化磷酸化、脂肪酸氧化、三羧酸循环(tricarboxylic acid cycling,TCA)通路等,线粒体对细胞代谢、体内平衡和应激反应至关重要,这些功能已成为介导代谢疾病、癌细胞代谢、神经变性和衰老的关键因素.线粒体自噬是降解线粒体的唯一机制,主要清除受损或功能失调的线粒体,用于控制线粒体的质量[5],影响多种细胞反应,如代谢平衡、细胞命运和炎症.TCA循环是线粒体产能的关键通路,线粒体能量供应不足会导致心脏、肌肉和大脑等高能量需求的器官和组织的功能紊乱,进而导致人类疾病,包括阿尔茨海默氏病、帕金森病等疾病[6].二甲双胍(metformin,Met)是治疗2型糖尿病的一线药物,除具有降血糖作用外,还具有抗炎、抗衰老等功效[7],其作用机制是能降低多种促炎炎性因子的产生,诱导抗炎细胞因子介导免疫细胞分化,目前研究发现二甲双胍在肥胖中起到的抗炎作用主要通过将巨噬细胞的极化状态转化为M2型来改善反应[8].
目前尚未有TCA循环对巨噬细胞线粒体功能影响的深入报道,本研究以脂多糖(lipopolysaccharide,LPS)营造炎症环境,Met营造抗炎环境,就TCA循环在炎症与抗炎环境下对线粒体功能的影响进行探讨,以分析在不同形态的巨噬细胞中TCA循环的变化情况,以及相应的变化对线粒体功能造成的影响.
1 材料与方法
1.1 实验试剂
脂多糖(LPS,055:B5),二甲双胍(Met)购自美国Sigma 公司;RAW264.7小鼠巨噬细胞系购自中国科学院细胞库;DMEM低糖培养基购自美国Hyclone公司;胎牛血清,双抗购自美国Gibco公司;抗体iNOS(ab178945)、CS(ab129095)、OGDH(ab137773)、IDH2(ab131263)、MDH2(ab181873)、Beclin-1(ab207612)、LC3b(ab204297)、GAPDH(ab181602)购自英国Abcam公司;RNA isolater Total RNA Extraction Reagent购自中国Vazyme公司;反转录试剂盒FastQuant RT Kit,荧光定量PCR试剂盒SuperReal PreMix Plus购自中国Tiangen公司;活性氧检测试剂盒Reactive Oxygen Species Assay Kit购自中国上海翊圣生物科技有限公司(50101ES01).
1.2 细胞培养
将RAW264.7细胞培养于添加青霉素(质量浓度100 IU/mL)、链霉素(质量浓度100 μg/mL)以及质量分数10%热灭活胎牛血清的培养基中,置于37 ℃、体积分数95%空气、体积分数5%CO2孵箱内培养,取对数生长期细胞用于实验.
1.3 Real-time PCR
取对数期 RAW264.7 细胞悬液接种于6孔板,细胞密度为 5×105/mL,每孔2 mL,培养 24 h贴壁后,设置空白对照组、LPS组、Met+LPS对照组,LPS的质量浓度均为1 μg/mL,Met的浓度采用已有文献的浓度,均为5 mmol/L[9],Met于LPS前1 h加入,加入LPS刺激8 h.使用TRIzol试剂提取各组细胞总RNA, 用紫外分光光度计检测所提RNA浓度及纯度,按照逆转录试剂盒说明,将 RNA为模版逆转录成 cDNA,实时定量PCR采用SYBR Green法.采用2-ΔΔCt方法对 qPCR 结果进行数据分析.本实验研究中的引物均由中国BioTNT公司合成,引物序列见表1.

表1 本研究使用的相关引物序列Table 1 Primer sequences for RT-PCR
1.4 Western blot印迹检测
取对数期 RAW264.7 细胞悬液接种于 6 孔板,细胞密度为 5×105/mL,每孔2 mL,培养 24 h贴壁后,设置空白对照组、LPS组、Met+LPS对照组,LPS的质量浓度均为1 μg/mL,Met的浓度均为5 mmol/L,Met于LPS前1 h加入,加入LPS刺激8 h.用三乙醇胺缓冲盐水溶液(tris buffered saline,TBS)洗两遍,加入适量的蛋白裂解液,收集细胞蛋白,定量,等量蛋白上样,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS PAGE),半干转聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),质量分数5%脱脂牛奶封闭1 h,一抗 4 ℃过夜,洗膜缓冲液(tris buffered saline Tween, TBST)洗膜3次,然后将其放入用TBS稀释的二抗(体积比为1∶5 000)中,TBST洗膜3次,最后使用Amersham Imager600显影仪显色.各蛋白稀释的体积比如下:CS(1∶1 000),OGDH(1∶1 000),MDH2(1∶10 000),Beclin-1(1∶2 000),ACC(1∶1 000),LC3b(1∶1 000),iNOS(1∶1 000),IDH2(1∶1 000),GAPDH(1∶10 000).
1.5 线粒体活性氧(reactive oxygen species,ROS)的测定
取对数期 RAW264.7 细胞悬液接种于 6 孔板,细胞密度为 5×105/mL,每孔 2 mL,培养 24 h贴壁后,设置空白对照组、LPS组、Met+LPS对照组,LPS的质量浓度均为1μg/mL,Met的浓度均为5 mmol/L,Met于LPS前1 h加入,加入LPS刺激8 h.按照1∶1 000的体积比用无血清的培养基稀释DCFH-DA,使其终浓度为10 μmol/L.将收集好的细胞悬浮于适量稀释好的药物,于37 ℃细胞培养箱内避光孵育30 min,每隔3~5 min颠倒混匀一下,使探针和细胞充分接触.用无血清的细胞培养基洗涤细胞1~2次,以充分去除未进入细胞内的DCFH-DA.洗涤及细胞重悬后利用流式细胞仪检测各组的相对荧光强度,FITC荧光信号激发波长488 nm, 发射波长525 nm,所检测的相对荧光强度可间接反映出细胞内的ROS水平.实验重复3次.
1.6 JC-1线粒体膜电位(JC-1 mitochondrial membrane potential,MMP)的测定
取对数期 RAW264.7 细胞悬液接种于 6 孔板,细胞密度为 5×105/mL,每孔 2 mL,培养 24 h贴壁后,设置空白对照组、LPS组、Met+LPS对照组,LPS的质量浓度均为1 μg/mL,Met的浓度均为5 mmol/L,Met于LPS前1 h加入,加入LPS刺激8 h.将收集好的细胞用体积为0.5 mL的JC-1 染色工作液重悬,混匀后于37 ℃细胞培养箱内避光孵育20 min.孵育结束后, 4 ℃ 600g离心3 min,沉淀细胞,弃上清,用JC-1染色缓冲液(1×)洗涤两次,并用适量重悬细胞,使用流式细胞仪分析,FITC荧光信号在488 nm处激发,530 nm处检测到,PE荧光信号在530 nm处激发,630 nm处检测到.实验重复3次.
1.7 统计学分析
2 结果
2.1 线粒体活性氧检测的结果
ROS是需氧细胞在代谢过程中产生的一系列活性氧簇,其主要来源是线粒体代谢的副产品,中、高浓度的ROS通过细胞氧化应激反应诱导细胞凋亡甚至导致其坏死,低浓度的ROS对转录因子的激活以及对细胞增殖、分化有促进作用,线粒体功能障碍的典型症状是高ROS的生成.LPS刺激8 h后线粒体ROS升高,此时线粒体功能受到损伤,Met抗炎后线粒体ROS下降,线粒体状态趋于稳定(图1).

与空白组比较 1)P<0.05; 与LPS实验组比较 2)P<0.05.Compared with normal control group, 1)P<0.05; Compared with LPS group, 2)P<0.05.
2.2 Real-time PCR结果
为确定LPS引起巨噬细胞炎症状态的反应时间,设置时间梯度,选择0、2、4、8、24 h时间点.IL-1β与IL-6是免疫细胞分泌的一系列重要炎症因子.与空白组比,随着LPS刺激的时间增加,IL-1β与IL-6的质量分数均有显著表达(图2),巨噬细胞出现炎症状态,加药8 h后巨噬细胞炎症状态最为显著,因此后续实验选择该时间点进行炎症与抗炎实验.
与空白组比,随着LPS刺激的时间增加,柠檬酸合酶(citrate synthase,CS)、异柠檬酸脱氢酶2(isocitrate dehydrogenase 2,IDH2)、苹果酸脱氢酶(malic dehydrogenase, MDH2)、α-酮戊二酸脱氢酶(α-ketoglutarate dehydrogenase, OGDH)的质量分数先增加后降低,在LPS刺激8 h时上述酶质量分数全部降低(图3),即当在LPS刺激8 h的炎症状态下TCA循环通路的活性降低,因此后续实验选定8 h时间点.
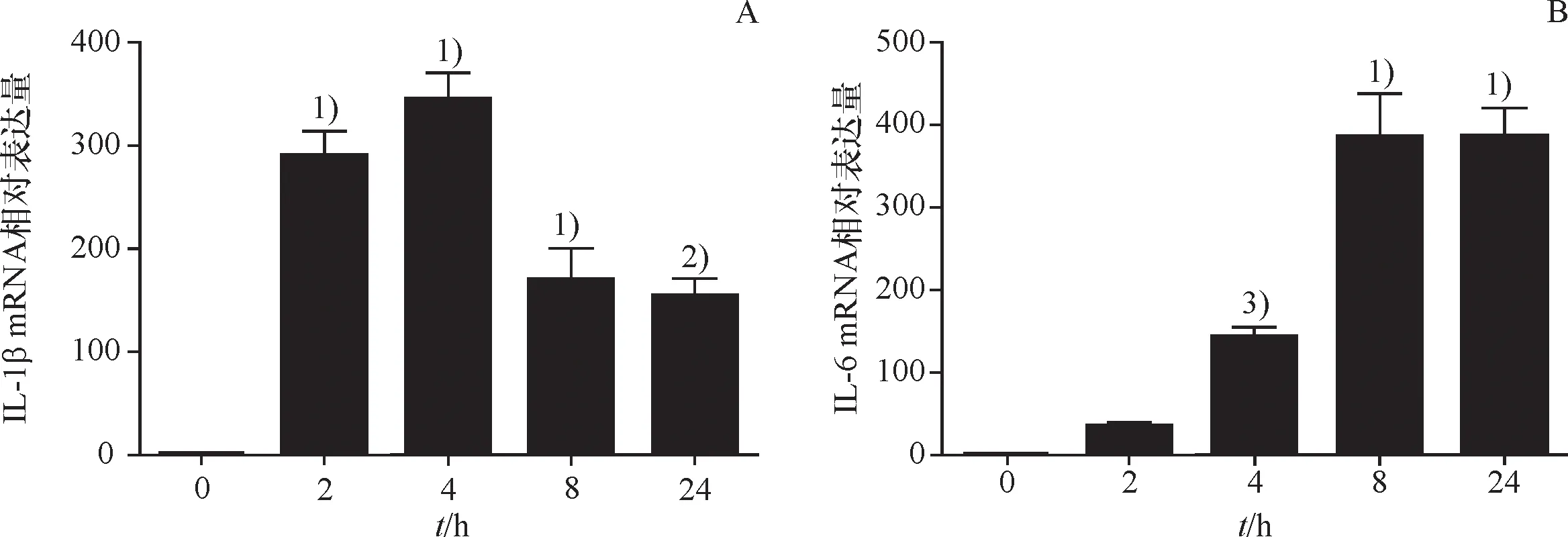
与空白组比较 1)P<0.000 1, 2)P<0.01, 3)P<0.05.
Compared with normal control group, 1)P<0.000 1, 2)P<0.01, 3)P<0.05.
A: LPS刺激巨噬细胞后IL-1β的质量分数随时间的变化趋势;B:LPS刺激巨噬细胞后IL-6的质量分数随时间的变化趋势.
A: Trend of IL-1βmass fraction over time after LPS stimulation of macrophages; B: Trend of IL-6 mass fraction over time after LPS stimulation of macrophages.
图2 LPS引起巨噬细胞炎症反应随时间的变化趋势
Fig.2 The change trend of macrophage inflammatory response induced by LPS with time
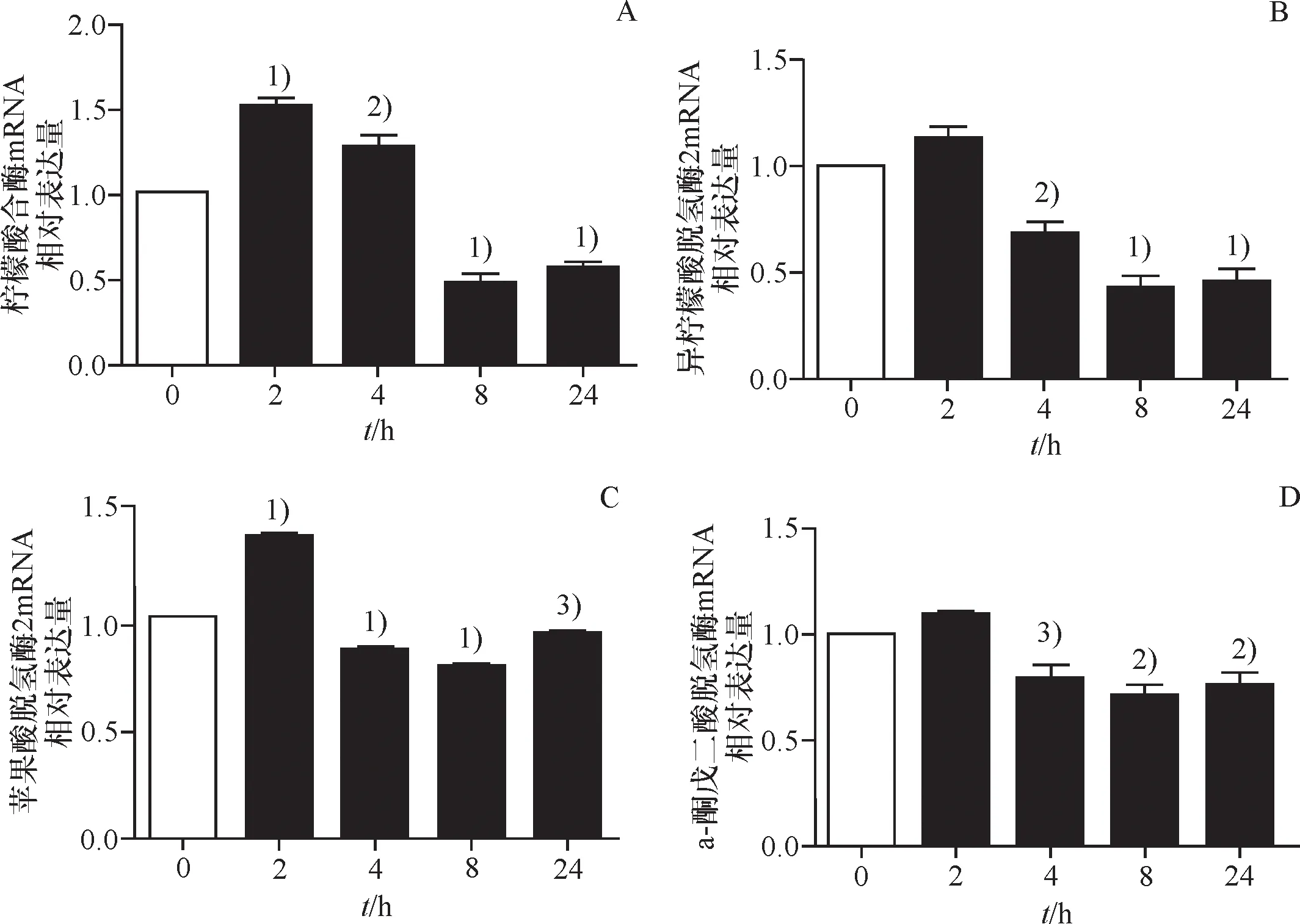
与空白组比较 1)P<0.000 1, 2)P<0.01, 3)P<0.05.
Compared with normal control group, 1)P<0.000 1, 2)P<0.01, 3)P<0.05.
A: LPS对CS质量分数的影响随时间的变化趋势;B: LPS对IDH2质量分数的影响随时间的变化趋势;C: LPS对MDH2质量分数的影响随时间的变化趋势;D: LPS对OGDH质量分数的影响随时间的变化趋势.
A: The change trend of the influence of LPS on CS mass fraction with time; B: The change trend of the influence of LPS on IDH2 mass fraction with time; C: The change trend of the influence of LPS on MDH2 mass fraction with time; D: The change trend of the influence of LPS on OGDH mass fraction with time.
图3 LPS对TCA循环通路中关键酶的影响随时间的变化趋势
Fig.3 The influence of LPS on the key enzymes in the TCA cycle pathway changes with time
与空白组比,在LPS质量浓度1 μg/mL刺激8 h时,LPS刺激细胞后,极大地提高了IL-6、IL-1β、IL-10这3种炎症因子的mRNA表达水平,说明LPS刺激可以造成巨噬细胞炎症因子转录水平的显著上升,这与模型建立的结果一致. 与LPS组相比,Met对上述促炎炎性因子IL-6、IL-1β有抑制作用,表达量降低,抑炎炎性因子IL-10表达量升高,即Met浓度为5 mmol/L抑制住炎症[9](图4).

与空白组比较 1)P<0.000 1, 2)P<0.01, 3)P<0.05; 与LPS实验组比较1)P<0.000 1, 2)P<0.01, 3)P<0.05.
Compared with control group, 1)P<0.000 1, 2)P<0.01, 3)P<0.05; Compared with LPS group, 1)P<0.000 1, 2)P<0.01, 3)P<0.05.
A: Met抗炎后IL-1β的质量分数;B:Met抗炎后IL-6的质量分数;C:Met抗炎后IL-10的质量分数.
A: Mass fraction of IL-1β after Met anti-inflammatory; B: Mass fraction of IL-6 after Met anti-inflammatory; C: Mass fraction of IL-10 after Met anti-inflammatory.
图4 Met对RAW264.7 细胞炎症因子基因表达的影响
Fig.4 Effects of Met on the expression of RAW264.7 cytokine genes
与空白组比,在LPS 质量浓度1 μg/mL刺激8 h的炎症状态下,TCA循环通路中的关键酶CS、IDH2、MDH2、OGDH表达水平均降低;与LPS对照组相比,当炎症抑制住后,TCA循环通路中的关键酶CS、IDH2、MDH2、OGDH表达水平均有所回升(图5).
2.3 Western blot印迹检测结果
一氧化氮合酶(nitric oxide synthase,iNOS)作为重要的炎性介质一氧化氮(nitric oxide,NO)生成的关键限速酶,其基因表达水平是调控NO 释放的重要因素,通过检测iNOS 蛋白水平的表达,发现LPS可显著上调iNOS 的表达,即此时炎症状态显著,而Met能够显著降低LPS诱导的iNOS表达量,即此时炎症状态被抑制(图6A).
TCA循环通路中的关键酶MDH2、OGDH、CS、IDH2在炎症状态下表达量下降,在炎症抑制住时表达量有所回升,即TCA循环在炎症状态下会被抑制,在抗炎状态下会被修复(图6B).
线粒体自噬相关蛋白Beclin-1和LC3bI在炎症状态下表达量下降,在Met作用的抗炎状态下表达量持续下降,即炎症状态TCA循环减弱时线粒体自噬功能受到抑制,浓度为5 mmoL/L的Met对线粒体自噬功能也有一定的抑制作用(图6C).
2.4 线粒体膜电位检测的结果
线粒体在产生能量时会将电化学势能储存于线粒体内膜,在内膜两侧,若质子及其他离子浓度的不对称分布就会形成线粒体膜电位,正常的膜电位是维持线粒体进行氧化磷酸化、产生三磷酸腺苷的先决条件,膜电位的稳定有利于维持细胞的正常生理功能,LPS刺激8 h后线粒体膜电位升高,此时线粒体功能受到损伤,Met抗炎后线粒体膜电位去极化,线粒体状态趋于稳定(图7).
2.5 讨论
在炎症状态下TCA循环通路被破坏,ROS生成量增加,线粒体膜电位升高.而线粒体ROS的增加会抑制氧化磷酸化和ATP生成,导致能量代谢失衡[10],因此极有可能是由于氧化磷酸化的减少,TCA循环被破坏.自噬对免疫反应的影响是复杂的,自噬可以通过调节病原体清除、抗原表达、先天和适应性免疫反应来促进或减少炎症[11],而高ROS会损坏线粒体结构,从而导致线粒体自噬功能减弱. α-酮戊二酸脱氢酶(α-ketoglutarate dehydrogenase, OGDH)的缺失导致α-酮戊二酸(OGDH的底物)的增加,其反过来导致mTORC1活化和随后的线粒体自噬减少,导致线粒体代谢功能障碍[5].在Met抗炎后,M2型细胞增多,ROS生成量降低,线粒体膜电位降低,TCA循环可能是受氧化磷酸化增多的β氧化而回升.有研究表明,在不同形态的巨噬细胞中,线粒体自噬功能有差异[12],在M1型巨噬细胞中线粒体自噬功能强,在M2型巨噬细胞中线粒体自噬功能会减弱,因此在Met抗炎后,由于M2型细胞增多,线粒体自噬功能减弱更为严重.在细胞外ATP水平较高时会诱导ATP产生促炎作用,这种促炎作用出现在炎症的早期阶段[13],在炎症过程的最后, ATP去磷酸化酶破坏ATP和炎症部位细胞产生腺苷,这将导致ATP水平下降和腺苷水平增加[14].
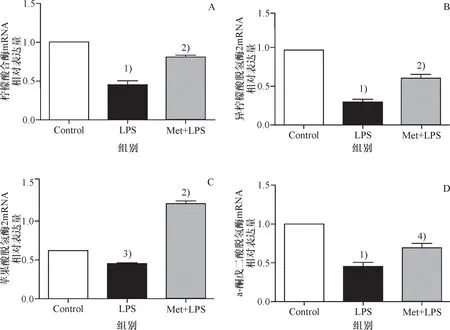
与空白组比较 1)P<0.000 1,3)P<0.01; 与LPS实验组比较 2)P<0.000 1,4)P<0.05.
Compared with control group, 1)P<0.000 1,3)P<0.01; Compared with LPS group, 2)P<0.000 1,4)P<0.05.
A: Met抗炎后CS的质量分数;B: Met抗炎后IDH2的质量分数;C: Met抗炎后MDH2的质量分数;D: Met抗炎后OGDH的质量分数.
A: Mass fraction of CS after Met anti-inflammatory; B: Mass fraction of IDH2 after Met anti-inflammatory; C: Mass fraction of MDH2 after Met anti-inflammatory; D: Mass fraction of OGDH after Met anti-inflammatory.
图5 炎症与抗炎对TCA循环通路中关键酶的影响
Fig.5 Effect of inflammation and anti-inflammatory on key enzymes in TCA circulation pathway
二甲双胍是治疗2型糖尿病的一线药物,除具有降血糖的作用外,还具有抗炎等功效,其作用机制是能降低多种促炎炎性因子的产生,诱导抗炎炎性因子介导免疫细胞分化.有研究发现二甲双胍通过调节巨噬细胞极化抑制肿瘤发生和分化[15].TCA循环是线粒体中产能的关键通路,因此线粒体能量供应不足会导致心脏、肌肉和大脑等高能量需求的器官和组织的功能紊乱,进而导致人类疾病,包括阿尔茨海默氏病、帕金森病等疾病.二甲双胍可以修复受损的TCA循环,使线粒体功能趋于稳定.
M1型巨噬细胞表现为TCA循环中断,参与促炎反应和杀死细胞内病原体[16],相反,M2型巨噬细胞发生β-氧化产生抗炎反应,促进伤口愈合[17].有研究表明,TCA循环通路在M1型巨噬细胞中发生两次循环中断[18],首次断裂发生在涉及异柠檬酸脱氢酶的步骤,第2次断裂发生在涉及琥珀酸脱氢酶的步骤.依赖于线粒体烟酰胺腺嘌呤二核苷酸磷酸的IDH2通过调节还原型烟酰胺腺嘌呤二核苷酸磷酸的产生,在线粒体氧化还原平衡的控制中发挥着关键作用[19].败血症是非冠状动脉重症监护病的主要死亡原因,在世界范围内发病率不断上升.败血症中巨噬细胞线粒体损伤的机制包括产能缺陷、细胞凋亡和炎症诱导,败血症期间线粒体ROS的增加会抑制氧化磷酸化和ATP生成,导致能量代谢失衡,引起全身炎症和多器官衰竭,ROS会损害线粒体结构,并阻止线粒体的生物发生.最近与IDH2相关的研究集中在其于癌症发展中的作用,包括乳腺癌、结肠癌和胶质瘤[20],IDH2突变导致多种癌症,包括炎症紊乱,最近的研究将各种癌症中IDH2的功能障碍与炎症反应的失调联系起来,如促炎炎性因子的过度产生[21],单核细胞中,败血症患者的CS活性最高水平显著低于正常人[22],由此推测TCA循环通路中关键酶的表达量下降会导致活性氧增加,从而导致线粒体功能紊乱,这也有可能是导致败血症的原因,在肝脏中炎症反应加剧了线粒体蛋白的乙酰化,MDH2被乙酰化,并且刺激苹果酸-天冬氨酸穿梭活性以维持糖酵解[23], OGDH是一种关键的代谢中间体,可作为促炎代谢物,通过NF-κB信号通路增加LPS诱导的促炎细胞因子的产生,当IDH2缺失时会导致OGDH的表达量下降,最终降低了LPS诱导的肺部炎症反应[24].
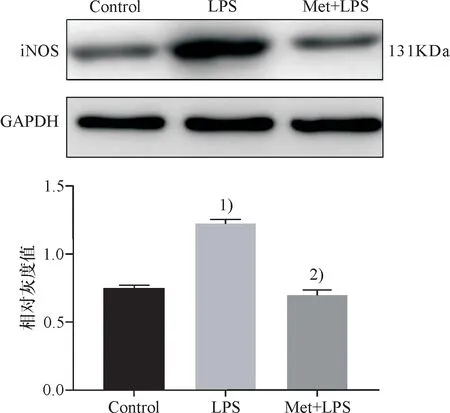
与空白组比较 1)P<0.01; 与LPS实验组比较 2)P<0.01.
Compared with control group, 1)P<0.01;Compared with LPS group, 2)P<0.01.
图6A iNOS表达量
Fig.6A The expression of iNOS
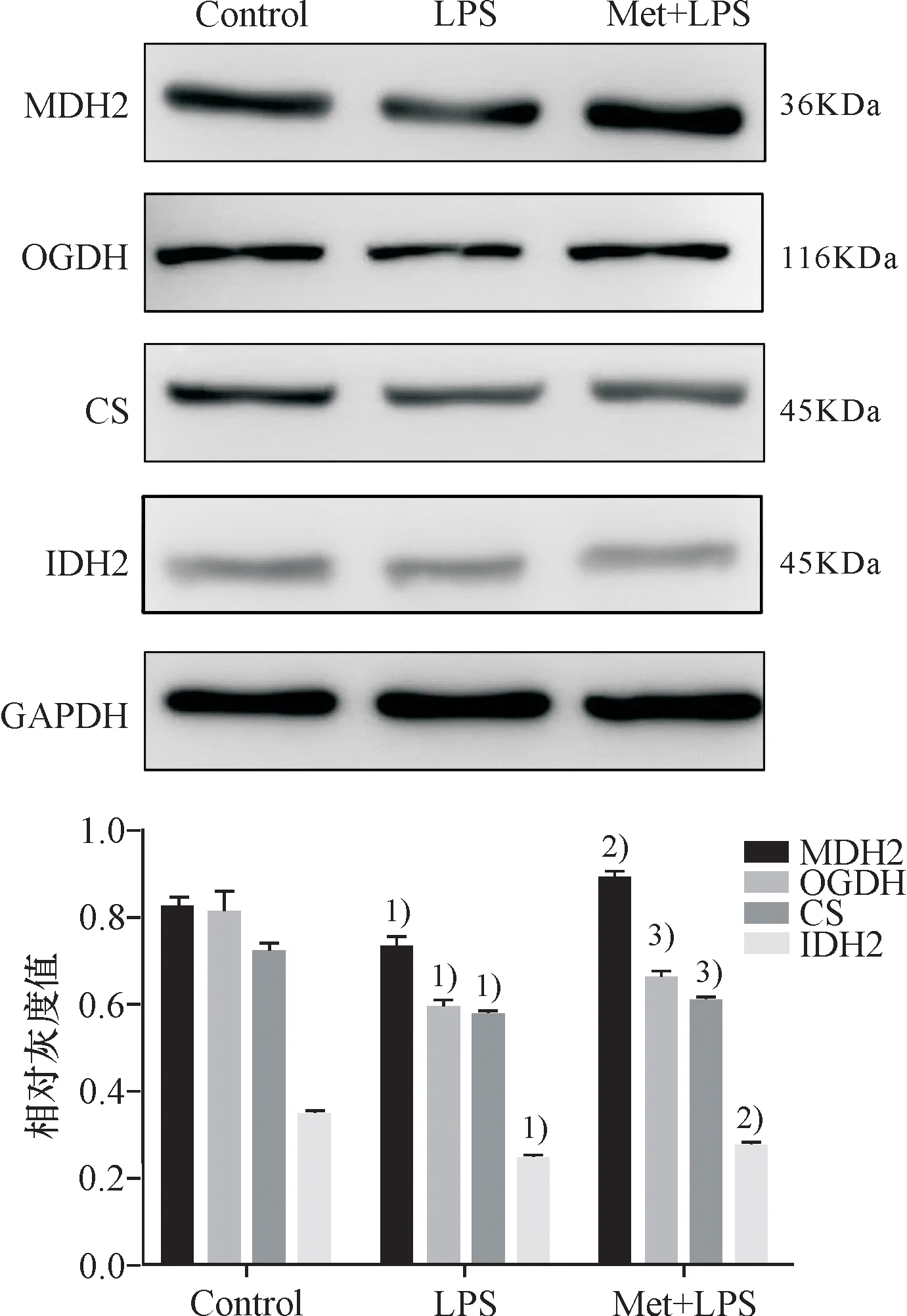
与空白组比较 1)P<0.01;与LPS实验组比较 2)P<0.01, 3)P<0.05.
Compared with control group, 1)P<0.01;Compared with LPS group, 2)P<0.01, 3)P<0.05.
图6B TCA循环通路中的关键酶在炎症与抗炎状态下的变化
Fig.6B Changes of key enzymes in the TCA circulation pathway in inflammatory and anti-inflammatory states
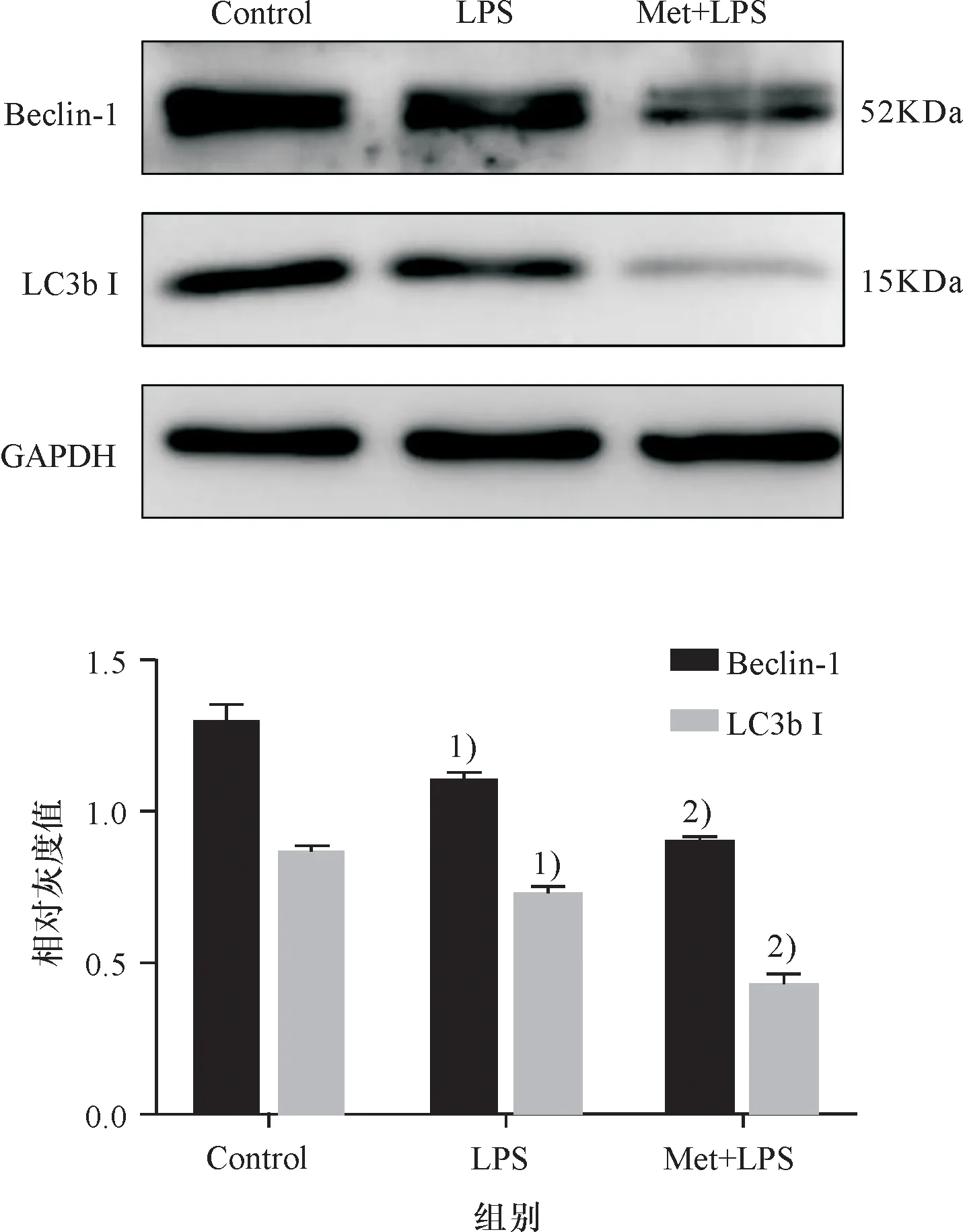
与空白组比较 1)P<0.01; 与LPS实验组比较 2)P<0.01.
Compared with control group, 1)P<0.01;Compared with LPS group, 2)P<0.01.
图6C 自噬相关蛋白在炎症与Met抗炎条件下的表达情况
Fig.6C Expression of autophagy related proteins in inflammatory and Met anti-inflammatory conditions

与空白组比较 1)P<0.05; 与LPS实验组比较 2)P<0.000 1.Compared with control group, 1)P<0.05; Compared with LPS group, 2)P<0.000 1.
3 结论
综上所述,线粒体中的TCA循环在炎症状态下会被破坏,造成线粒体能量代谢失衡,损坏线粒体结构;Met能够抑制炎症,加剧减弱线粒体自噬功能,同时抗炎状态会对被抑制的TCA循环起到修复作用,使线粒体功能趋于稳定.因此TCA循环的变化对线粒体功能的改变起到十分重要的作用,但在炎症与抗炎环境下TCA循环对线粒体功能影响的机制尚不清楚,后续需要进一步研究TCA循环影响线粒体功能的机制、作用靶点,以及TCA循环是如何影响线粒体的功能.
