三叉神经节递质的UHPLC-MS/MS法测定
2019-07-01付晓芸唐雪李星影毕禄莎孙嘉茵徐小平
付晓芸 唐雪 李星影 毕禄莎 孙嘉茵 徐小平
摘要:该文采用UHPLC-MS/MS建立一种同时测定大鼠三叉神经节中4种神经递质的方法。SD大鼠三叉神经节组织匀浆后,加乙腈沉淀蛋白,制备成供试品溶液;以Discovery HS F5-3(2.1mm×150mm,3.0μm)为色谱柱,0.1%甲酸溶液(A相)和0.1%甲酸-40%乙腈溶液(B相)为流动相,梯度洗脱进行分离;然后在+ESI和MRM模式下检测,以 Glycine-N15为内标。结果表明:4种氨基酸的线性关系良好(r2≥0.999),检测限和定量限分别为0.14~1.23ng/mL和0.47~4.11ng/mL;在浓度范围内,进样精密度、日内和日间精密度良好,RSD分别在0.90%~5.17%,3.01%~7.19%,4.64%~14.49%;加样回收率为94.8%~108%。大鼠三叉神经节炎症模型在0,1,3,5,7d4种神经递质的含量均发生不同程度的变化,其中天门冬氨酸(Asp)在炎症期没有明显的变化(P>0.05),而其余3种递质变化显著(P<0.05),且谷氨酸(Glu)最明显,体外实验也证实Glu在炎症条件下含量增加。所建方法可高效同时分离检测三叉神经中4种氨基酸的含量,有较好的使用价值。
关键词:氨基酸类神经递质;三叉神经;超高效液相色谱;三重四极杆质谱
中图分类号:O657.63 文献标志码:A 文章编号:1674-5124(2019)01-0064-06
0 引言
生活中常说的“脸痛”即三叉神经痛(trigeminalnerve pain,TN),是一种反复发作在面部三叉神经分布区内的阵发性剧烈神经痛,是中枢系统常见病之一[1-21。中枢神经系统内广泛分布大量的氨基酸,这类物质具有独特的神经递质作用,主要包括兴奋性氨基酸[3]如谷氨酸[4]天冬氨酸和抑制性氨基酸Y-氨基丁酸[5]、牛磺酸等两大类,当面部出现疼痛时,这些神经递质亦会发生相应变化。三叉神经节神经元(trigeminal ganglion neurons,TGNs)是假单极神经元,其胞体位于三叉神经节,由大量卫星胶质细胞(satellite glia cells,SGCs)包裹。研究表明,口腔领面部的创伤、炎症等刺激因素可以通过轴突运输的途径影响三叉神经节内TGNs-SGCs的交互对话,Glu是参与TGNs-SGCs交互对话的重要信号分子;所以,建立谷氨酸等神经递质的检测方法可为三叉神经疼痛机理的研究提供学术基础。国内外对氨基酸分析测定方法有不少报道,主要有分光光度法[6]、柱前柱后衍生高效液相色谱(HPLC)法[7]、氨基酸分析仪法[8]、离子色谱法[9]、液质联用法[10-11]、超高效液相色谱[12]等,但是针对三叉神经内氨基酸类神经递质的同时检测尚未见发表。由于神经节小,含量低且干扰多[13-14],本文拟采用UHPLC-MS/MS法快速定量大鼠三叉神经组织内以及TGNs-SGCs共培养体系内4种氨基酸类神经递质在疼痛前后的含量变化,通过对比炎症组与空白对照组的氨基酸神经递质的含量差异,可为三叉神经支配区域内疼痛异常提供神经递质的定量变化基础。
1 实验部分
1.1 仪器与试剂
岛津超高效液相色谱仪LC-30A与三重四极杆质谱仪LCMS-8050联用系统:MTN-2008D氮吹仪(天津奥特塞恩斯仪器有限公司);KQ-500B超声波清洗器(昆山市超声仪器有限公司);R201B旋转蒸发仪(上海申胜生物技术有限公司);HL104和XS205电子天平(瑞士Mettler Toledo公司):MaxiMix Ⅱ涡旋振荡器(赛默飞世尔科技有限公司);Milli-Q纯水仪(美国Milli-Q公司)。
甘氨酸(Gly)对照品,谷氨酸(Glu)对照品,Y-氨基丁酸(GAGA)对照品,天门冬氨酸(Asp)对照品(中国食品药品检定研究院);Glycine-N"(98%,Sigma-Aldrich);乙腈、甲醇(色谱级,赛默飞世尔科技有限公司);乙醇、甲醇(分析纯,成都科隆化学品有限公司);乙酸铵(色谱级,上海阿拉丁生化科技股份有限公司);甲酸(98%,LC-MS专用,百灵威科技有限公司);甲酸(分析纯,程度科龙化工试剂厂):Matrigel basement membrane matrix(BD生物科技,美国):木瓜蛋白酶(Sigma,美国):Neurobasal-A培养基(Gibco,美国)。
1.2 溶液的制备
1.2.1 对照品溶液的配置
分别取Gly,GABA,Asp,Glu对照品适量,配制成质量浓度为0.1mg/mL标准储备液,用超纯水逐级稀释至10,20,50,100,200,500,1000,2000,4000ng/mL,即为标准溶液。
1.2.2 内标溶液的配制
取Glycine-N15适量,精密称定,超纯水配制成质量浓度20μg/mL的内标溶液。
1.2.3 样品处理方法
取三叉神经节组织称重,置于匀浆管中,精密加入生理盐水1mL,匀浆后,吸取大鼠三叉神经组织匀浆液100μL,加入20μL内标工作液,再加入880μL乙腈,涡旋1min,14000r/min离心10min,取上清液20μL,进样LC-MS-MS,记錄色谱图和质谱图,以质谱峰面积进行计算。
1.3 色谱条件的考察
实验通过单因素考察,对色谱柱、流动相的比例、有机溶媒的极性和缓冲盐的强度等进行筛选。
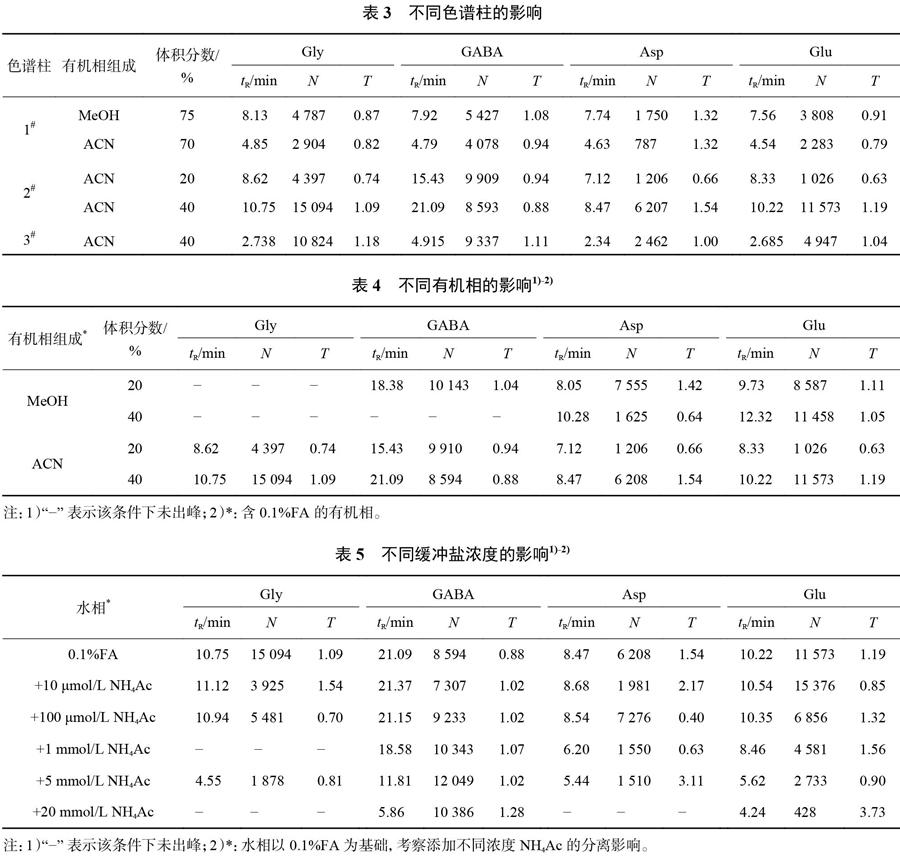
1.3.1 色谱柱的选择
流动相均以0.1%甲酸(FA)作为水相,含有0.1%FA的乙腈或甲醇为有机相,流量0.2mL/min,以样品中主成分峰的保留时间(tR)、柱效(N)、拖尾因子(T)作为指标分别对色谱柱1#:HILIC柱(SepaxPolar-Silica,4.5mm×150mm,3μm):色谱柱2#:五氟苯基柱(Ultimate PFP,2.1mm×50mm,3μm);色谱柱3#:五氟苯基柱(Discovery HS F5-3,2.1mm×150mm,3.0μm)进行考察。
1.3.2 有机相的选择
选择1.3.1获得的最佳色谱柱,以0.1%甲酸(FA)作为水相,样品中以4个氨基酸峰祎tR、N、T作为指标考察乙腈和甲醇对分离过程的影响。
1.3.3 缓冲盐浓度的选择
选择1.3.1获得的最佳色谱柱,以0.1%甲酸(FA)作为水相,1.3.2项下最优的有机相,考察了0.1%FA溶液中添加不同浓度乙酸铵的影响。
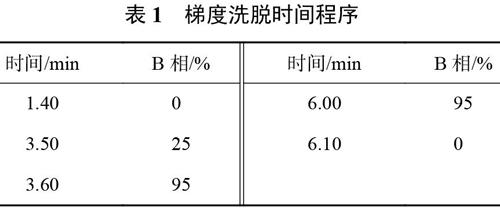
1.4 色谱条件
色谱柱:Discovery HS F5-3,2.1mm×150mm,3.0μm;流动相:A相为0.1%甲酸溶液,B相为0.1%甲酸-40%乙腈溶液;流量:0.20mL/min;进样体积:2μL;柱温:40℃;混合器体积:180μL;洗脱方式:梯度洗脱,如表1所示。
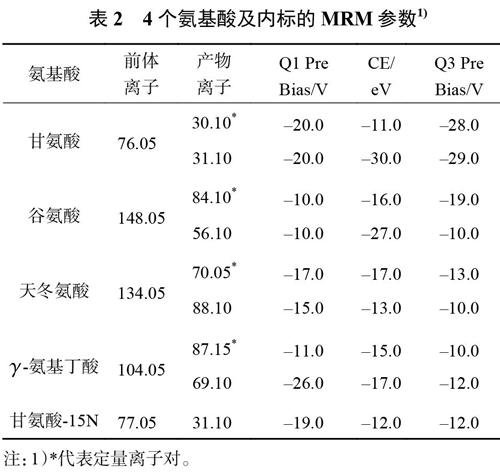
1.5 质谱条件
采用+ESI离子化模式和多反应监测(MRM)扫描模式;碰撞气:氩气,270kPa;接口温度:300℃;DL温度:250℃;加热模块温度:400℃;接口电压:4.0kV;参数见表2。
2 方法学验证
2.1 线性关系、检出限和定量限
取1.2.1中的标准溶液100μL,加内标液制成质量浓度为1,2,5,10,20,50,100,200,400ng/mL的标准曲线溶液,经测定计算各自线性方程,并经不断稀释检测出仪器的检出限(S/N≥3)和定量限(S/N≥10)结果。
2.2 精密度和准确度
以高中低3个浓度的AA混合标准溶液连续6次进样;以制备的高中低3组供试品溶液在同一日反复检测6次,于不同日测定,分别计算进样精密度、日内和日间精密度。精密量取大鼠三叉神经组织匀浆液80μL,离心管,加内标液20μL,加标准溶液20μL,然后照1.2.3项下处理,制备高中低3个浓度的加标样品,按照1.4和1.5项下条件分析,测定加样回收率。
3 神经递质的檢测
3.1 动物模型的选择
以常见SD大鼠作为疼痛实验模型[15-16];体重:160~180g。
3.2 三叉神经节中神经递质的检测
实验设计了炎症0,1,3,5,7d的大鼠模型,动物在全麻条件下取出三叉神经,每组8份样品,组织样品照1.2.3方法制备,照1.4和1.5项下测定条件检测。并使用SPSS软件进行配对样本T检验,以判断炎症Od与炎症1,3,5,7d数据是否具有统计学意义上的显著差异。
3.3 TGNs-SGCs细胞培养基中神经递质的检测
本文利用TGNs-SGCs共培养体系,体外模拟验证Glu在炎症条件下的代谢变化。实验中取新鲜获取的三叉神经节,经木瓜蛋白酶溶液处理后加入Neurobasal-A培养基2mL重悬混匀。用Matrigel接种细胞悬液。置于37℃、5% CO2的细胞培养箱中继续培养24~48h获得供试培养液。取供试培养液少许,照1.4,1.5项检测不同培养时间,培养液中Glu的含量变化。
4 结果讨论
4.1 液相色谱条件的选择
色谱柱的选择由表3可知,在相应的较优的流动相条件下,五氟苯基柱(Discovery HS F5-3,2.1mm×150mm,3.0μm)得到的评价指标更优,柱效更高,峰形对称度更好,更适合后续进行条件筛选。有机相的选择由表4可知,含40%的乙腈作为有机相,出峰情况好,柱效高。由表5可知,随着缓冲盐浓度的增加,离子强度上升,4种氨基酸的保留时间都随离子强度增大而减小,加入缓冲盐后对各种氨基酸的各项评价指标没有明显提升,故采用不加入缓冲盐的0.1%FA作为水相。
4.2 标准样品一级质谱图和二级质谱图
由1.5的质谱条件获得氨基酸各自相应的总离子流图,如图l所示。
4.3 方法学验证
由表6,表7可知,四种氨基酸在浓度范围内的线性关系良好(r2≥0.999),检测限(LOD)和定量限(LOQ)分别为0.14~1.23ng/mL和0.47~4.11ng/mL。比传统的氨基酸测定方法[17-18]的检测限、定量限更低,说明本实验采用的方法更灵敏高效。高中低3个不同浓度进样精密度、日内和日间精密度的RSD分别在0.90%~5.17%,3.01%~7.19%,4.64%~14.49%:加样回收率为94.8%~108%之间。
4.4 神经递质的检测
三叉神经节中神经递质的检测,由表8可知,4种氨基酸神经递质中天门冬氨酸(Asp)炎症模型中没有明显的变化(P>0.05),其余3种神经递质在炎症的1d未表现出明显的变化外,在炎症3,5,7d均表现出的显著变化(P<0.05)。由图2可知,疼痛过程中谷氨酸(Glu)的浓度在3d后明显增高。甘氨酸(Gly)、γ-氨基丁酸(GAGA)的浓度略有增加。TGNs-SGCs细胞培养基中神经递质的检测结果如图3所示。可知,在炎症条件下神经元体外培养48h后,实验组的Glu含量明显高于空白对照组,与三叉神经疼痛趋势和节中神经递质的表现趋势相同。
5 结束语
本文采用UHPLC-MS/MS法首次同时分离检测三叉神经节中4种氨基酸的含量。采用优化后的色谱条件,检测得到三叉神经节内Asp炎症Od与炎症1,3,5,7d没有统计学意义上的显著差异。Glu的浓度在炎症刺激3d后明显增高,体外实验同样证实了Glu在炎症条件下的代谢变化。说明Glu的含量与疼痛异常行为密切相关,与炎症变化进展相符[19],另有研究发现中风、脑组织损伤、癫痛、帕金森病等病理过程突触间隙Glu含量都增高[20-21]。此外,Gly、GABA的浓度略有增加,说明两者作为抑制性的神经递质,在炎症下释放增加,抑制系统功能增强,但其具体机制还有待进一步的研究。
参考文献
[1]段雷,胡文.三叉神經痛的发病机制的研究进展[J].立体定向和功能性神经外科杂志,2016(5):317-320.
[2]STINE M,GIULIA D S.Trigeminal neuralgia-diagnosis andtreatment[J].Cephalalgia:An International Journal ofHeadache,2017,37(7):648-657.
[3]王玮瑶,陈玲,岳学玲,等.慢性束缚应激对老龄大鼠空间学习和记忆能力及海马齿状回区兴奋性氨基酸水平的影响[J].吉林大学学报(医学牌,2018,44(1):8-12.
[4]LI X L,GOEL P,WONDOLOWSKI J.A glutamatehomeostat controls the presynaptic inhibition of neuro-transmitter release[J].Cell Report,2018,23(6):1716-1727.
[5]秦茵,钱兴皋,刘奥,等.不同功率的低强度激光对神经病理性疼痛大鼠痛阈及脊髓背角5-HT,GABA表达的影响[J].颈腰痛杂志,2016,37(1):23-27.
[6]DRABKOVA P,ANDRLOVA L,KANDAR R.An HPLCmethod for the determination of selected amino acids inhuman embryo culture medium[J].Biomedical Chromato-graphy,2017,31(2):1-11.
[7]黄冰琳.OPA柱前衍生RP-HPLC-FLD测定小鼠脑组织中6种氨基酸类神经递质[J].海峡药学,2016,28(11):23-26.
[8]李名路,庞小莲,陈凤.氨酸分析仪测定胧氨酸片中胧氨酸的含量[J].药物分析杂志,2018(5):889-893.
[9]栾兰,任嘉鹏,王钢力,等.离子交换色谱法测定注射用双黄连(冻干)中氨基酸的含量[J].应用化工,2016,45(2):377-380.
[10]李慧,鲁文慧,焦丽丽,等.液相色谱一质谱联用技术检测大鼠血浆、肾上腺及下丘脑中神经递质含量[J].分析化学,2018,46(4):586-593.
[11]赵芳,李强,梁梅丽,等.超高效液相色谱-串联质谱法快速测定大鼠血清中8种神经递质[J].分析化学,2018,46(1):121-128.
[12]翁燕,刘丽娜,周小燕,等.建立UPLC法测定复方氨基酸胶囊(9-5)中氨基酸的含量[J].实用药物与临床, 2017,20(2):202-207.
[13]赵艳萍,丁晓霞,王勇,等.氨基酸类神经递质分析方法的研究进展[J].甘肃医药,2015,34(10):740-745.
[14]邓超,张鹤,薛进朗,等.新生SD大鼠三叉神经元细胞的体外原代培养及鉴定[J].口腔医学研究,2018,34(4):411-413.
[15]晃成磊,鲁显福,张励才.甲醛致炎痛对大鼠远位触液神经元γ-氨基丁酸表达的影响[J].中国应用生理学杂志,2010,26(1):36-38.
[16]孟春,王国林.炎性痛大鼠脊髓背角γ-氨基丁酸及其受体的表达[J].中华麻醉学杂志,2004(9):25-28.
[17]宣柳,沈佐君,何晓东,等.高效毛细管电泳测定海马组织和脑脊液中氨基酸类神经递质[J].检验医学,2007,22(3):324-328.
[18]白钰,张莉,马晓丽,等.RP-HPLC-荧光法测定大鼠海马组织中5种氨基酸类神经递质[J].检验医学,2014,29(1):69-72.
[19]KUNG L H,GONG K,A])]])OYIN M,et al.Evidence forglutamate as a neuroglial transmitter within sensoryganglia[J].P1oS One,2013,8(7):e68312.
[20]LUO R,(II]O Y,CAO D Y,et al.Local effects of octreotideon glutamate-evoked activation of Adelta and C afferent fibersin rat hairy skin[J].Brain Research,2010,1322:50-58.
[21]HAN F,SHIODA N,MORIGUCHI S,et al.Downregulationof glutamate transporters is associated with elevation inextracellular glutamate concentra!ion following rat micro-sphere embolism[J].Neuroscience Letters,2008,430(3):275-280.
