高中化学守恒法解题技巧探究
2019-07-01冯庆学
冯庆学
(河北省南和县第一中学 054400)
一、电子得失守恒法
电子得失守恒法及化合价收红包.指的是在某种化学反应之后所生成的化合物中正负化合价的总数相等,利用化合价守恒法能得知化合物正负化合价总数.
例1 (NH4)2SO4在强热条件下分解,生成NH3、SO2、N2、H2O,反应中生成的氧化产物和还原产物的物质的量之比为( ).
A. 1∶3 B. 2∶3 C. 1∶1 D. 4∶3
解析(NH4)2SO4在强热条件下分解,N2是其氧化产物,SO2为还原产物,根据电子得失守恒原则有3×2↑×x=2↓×y,因此有x∶y=1∶3,所以选A.
二、质量守恒法
化学反应的本质是原子间的重新组合,而质量守恒就是在化学反应前后每个物质的总质量保持不变.因此,利用质量守恒这一定律进行解题的方法就是质量守恒法.质量守恒法在实际应用中非常的广泛和重要,需要大家认真总结和思考.
例2 将NO2、O2、NH3的混合气体26.88 L通过稀H2SO4后,溶液质量增加45.75 g,气体体积缩小为2.24 L.将带火星的木条插入其中,木条不复燃.则原混合气体的平均相对分子质量为( ).(气体均在标准状况下测定)
A.40.625 B.42.15 C.38.225 D.42.625
解析将NO2、O2、NH3的混合气体通过稀H2SO4后,NH3被吸收.


NO2和O2与水接触会产生下面所示的反应:


生成的NO2跟水再次发生反应:

因为上面的①、②属于循环反应,因此可以将反应①×2+反应②,消去中间的产物NO,从而得出:

如果反应④中的O2剩余,那么将把带火星的木条插进去,木条会复燃.但是题目中的木条并不复燃,这表明没有O2剩余.根据反应③可以知道,剩余的气体是NO,它的体积在标准状况下是2.24 L,质量为m(NO).
×30 g/mol =3.0 g
根据质量守恒定律,混合气体的质量m为:m(总)=45.75 g+3.0 g=48.75 g
混合气体的物质的量为:
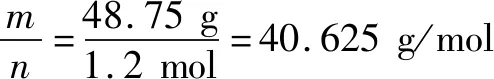
摩尔质量的数值和相对分子质量的数值相等,所以选A.
三、原子守恒法
原子守恒法,就是在化学反应前后原子的数量和种类都保持不变,并且每个元素的原子个数也保持不变.因此利用化学反应中原子的这一特性进行解决的方法就是原子守恒法.
例3 38.4 mg铜跟适量的浓HNO3反应,铜全部作用后,共收集到气体22.4 mL(标准状况).反应消耗的HNO3物质的量可能为( ).
A.1.6×10-3mol B.2.0×10-3mol
C.2.2×10-3mol D.2.4×10-3mol
解法一根据常规的方法,首先列出化学方程式,然后求解.
设生成的NO2、NO分别为x、y.由题意可知Cu的相对原子质量是64,所以

1 4 2
0.5x2xx

3 8 2
1.5y4yy
解得x=0.9×10-3moly=0.1×10-3mol
在化学反应中所消耗掉的HNO3:2x+4y=2×0.9×10-3mol+4×0.1×10-3mol=2.2×10-3mol,因此选C.
解法二原子守恒法
根据分析可以知道Cu与HNO3反应之后生成了Cu(NO3)2和NOx,在反应中HNO3既起到了酸的作用,也起到了氧化剂的作用,因此根据N原子守恒可得:
Cu - Cu(NO3)2-2HNO3(酸)
1 1 2
NOx- HNO3(氧化剂)
1 1
反应中共消耗HNO3:1.2×10-3mol+1×10-3mol=2.2×10-3mol.因此选C.
总之,守恒定律是化学世界中永远不变的一个主题,守恒法是在守恒定律的基础上延伸和发展而来的.守恒法在化学解题中有着重要的处理依据,能够有效提高解题效率,节约时间.本文通过以上对高中化学解题法中守恒法的集中应用实践进行分析,希望能够为高中学生提供有效的理论指导,从而提高解题效率,灵活地运用守恒法,为高考奠定坚实的基础.
