脂肪干细胞抑制老年类风湿关节炎小鼠的炎症反应
2019-07-01李宏亮孙璇龚芸芸成嘉祁刘畅刘明珠王生存刘春王庆华邵义祥
李宏亮 孙璇 龚芸芸 成嘉祁 刘畅 刘明珠 王生存 刘春 王庆华 邵义祥
(南通大学 1杏林学院,江苏 南通 226001;2医学院;3实验动物中心)
类风湿关节炎(RA)是以对称性滑膜慢性炎症、关节软骨和骨破坏为特征的一种系统性自身免疫性疾病〔1〕。临床表现为多关节炎,主要累及手、腕、足等小关节,常反复发作,对称分布,迁延难愈,此外还有发热、疲乏等全身表现〔2〕。主要以关节滑膜细胞增生、血管翳形成、炎性细胞浸润、软骨及软骨下骨破坏为病理变化,最终导致关节畸形强直,功能障碍〔3〕。本病的病因尚未完全阐明,多认为与感染、遗传、环境、性激素水平及营养不良、外伤、劳累、神经精神状态有关〔4,5〕。目前国内外对RA的治疗主要采取药物治疗、外科治疗和心理康复治疗。药物治疗主要以非甾体类抗炎药、抗风湿药、糖皮质激素和植物制剂为主〔6〕,但效果不甚明显,其发病率和致残率仍居高不下。目前RA治疗的最终目标是防止和控制关节损坏,阻止功能丧失。近年来干细胞技术在世界范围内被广泛成熟应用,脂肪干细胞(ADSCs)是从脂肪组织中分离得到的一种具有多向分化潜能的干细胞〔7〕。具有广泛增殖和分化成多个细胞系的能力〔8〕,主要功能为组织细胞修复,促进细胞再生及免疫调控〔9,10〕。ADSCs因其诸多的优势功能及来源广泛、取材方便、不易衰老、排斥反应低等特点被大量的应用于临床治疗,成为骨组织工程研究的热点〔11,12〕。研究发现其具有抑制效应T细胞和调节炎症反应的能力〔13〕。但目前尚未见其用于治疗RA的报道。本研究旨在探讨ADSCs在RA治疗中的抗炎作用及其机制。
1 材料与方法
1.1主要试剂 鸡Ⅱ型胶原(CⅡ)购自Sigma公司产品,实时荧光定量-聚合酶链反应(RT-PCR)试剂盒、逆转录试剂盒及Trizol购自南京诺维赞生物技术有限公司产品;苏木素-伊红(HE)染色试剂盒购自索莱宝生物科技有限公司产品;白细胞介素(IL)-1β、IL-10、IL-6及肿瘤坏死因子(TNF)-α检测试剂盒购自武汉优尔生公司;引物由南京思普金生物科技有限公司合成。小鼠ADSCs由南京大学模式动物研究所提供。
1.2实验动物 健康雌性SPF级C5BL/6J小鼠30只,8周龄,23~27 g,由南通大学实验动物中心提供〔实验动物生产许可证号:SCXK(苏)2014-0001〕。饲养于实验动物中心屏障环境动物实验室〔SYXK(苏):2015-0016〕,5只/笼,相对湿度40%~70%,12 h/12 h明暗周期光照,温度22~25℃,自由采食和饮水。实验动物饲养及取材操作规程获得南通大学实验动物管理委员会批准。
1.3RA模型的诱导 CⅡ以2 mg/ml的浓度溶解于0.1 mol/L pH3.2的乙酸中,置于4℃冰箱中过夜充分溶解。次日用等体积的完全弗氏佐剂(CFA)混合乳化,随后每只老鼠以100 μl剂量尾部皮下均匀注射4~6个点。注射日计作0 d,其后每日观察小鼠关节炎症情况。第7天进行加强免疫,每只小鼠腹腔注射100 μl的CⅡ/CFA乳剂;第14天再次加强免疫,每只小鼠腹腔与尾部皮下各注射100 μl的CⅡ/CFA乳剂,皮下多点注射,最终存活个体作为实验对象。随机抽取3只小鼠进行X线平片(X-Ray)检测,并结合小鼠关节炎评分确定造模是否成功。
1.4ADSCs治疗及取材 ADSCs采用胶原酶裂解法获得,用标准高糖混合F12培养基(DMEM-F12)进行扩增。第3代ADSCs被用于RA模型的治疗,治疗前检测微生物和内毒素。当小鼠关节炎评分>2分,并确认造模成功后进行干细胞治疗,治疗组小鼠尾静脉注射含有2×106个ADSCs的DMEM-F12培养液200 μl,对照组小鼠注射等量DMEM-F12,并计作0 d。在7 d、14 d再次进行治疗。小鼠双后足踝关节注射CⅡ/CFA乳剂诱导炎症发生5 d后,用便携式测厚仪测量各组小鼠双侧踝关节直径,并根据其肿胀程度进行关节评分,每隔2天检测1次,至第35天。小鼠踝关节的病变程度按5级评分法,评分标准:关节无红肿计0分;踝关节轻度红肿,不累及足趾计1分;踝关节轻度红肿,累及足趾计2分;踝关节中度红肿,并伴有组织肿胀计3分;踝关节重度红肿,并出现功能障碍计4分。开始治疗后30 d,动物麻醉后心脏采血,取膝关节滑膜及周围组织置于4%多聚甲醛溶液(PFA)中固定,4℃保存备用。
1.5病理学切片制作及分析 膝关节滑膜及周围组织在PFA中充分固定后,磷酸盐缓冲液(PBS)清洗1 h,重复1次,接着10%乙二胺四乙酸(EDTA)溶液脱钙处理4 w,随后经30%、50%、70%、80、90%乙醇溶液各1 h,无水乙醇1 h,重复1次,二甲苯透明30 min,重复1次,透蜡2 h,重复1次,包埋,徕卡石蜡切片机行5 μm切片,常规脱蜡复水后进行HE染色,中性树胶封片后镜检并拍照存储。
1.6RNA提取及qRT-PCR分析 膝关节滑膜及周围组织经液氮处理后存放于-80℃冰箱,检测时取出加入1 ml总RNA提取试剂(Trizol)后冰浴匀浆,在室温下静置5 min后于4℃下12 000 r/min离心15 min,上清液用异丙醇沉淀RNA,再次离心10 min,75%乙醇洗涤,焦碳酸二乙酯(DEPC)水溶解并测定浓度。0.8%的琼脂糖凝胶电泳检测RNA完整性后,将RNA逆转录成cDNA,并利用SYBR荧光体系在ABI7300上进行qRT-PCR检测,每个样品设3个复孔,计算2-ΔΔCt值,以GAPDH为内参,引物序列:IL-10:正向:5′-CAGAGTCTAGGATGGGTTCATTAC-3′,反向:5′-TCCCAGCTGCACTTCATTT-3′;IL-6:正向:5′-GTCAACTCCATCTGCCCTTC-3′,反向:5′-TGTGGGTGGTATCCTCTGTG-3′;IL-1β:正向:5′-GA AGAAGAGCCCATCCTCTG-3′,反向:5′-TCATCTCGGAGCCTGTAGTG-3′;TNF-α:正向:5′-CCAAAGGGATGAGAAGTTCC-3′,反向:5′-CTCCACTTGGTGGTTTGCTA-3;GAPDH:正向:5′-GAAGGTGAAGGTCGGAGTC-3′,反向:5′-GAAGATGGTGATGGGATTTC-3′。
1.7酶联免疫吸附试验(ELISA) IL-1β、IL-10及TNF-α按照试剂盒说明书进行检测。
1.8统计分析 采用SPSS23.0软件进行t检验。
2 结 果
2.1小鼠关节直径及肿胀程度测定 模型组小鼠的评分始终维持在4分水平,而干细胞组小鼠的评分在用药后第20天基本达到2分甚至1分,说明其肿胀程度被明显抑制。
2.2两组关节水肿情况 从外观上发现模型组小鼠双足踝关节有明显的肿胀,皮肤颜色较深,伴有运动功能障碍,甚至出现跛行。相较于模型组,干细胞组关节肿胀程度明显被抑制(图1)。
2.3两组关节病理情况 经HE染色,模型组踝关节出现典型的炎症表现,如软骨损伤,滑膜增生,大量的炎性细胞浸润。而干细胞组关节病理变化得到显著改善,软骨损伤及滑膜增生减轻,炎性细胞浸润明显减少(图2)。
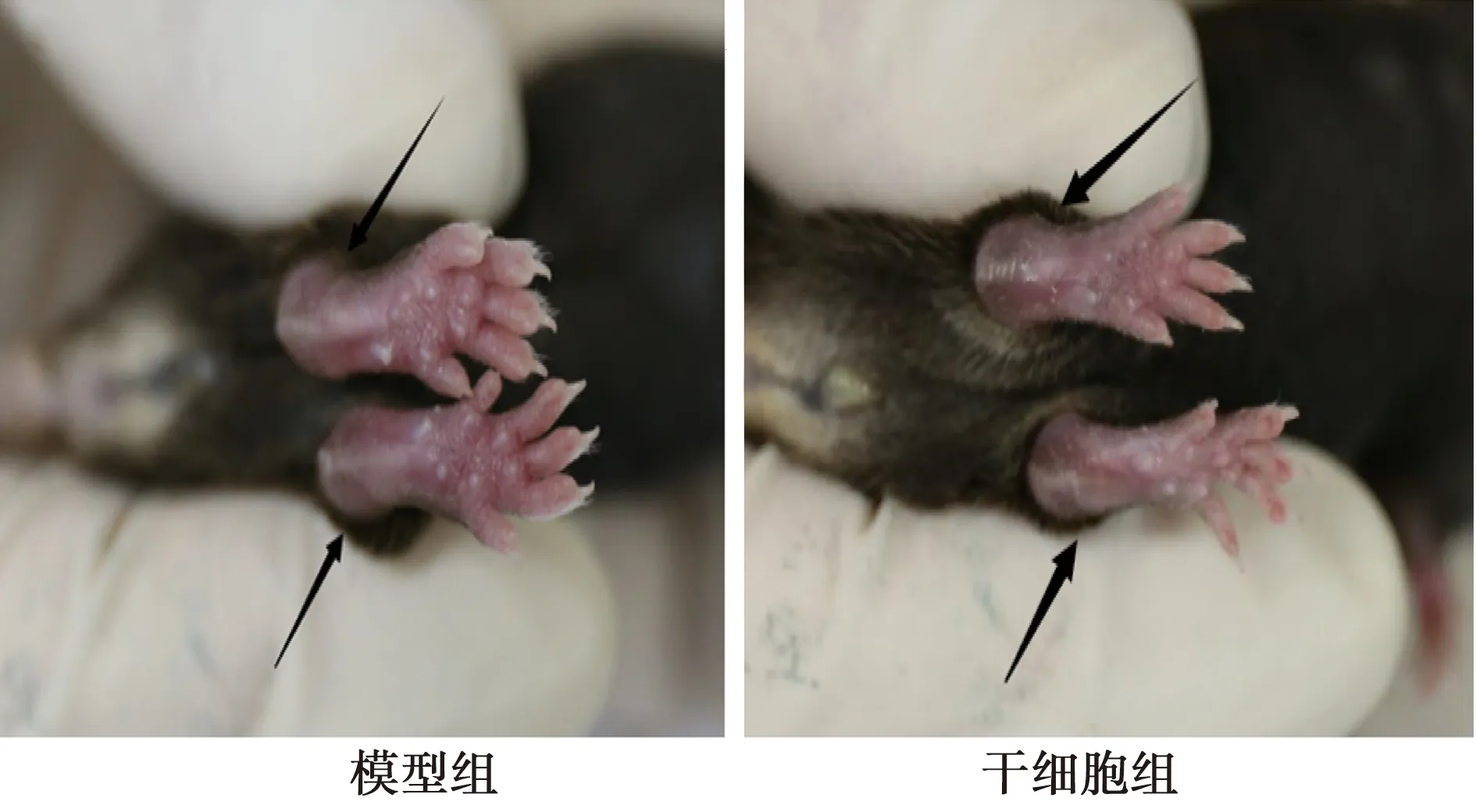
图1 两组小鼠关节水肿情况

图2 两组关节病理情况(HE染色)
2.4两组关节炎症因子表达情况 干细胞组治疗后关节组织中TNF-α、IL-1β、IL-6水平极显著下降(P<0.001)。而IL-10的表达量则表现出相反的趋势,干细胞组治疗后其表达量极显著升高(P<0.001)。干细胞组血清中TNF-α,IL-1β呈极显著降低,IL-10呈极显著增加(P<0.001),见表1。
表1 两组炎症因子表达情况
与模型组比较:1)P<0.001
3 讨 论
采用鸡胶原法诱导的小鼠关节炎模型能够较好地模拟人类RA的临床表现,是筛选和研究治疗RA药物的良好模型。多种炎症因子参与RA疾病的发生及发展,TNF-α及其受体、IL发挥着不可忽视的作用〔14〕。IL-6是骨吸收的主要调节者,低浓度IL-6刺激破骨细胞形成,较高浓度则能刺激成熟的破骨细胞骨吸收功能。在RA发生过程中,成骨细胞在外界刺激下产生IL-6,IL-6与受体复合物及膜受体糖蛋白130结合,启动下游多种转录因子,促进单核细胞融合,刺激多核破骨细胞的分化成熟,促进急性时相反应蛋白的表达与分泌,最终导致炎症细胞过度增殖和自身免疫性损伤〔15,16〕。
ADSCs能直接或间接作用于T细胞、B细胞、树突细胞、自然杀伤细胞、巨噬细胞等免疫细胞,从而抑制IL-1β,TNF-α,干扰素(IFN)-γ,IL-6等炎症因子的表达,诱导IL-10等抗炎因子的产生〔17〕。
本研究ADSCs显著抑制了RA小鼠关节局部TNF-α、IL-1β、IL-6的转录水平,同时显著提高了IL-10的转录水平与表达。证明ADSCs对RA小鼠具有良好的治疗作用,其作用机制及靶点值得进一步研究。
