慢病毒介导SOX4表达下调对乳腺癌细胞生长及迁移能力的影响
2019-07-01过一清郑华蒋子龙
过一清 郑华 蒋子龙
(1甘肃省第二人民医院普外科,甘肃 兰州 730000;2兰州市妇幼保健院超声科)
乳腺癌靶向基因治疗成为研究热点〔1〕。性别决定区Y框蛋白(SOX)4是一个转录调控因子,其在人类胚胎发育的周围神经组织、脾脏、毛囊等组织中广泛表达,在成年人的卵巢、胸腺、乳腺等组织的特定细胞中表达,SOX4参与骨骼、胰岛、心脏等发育过程,与骨质疏松、肿瘤等疾病的发生有关〔2~4〕。研究显示,SOX4在子宫内膜癌、胆囊癌、前列腺癌等肿瘤组织中高表达,沉默SOX4可以抑制黑色素瘤等肿瘤细胞的转移和生长,SOX4在肿瘤发生中发挥促进作用〔2,5~7〕。SOX4在乳腺癌组织中有较高水平的表达,并且其表达水平的高低与淋巴结的转移相关〔8〕。本研究探讨敲减SOX4对乳腺癌细胞生长、侵袭和迁移的影响。
1 材料与方法
1.1材料 乳腺癌MCF-7细胞购自美国ATCC,细胞培养参数为:饱和湿度,37℃,5% CO2培养箱。兔抗细胞周期蛋白(Cyclin)D1一抗、兔抗p21一抗购自武汉伊莱瑞特生物科技股份有限公司;SOX4 siRNA重组慢病毒、阴性对照重组慢病毒均由上海锐赛生物技术有限公司构建包装;TRIZOL试剂购自美国Invitrogen公司;PCR所用试剂购自大连TaRaka公司;兔抗波形蛋白(Vimentin)一抗、兔抗基质金属蛋白酶(MMP)-2一抗购自天津赛尔生物技术有限公司;PI单染细胞周期检测试剂盒购自南京建成生物研究所;兔抗上皮性钙黏附素(E-cadherin)一抗、兔抗MMP-9一抗购自美国Proteintech Group;兔抗SOX4一抗购自美国Santa Cruz Biotechnology公司。
1.2SOX4 siRNA对乳腺癌细胞中SOX4表达影响
1.2.1分组及培养 MCF-7细胞分成3组,把感染SOX4 siRNA重组慢病毒的MCF-7细胞记为Lv-si-SOX4组;把感染阴性对照重组慢病毒的MCF-7细胞记为Lv-NC组;把没有感染重组慢病毒的MCF-7细胞记为Control组。慢病毒感染方法如下:在生长密度为30%~40%的MCF-7细胞中添加慢病毒液,慢病毒感染复数为20,慢病毒感染1 d以后将原病毒液吸弃,添加含有10%胎牛血清的DMEM培养液继续培养,培养3 d后,在荧光显微镜下观察绿色荧光表达情况,感染效率高于85%可用于后续实验。
1.2.2qRT-PCR 在3组细胞中添加TRIZOL裂解液,按照TRIZOL试剂说明书提取各组乳腺癌细胞总RNA。分别取RNA,紫外分光光度计法检测A260 nm/A280 nm在1.8~2.0。用cDNA合成试剂盒,在冰上配制逆转录体系,包括:2 μl 10×RT缓冲液、2 μl脱氧核糖核酸(dNTP)混合物、2 μl寡脱氧核苷酸(Oligo-dT)、1 μl反转录酶、2 μl RNA,最后加去离子水至20 μl,反应条件设置为:37℃,15 min;85℃,5 s;4℃,10 min。引物如下:β-actin正义链5′-CACATCCGTAAAGACCTCTATGCC-3′,反义链5′-ATAGAGCCACCAATCCACACACAG-3′;SOX4正义链5′-CTTGACATGATTAGCTGGCATGATT-3′,反义链5′-CCTGTGCAATATGCCGTGTAGA-3′。cDNA作为模板,进行PCR,反应体系包括:25 μl SYBR GreenⅠ、0.5 μl上游引物、0.5 μl下游引物、23.5 μl无RNA酶的水、0.5 μl cDNA模板,加去离子水至50 μl,PCR条件为:95℃,60 s;95℃,15 s;58℃,30 s;72℃ 30 s,共循环40次。根据ABI7300 PCR程序得到每个反应的Ct值,把β-actin作为内参,根据2-△△Ct法计算不同组乳腺癌细胞中SOX4表达水平。
1.2.3Western印迹法 在3组细胞中添加含有1 mmol/L苯甲基磺酞氟(PMSF)的RIPA的裂解液,放在冰上反应30 min以后,在4℃低温离心,吸取上清在-80℃保存。以二喹啉甲酸(BCA)法蛋白定量分析以后,配制十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE),凝胶使用10%的分离胶和5%的上层胶。把蛋白样品与1倍体积的2×结合缓冲液混合以后,置于100℃水浴中反应5 min。按照每孔内添加30 μg蛋白样品计算,80 V电泳40 min以后,120 V电泳直至染料进入到凝胶的底部。用半干式电转膜方法将蛋白转移到聚偏氟乙烯(PVDF)膜上,转膜电流为150 mA。免疫反应:取电转以后的PVDF膜放在5%脱脂奶粉封闭液中孵育1 h,置于TBST中洗膜3次,再放在1∶800稀释的SOX4一抗反应液中室温结合2 h,同样用TBST洗膜3次,与1∶2 000稀释的二抗反应后,TBST洗膜3次。按照电化学发光(ECL)试剂盒发光以后,测定各组SOX4和β-actin条带的灰度值,β-actin为内参,计算分析SOX4蛋白水平。
1.3噻唑蓝(MTT)检测细胞增殖 3组细胞密度调整为5×107个细胞/L,接种到96孔板中,每个孔内添加100 μl的细胞悬液,用磷酸盐缓冲液(PBS)将边缘的各孔填充。分别在细胞培养至1 d、2 d、3 d、4 d时取出细胞培养板,在每个孔内添加0.5%的MTT溶液(每孔中添加20 μl),继续培养4 h以后,将孔内的液体小心吸除,添加150 μl的二甲基亚砜溶液,放在摇床上震荡结合10 min后,使结晶物充分溶解,将培养板置于酶标仪上测定570 nm波长处的A值。
1.4流式细胞术检测细胞周期 3组细胞用0.25%的胰蛋白酶消化以后,配制成单细胞悬浮液,以1 200 r/min离心10 min以后,加入PBS将细胞中血清去除。在细胞中添加70%的乙醇溶液固定后,保存在4℃。加入10 mg/L的碘化丙啶(PI)染液孵育5 min后,放在4℃避光反应30 min,用流式细胞仪检测周期变化。
1.5Transwell小室检测细胞侵袭和迁移 侵袭实验步骤为:用50 mg/L的基质胶按照1∶8的比例稀释以后,包被Transwell小室,放在4℃风干以后,置于37℃过夜;用不含血清的细胞培养液将3组细胞稀释以后(此时细胞密度为1×105个/ml),吸取200 μl的细胞悬浮液接种到Transwell小室的上室中,在小室的下室中添加含有胎牛血清的细胞培养液500 μl,培养24 h以后,多聚甲醛固定,以结晶紫染色以后,选取5个视野,计数侵袭细胞数目。迁移实验前不用基质胶包被Transwell小室,其余步骤同侵袭实验。
1.6Western印迹检测细胞中CyclinD1、p21、MMP-2、MMP-9、Vimentin、E-cadherin蛋白表达 取3组细胞,用Western印迹方法检测各组乳腺癌细胞中CyclinD1、p21、MMP-2、MMP-9、Vimentin、E-cadherin蛋白水平,Western印迹步骤同1.2.3。
1.7统计学分析 应用SPSS21.0软件进行单因素方差分析、LSD-t检验。
2 结 果
2.1SOX4 siRNA对乳腺癌细胞中SOX4表达影响 Lv-si-SOX4组SOX4 mRNA和蛋白水平均显著低于Lv-NC组及Control组(均P<0.05),见图1、表1。

图1 Western印迹检测SOX4蛋白表达

组别SOX4 mRNASOX4蛋白Control组1.00±0.000.48±0.06Lv-NC组1.02±0.120.51±0.07Lv-si-SOX4组0.19±0.031)2)0.14±0.021)2)
与Lv-NC组比较:1)P<0.05;与Control组比较:2)P<0.05;下表同
2.2敲减SOX4对乳腺癌细胞增殖影响 Lv-si-SOX4细胞A570值明显低于Control组和Lv-NC组(P<0.05)。见表2。

表2 各组细胞A570值比较
2.3敲减SOX4对乳腺癌细胞周期分布影响 与Control组及Lv-NC组比较,Lv-Si-SOX4组乳腺癌细胞G0/G1比例明显升高,S期及G2/M期细胞比例明显降低,细胞周期促进因子CyclinD1蛋白表达显著下降,细胞周期抑制因子p21蛋白表达水平显著升高(均P<0.05),见图2、表3。
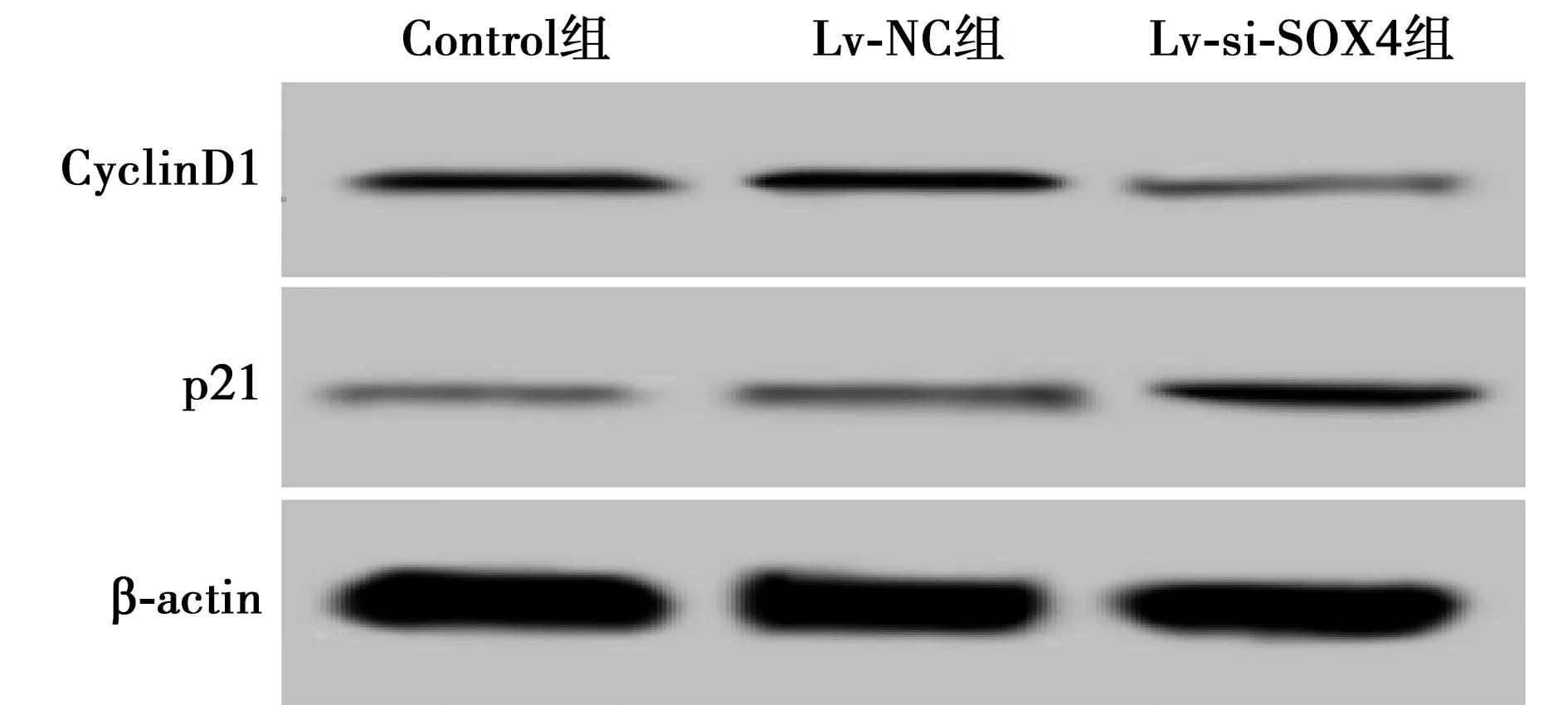
图2 Western印迹检测CyclinD1、p21蛋白表达

表3 各组乳腺癌细胞周期分布、细胞侵袭、迁移能力及CyclinD1、p21、MMP-2、MMP-9蛋白表达比较
2.4敲减SOX4对乳腺癌细胞侵袭和迁移能力影响 与Control组及Lv-NC组比较,Lv-si-SOX4组细胞侵袭和迁移数目均显著降低,细胞中MMP-2、MMP-9蛋白水平也显著降低(均P<0.05),见表3、图3。

图3 Western印迹检测MMP-2、MMP-9蛋白表达
2.5敲减SOX4对乳腺癌细胞上皮间质转化(EMT)影响 与Control组及Lv-NC组比较,Lv-si-SOX4组上皮标志物E-cadherin蛋白表达水平显著升高,间质标志物Vimentin蛋白表达水平显著降低(均P<0.05),见表4和图4。

图4 Western印迹检测Vimentin、E-cadherin蛋白表达

组别VimentinE-cadherinControl组0.87±0.070.29±0.04Lv-NC组0.90±0.110.30±0.03Lv-si-SOX4组0.25±0.061)2)0.42±0.051)2)
3 讨 论
SOX4基因是一种单外显子基因,其编码的蛋白质由474个氨基酸组成,SOX4蛋白的C端含有一个转录激活结构域,N端含有一个高迁移率族蛋白(HMG)结构域,HMG结构域能特异性地结合呈直线的DNA双螺旋小沟并促使其弯曲,从而影响染色体的结构,促进转录增强子复合物功能发挥〔9,10〕。SOX4蛋白还含有一个甘氨酸富集区和丝氨酸富集区,能够参与细胞凋亡反应,SOX4在心脏发育、前B细胞生长、胰岛素分泌等过程中具有关键作用,SOX4是一个具有多种生物学功能的转录调控因子〔11,12〕。研究表明,SOX4可能具有促进肿瘤发展的作用,SOX4异常过表达可能是肿瘤患者预后差的标记基因,高表达SOX4的膀胱癌等肿瘤细胞更容易形成转移灶,同样在血液系统恶性肿瘤中也发现SOX4高表达〔13,14〕。SOX4过度高表达可能与乳腺癌的转移有关〔15〕。
本实验表明,敲减SOX4后的乳腺癌细胞的增殖能力降低,细胞周期被阻滞在G0/G1期,细胞的侵袭和迁移能力也下降,提示敲减SOX4具有抑制乳腺癌细胞生长和转移的作用。之前的研究报道表明,SOX4具有促进细胞增殖的作用,敲减SOX4后的黑色素瘤细胞G1期进入S期的比例减少,细胞增殖能力降低〔16〕。G0/G1期向S期转变是细胞周期中的关键调控点,其受到细胞内CyclinD1、p21等周期相关蛋白的调控作用,CyclinD1具有促进细胞从G0/G1期向S期转变的作用,p21具有阻碍细胞从G0/G1期向S期转变的作用〔17,18〕。本实验表明,敲减SOX4后的乳腺癌细胞中的CyclinD1蛋白表达水平降低,p21蛋白表达水平升高,敲减SOX4可以通过调控细胞周期相关蛋白的表达抑制细胞从G0/G1期向S期进展,从而发挥抑制乳腺癌细胞增殖的作用。
肿瘤细胞EMT是肿瘤转移的早期标志,在这一过程中,肿瘤细胞上皮特性逐渐消失,E-cadherin等上皮细胞标志物的表达降低,与此同时细胞逐渐表现出间质细胞特性,间质细胞标志物Vimentin表达水平升高〔19,20〕。肿瘤转移与肿瘤细胞降解细胞外基质有关,肿瘤细胞从原发部位脱落以后,黏附于细胞外基质上,并通过分泌细胞外基质降解酶进入血管及淋巴管,形成新的并发灶〔21,22〕。MMP-2和MMP-9是MMPs家族的成员,也是目前为止发现的与肿瘤转移关系最为密切的细胞外基质降解酶,二者表达水平升高标志肿瘤转移的发生〔23〕。SOX4具有调控肿瘤细胞EMT的作用,在肺癌、食管癌等肿瘤细胞中研究均表明,沉默SOX4可以抑制肿瘤细胞EMT并下调肿瘤细胞转移能力〔24,25〕。本实验的结果显示,敲减SOX4后的乳腺癌细胞侵袭和迁移能力降低,细胞EMT水平也下降,细胞合成的MMP-2和MMP-9减少,说明敲减SOX4具有抗乳腺癌细胞转移潜能的作用。
综上,靶向SOX4可能是治疗乳腺癌的有效途径,敲减SOX4具有抑制乳腺癌细胞增殖,阻滞细胞周期,抑制细胞侵袭和迁移的能力,这为研究SOX4在恶性肿瘤发生中的作用机制奠定了基础。本实验只初步探讨了敲减SOX4对乳腺癌细胞恶性表型的影响,对于其具体的作用机制尚未研究,在以后的实验中会对其机制进行具体分析。
