沉默S100A4基因对乳腺癌上皮间质转换的影响
2019-06-27李丽春
李丽春,陈 瑶,付 梅,何 谦
乳腺癌是最常见的女性恶性肿瘤之一[1],近几年其在诊断和治疗方式上都有一定的进展,但是其5年生存期仍然较低,主要原因是其发生转移[2]。上皮间质转换(EMT)在细胞分化过程中发挥着重要的作用,近年来在肿瘤的演进中受到关注,并且认为其是导致肿瘤侵袭转移的主要机制之一[3]。有文献报道,其参与乳腺癌的侵袭和转移[4]。EMT过程中,上皮细胞标志物E-cadherin下降,间质细胞标志物N-cadherin上调,导致细胞获得一定的运动能力[5],同时Slug、Snail作为转录因子也参与EMT过程[6]。S100A4基因定位于1号染色体长臂2区1带,其表达的蛋白是钙结合蛋白S100家族的主要成员之一,其主要功能是调节细胞粘附能力。有研究报道,S100A4在乳腺癌、胃癌、鼻咽癌、甲状腺癌、膀胱癌等肿瘤组织中高表达[7-8]。有文献提示,S100A4可能也参与与乳腺癌的侵袭和转移,并且与乳腺癌的临床病理参数以及预后相关,但S100A4是否是通过调节EMT过程进而影响乳腺癌的临床病理变化及预后[9],目前尚未完全清楚。因此,本实验研究了沉默S100A4基因对乳腺癌EMT过程的影响,为进一步阐明乳腺癌的发病机制提供理论依据。
1 材料与方法
1.1 主要试剂与设备 MCF-7和MDA-MB-231细胞购自上海生物制品研究所;S100A4和非特异性阴性对照序列的siRNA购自上海生博生物医药科技有限公司;胎牛血清和青、链霉素溶液、DMEM购自美国 Gibco公司,TRIzol和 RT试剂盒购自大连TaKaRa公司,SYBR Green PCR混合液购自美国Life technology公司,BCA蛋白浓度检测试剂盒、RIPA细胞裂解液裂解均购自上海碧云天生物技术有限公司。所用引物由武汉金开瑞生物工程有限公司合成,Lipoctamine2000购自美国 Thermo Fisher Scientific公司 ,实验所用一抗(β-actin,Slug,N-cadherin,S100A4和Snail)均购自美国Cell Signaling Technology公司,E-cadherin购自美国Abcam公司,抗兔 IgG(H+L)、 抗鼠 IgG(H+L)、Super ECL Plus Western Blotting Substrate化学发光显影液、DEPC水均购自上海碧云天生物技术有限公司;凝胶图像分析系统和PCR仪均购自美国Bio-Rad公司。
1.2 细胞与组织标本 MCF-7和MDA-MB-231细胞于 37℃、5%CO2、95%大气条件下培养,每2 d更换一次培养基。本实验所用细胞均处于对数生长期。
组织样本来自医院乳腺外科收治的4例乳腺癌患者,均经3位病理医生诊断,组织学类型均为原发浸润性导管癌。肿瘤组织和正常组织标本分别取自瘤体和距离瘤体2 cm外正常乳腺组织。本研究经医院医学伦理委员会的批准,所有参与研究的患者知晓本研究并签署了知情同意书。
1.3 细胞转染和分组 将S100A4和非特异性阴性对照序列的siRNA分别转染至人乳腺癌MCF-7和MDA-MB-231细胞,分别作为S100A4基因沉默组(基因沉默组)和阴性对照组,转染步骤按脂质体Lipoctamine2000说明书操作。
1.4 Western blot实验 Western blot实验检测S100A4蛋白在人乳腺癌组织样本中的表达水平以及 S100A4、N-cadherin、E-cadherin、Slug、Snail 蛋 白在基因沉默组和阴性对照组中的表达水平。方法概述如下:转染了siRAN和阴性对照的细胞或者新鲜组织收集于1.5 ml的EP管中,用RIPA细胞裂解液裂解,BCA方法测量蛋白浓度。实验的蛋白样本用RIPA调整至相同的浓度,蛋白样品上样电泳2 h后转膜,用含5%脱脂奶粉封闭液封闭2 h,一抗孵育过夜(4℃);次日用TBST浸洗1 h,然后用对应的二抗孵育 2 h,TBST浸洗 45 min,最后用 Super ECL Plus Western Blotting Substrate化学发光显影液显影。
1.5 RT-PCR 检测S100A4基因在人乳腺癌组织样本中的表达水平以及 S100A4、N-cadherin、E-cadherin、Slug、Snail基因在 S100A4 基因沉默组(沉默组)和阴性对照组(对照组)中的表达水平。方法概述如下:采用TRIzol法提取组织样本或者细胞mRNA,按逆转录试剂盒说明书进行RNA逆转录反应合成cDNA。反应体系如下:2 μg的mRNA加8 μl的5×primeScript mix缓冲液,然后用DEPC水补充至40 μl。然后进行实时荧光定量PCR,方法参照RT试剂盒和SYBR Green PCR试剂盒说明书。各组基因表达的相对差异用循环数(ct)表示,每个样品的ct值用B-actin进行校正,
1.6 统计学方法 应用PASW Statistics统计软件进行分析,Graghpad Prism 6.2软件进行统计图制作。计量数据以±s表示,多组比较时行方差分析法,两组比较行独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 S100A4基因和蛋白在乳腺组织中的表达水平比较 Western blot实验结果显示,S100A4蛋白在乳腺癌组织中表达明显上调(表 1);RT-PCR实验结果显示,S100A4基因在乳腺癌组织中表达明显上调(表 2)。

表1 S100A4蛋白在乳腺癌组织及正常组织表达比较
2.2 S100A4基因和蛋白在转染siRNA乳腺细胞中的表达水平比较 Western blot实验分析显示,乳腺癌细胞转染siRNA后,S100A4蛋白表达水平下调(MCF-7 细胞:(104.1±11.36)vs(61.61±9.96);MDA-MB-231 细胞:(185.23±10.54)vs(136.78±9.32);RT-PCR实验也显示,乳腺癌细胞转染siRNA后,S100A4基因表达水平降低(MCF-7 细胞:(31.87±0.15)vs(23.11±0.65);MDA-MB-231 细胞:(26.61±0.03)vs(20.52±0.09)。

表2 S100A4基因在乳腺癌组织及正常组织表达比较
2.3 基因沉默组与阴性对照组EMT相关蛋白和基因表达水平比较 Western blot(表3)和 RT-PCR(表 4)实验结果显示,N-cadherin、Snail、Slug 蛋白和基因表达水平在基因沉默组明显降低,而E-cadherin明显上调。
3 讨论
乳腺癌是发生于女性群体中最常见的恶性肿瘤之一。肿瘤侵袭至周围组织和发生转移是导致乳腺癌患者预后差的主要因素之一。有文献报道,S100家族参与调节多种肿瘤的侵袭和转移[10-11]。本实验证明,S100家族的重要的成员之一S100A4在乳腺癌组织中的表达明显上调,与Wang等[11]的报道一致。提示S100A4可能参与乳腺癌的生物学行为的调节。EMT参与结直肠癌、乳腺癌、卵巢癌等多种肿瘤侵袭和转移。有文献报道,S100A4参与调节人卵巢癌[12]、胰腺癌[13]、肝细胞肝癌[14]等的 EMT过程。EMT过程中,上皮细胞相关标志物E-cadherin明显下调,间质相关标志物N-cadherin明显上调,Snail和Slug是参与调节EMT过程的重要的转录因子。本实验结果显示,沉默S100A4的乳腺癌细胞能上调E-cadherin表达水平,下调N-cadherin、Snail和Slug的表达,提示S100A4参与调节EMT过程。有文献报道,敲低S100A4能抑制Src-FAK信号通路的激活[15],此信号通路的激活能促进EMT[16-17]。Xu等[13]报道,S100A4通过调节Shh-Gli1信号通路,进而参与EMT的调节。故推测在人乳腺癌中,S100A4通过激活Src-FAK或者Shh-Gli1信号通路,进而激活EMT过程。Rudland等[18]报道,S100A4与乳腺癌患者的预后呈现负相关。本实验证明,S100A4参与调节乳腺癌的EMT过程,而EMT是导致患者发生转移的主要机制之一,推测S100A4可能上调EMT过程,导致乳腺癌患者发生转移,进而影响患者的预后。

表3 沉默组与对照组EMT 相关蛋白表达水平比较(n=3)
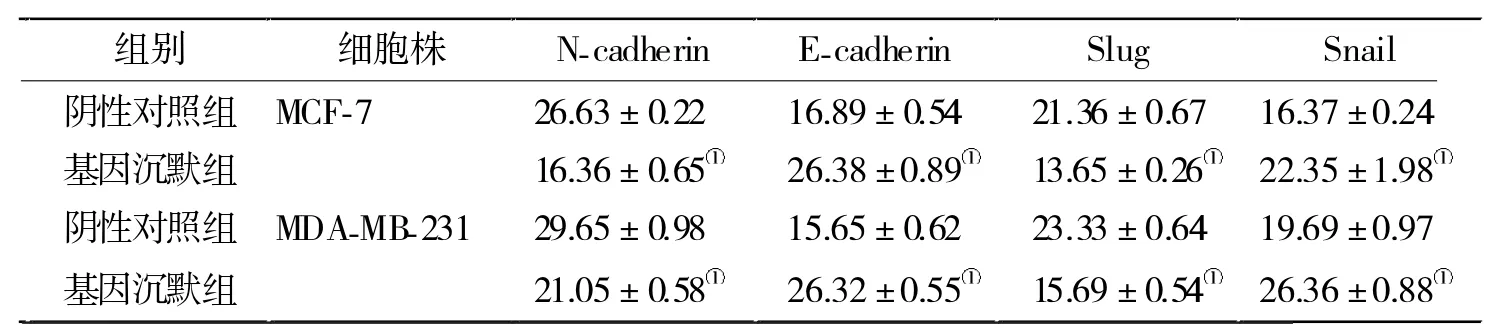
表4 沉默组与对照组EMT 相关基因表达水平比较(n=3)
综上所述,S100A4通过调节EMT过程,促进乳腺癌的侵袭和迁移,其可能成为乳腺癌治疗新的靶标分子。
