CJ016对H1975细胞周期和细胞凋亡的影响
2019-06-27谭永红
万 丹,甘 萍,谭永红
小分子抗肿瘤化合物因其结构简单,代谢途径和作用机理便于研究分析,同时合成途径相对简捷,以及经济、低毒等特点而备受关注。在基因突变或缺失导致癌症发生的进程中,组蛋白去乙酰化酶(HDACs)能通过反向调节染色质修饰来影响基因表达,诱发癌症发生、发展,目前已成为治疗癌症的一个潜在靶点[1-3]。近年来,已发现几类抗癌活性较好且特异性强的HDACs抑制剂,有些已进入临床治疗。但是,这HDACs抑制剂多被用于血液瘤等疾病的治疗,在面对肺癌、肝癌这些多见实体瘤时,疗效却不尽如人意。为了能改善HDACs抑制剂治疗实体瘤的疗效,本课题组自主合成了小分子化合物CJ016(图1),同时选择吉非替尼耐药的H1975细胞作为研究对象,观察CJ016对H1975细胞周期和细胞凋亡的影响,从而分析其抗肿瘤作用机制,为进一步研究提供理论基础[4]。
1 材料与方法
1.1 材料
1.1.1 细胞株 人非小细胞肺癌细胞株(NCIH1975)购自中科院上海生命科学院细胞资源中心。
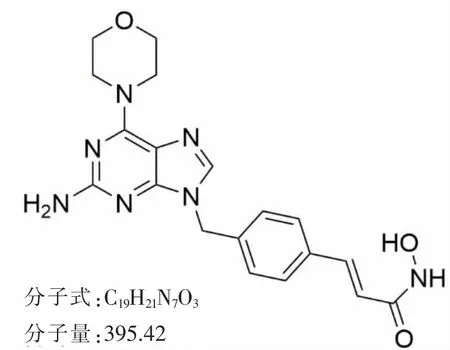
图1 CJ016分子结构式
1.1.2 试剂与设备 化合物CJ016由本课题组自主合成、纯化;紫杉醇(Paclitaxel,PTX)购自大连美仑生物技术有限公司;碘化丙啶(PI)、Annexin V购自美国Sigma公司;MTT购自美国Sigma公司,规格1 g/瓶;RPMI-1640培养基购自美国HyClone公司;优级胎牛血清购自草原绿野生物工程材料有限公司;M5型全波长酶标仪购自美国Molecular公司,FASC420型流式细胞仪购自美国Thremo公司。
1.2 方法
1.2.1 细胞培养 H1975细胞培养于含10%胎牛血清的RPMI-1640培养基中,细胞复苏后,每48 h传代一次,镜下观察细胞生长形态和密度,在5%CO2和37℃的恒温培养箱内培养,连续传代培养3次,选择生长相对稳定的对数期细胞用于后续研究。
1.2.2 CJ016对H1975细胞增殖的影响 取对数生长期细胞,按4×104个细胞/ml接种于96孔板,100 μl/孔。培养24 h后,分别加入终浓度分别为2.5、5、10、20、40、80 nmol/L 的 CJ016,空白对照组加等体积的培养基,每组6个复孔。继续培养24、48、72 h后,用MTT法检测细胞生长情况并计算细胞抑制率(%)。抑制率(%)=(空白对照组OD值-给药组OD值)/空白对照组OD值×100%。
1.2.3 PI染色测定细胞周期 用0.25%胰酶消化并收集H1975细胞,按4.5×105个细胞/孔的密度接种于6孔培养板中,培养24 h后,加入终浓度分别为 10、20 nmol/L的 CJ016和 20 nmol/L的 PTX,作用24 h后消化并收集细胞,用2 ml PBS洗2次,1000 r/min离心3 min,用预冷的70%乙醇4℃固定过夜。离心,用 Buffer缓冲液 (Rnase A 1 μg/L,EDTA 20 mM/L)重悬后,于室温孵育30 min。加PI染液 0.4 ml(1 mg/L),小心混匀,避光室温染色 1.5 h,用流式细胞仪检测DNA含量[5-7]。
1.2.4 Annexin V/PI双染色检测细胞凋亡 用0.25%胰酶消化并收集H1975细胞,按4.5×105个细胞/孔的密度接种于6孔培养板中,正常培养24 h后,将培养细胞分为4组:CJ016给药组(加入终浓度分别为10、20 nmol/L的CJ016)、PTX组 (加入终浓度为20 nmol/L的PTX)、空白对照组(加入等体积的培养基)。继续培养48 h,消化并收集细胞,用细胞筛过滤。血球计数板计数后,每组收集≥2×105个细胞。用0.3 ml Buffer缓冲液重悬细胞于流式管内,加5 μl的Annexin V-FITC,室温避光染色30 min。加10 μl的PI染液,室温避光染色10 min,用流式细胞仪检测细胞凋亡情况[8-9]。
1.3 统计学方法 应用SPSS19.0统计软件分析数据,实验数据以±s表示,采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 CJ016对H1975细胞增殖的影响 随CJ016给药浓度不断增加,细胞抑制率也相应提高,在80 nmol/L的剂量时,已基本没有细胞存活。同时,随CJ016给药时间不断延长,细胞抑制率也随之增加,72 h时对细胞的抑制活性最大。见图2。
2.2 CJ016对H1975细胞周期的影响 与空白对照组比较 (18.27%),CJ016处理H1975细胞24 h后,能将细胞阻滞在合成期和分裂期(G2/M),10、20 nmol/L的CJ016使G2/M细胞比例明显增加,分别为25.15%和42.11%。同时,S期细胞比例有所增加,G0/G1期细胞比例相对减少,且呈现出一定的剂量差异。见图3。

图2 CJ016对H1975细胞增殖的影响
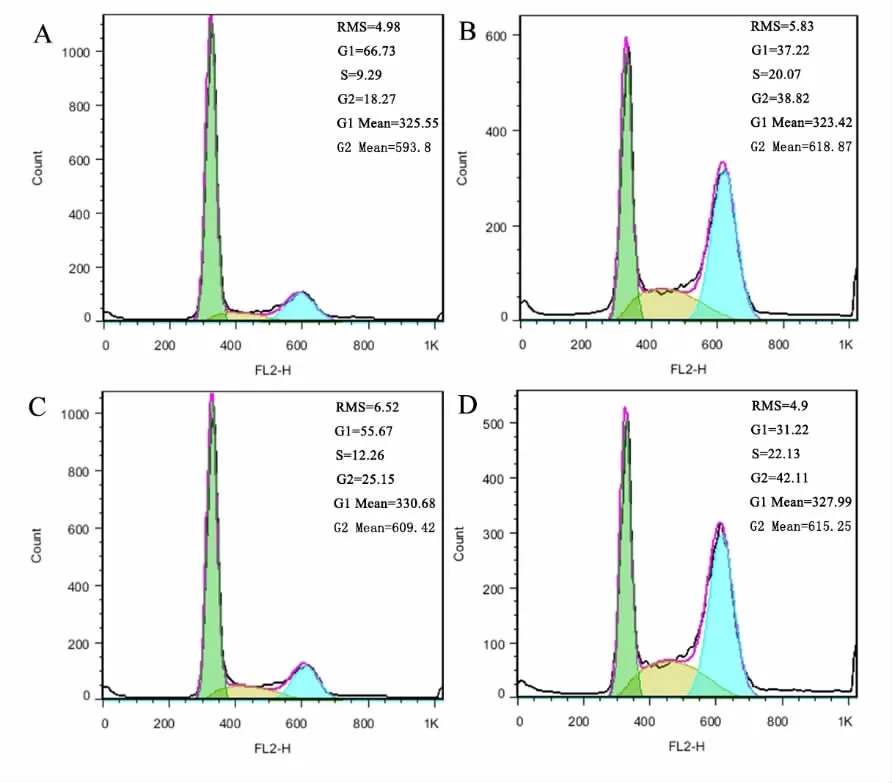
图3 CJ016对H1975细胞周期的影响
2.3 CJ016诱导H1975细胞凋亡 空白对照组发生凋亡的细胞比例很少,凋亡细胞总数<1%;阳性对照紫杉醇组凋亡细胞总数为20.29%。CJ016处理H1975细胞48 h后,细胞凋亡比例明显增加:与空白对照组比较,10 nmol/L的CJ016使细胞早期凋亡(7.52%)和晚期凋亡 (10.1%)的比例明显增加;20 nmol/L的CJ016使细胞晚期凋亡(25.8%)的比例明显增加,且呈现一定的剂量差异。)+见图见图 4。
3 讨论
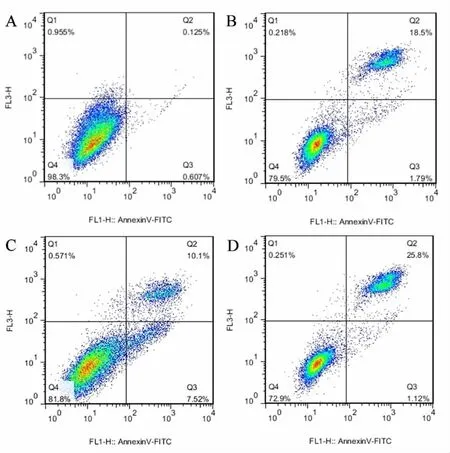
图4 CJ016对H1975细胞凋亡的影响
HDACs是参与人体内染色体重塑的一类重要激酶,其在表观遗传和基因表达中起关键作用,与癌症的发生发展密切相关。小分子化合物因其结构相对简单,合成途径较简捷经济,从而广受关注。因此,利用小分子化合物来治疗癌症的方法在临床上被广泛使用。CJ016作为小分子HDACs抑制剂,在体外能有效抑制H1975细胞增殖,本课题组观察到,当CJ016给药浓度高于20 nmol/L时,镜下观察可见细胞数量明显减少,细胞皱缩变圆,半贴壁或漂浮死亡。且随给药浓度不断增加,抑制作用也随之增强,呈现出较广的治疗窗口。同时,随着作用时间的延长,其对肿瘤细胞的抑制效果也相应增加。流式检测结果发现,10 nmol/L的CJ016处理H1975细胞48 h后,凋亡细胞比例(17.62%)较空白对照组(0.732%)明显增多,凋亡细胞大多处在晚期凋亡中;而20 nmol/L的CJ016诱导细胞凋亡比例 (26.92%)高于10 nmol/L组,存在一定的剂量效应关系,且略优于阳性对照紫杉醇组(20.29%)。表明CJ016能有效诱导H1975细胞发生凋亡,从而抑制肿瘤细胞恶性增殖。从图3也可以看出,CJ016处理H1975细胞24 h后,能剂量依赖地将细胞周期阻滞在G2/M期中,一定程度地减缓细胞正常有丝分裂,起到抑制细胞增殖的作用。
综上所述,CJ016能有效地阻滞H1975细胞分裂增殖,诱导细胞发生凋亡,起到延缓或抑制肿瘤细胞恶性传代的作用,具有一定的抗肿瘤作用。
