Fancm基因敲除小鼠构建及其表型分析
2019-06-27杨桥郭红刚楼琦柯贤福周文伟应华忠俞冰张婷婷
杨桥,郭红刚,楼琦,柯贤福,周文伟,应华忠,俞冰,张婷婷*
(1. 浙江省医学科学院,杭州 310000; 2. 浙江中医药大学,杭州 310000)
范可尼贫血(Fanconi Anemia, FA)又称范可尼贫血综合征,是一种较为少见的隐性遗传疾病[1-2]。FA患者多伴有先天发育异常、进行性骨髓衰竭与高度癌症易感性[3-4]。近年来,范可尼贫血综合征中的不孕不育表型也引起了广泛关注[5-6]。范可尼贫血综合征是由于范可尼贫血通路基因缺失造成的。至今为止,文献中陆续报道了22个范可尼贫血通路基因(FANCAtoFANCV),其中的任何一个发生突变,都会导致范可尼贫血症的发生。范可尼贫血通路蛋白参与DNA交联损伤修复(DNA interstrand crosslinks,ICLs),维护基因组稳定性与完整性[1,7]。范可尼贫血症是研究DNA损伤修复通路在生长发育与肿瘤发生中功能的重要模型。
FANCM是范可尼贫血通路的核心蛋白之一,FANCM识别并且结合到DNA交联损伤的位点,募集并激活下游FANCD2-FANCI复合物,启动DNA损伤修复级联反应[8-9]。德国大学的研究发现FANCM基因突变与家族早发性乳腺癌有显著的相关性,是乳腺癌早期诊断与风险评估的指标[10]。多个国际医学中心都报道了FANCM基因突变与三阴性乳腺癌以及卵巢癌的发病、药物敏感性以及治疗预后的相关性[11-15]。最近多个临床研究证明了FANCM基因突变与遗传性不孕不育的直接相关,多组男性家族性不育症与非阻塞性无精症患者的全基因组测序结果都发现了遗传性FANCM基因变异[16-17]。法国学者还在一个有遗传性卵巢早衰的芬兰家族中发现FANCM基因突变是其致病因素[18]。
本课题组一直致力于范可尼贫血综合征相关基因的研究,为了更好的理解FANCM突变造成的生理学变化,特别是范可尼贫血综合征相关的表型。我们使用CRISPR/Cas9技术构建了Fancm基因敲除小鼠模型,希望借助此小鼠研究Fancm基因缺失对机体所产生的影响。
1 材料与方法
1.1 实验动物
2~4月龄SPF级C57BL/6小鼠80只,体重20~30 g,由上海斯莱克实验动物有限公司提供【SCXK(沪)2017-0005】;2月龄,体重25~30 g,SPF级ICR小鼠5只,由浙江省实验动物中心提供【SCXK(浙)2014-0001】;所有小鼠均饲养于浙江省医学科学院实验动物中心SPF环境【SYXK(浙)2014-0008】。近交系繁育,温度维持在22~25℃,湿度维持在50%~70%,昼夜明暗交替时间为12 h/12 h。所有操作均符合浙江省医学科学院实验动物中心伦理委员会审批(伦理审批号:2018-099)。
1.2 方法
1.2.1 sgRNA体外转录与显微注射
使用文献[19-20]中方法Phusion高保真DNA聚合酶(NEB,美国)PCR快速合成sgRNA转录模板。使用MEGAshortscript转录试剂盒(Ambion,美国)体外合成sgRNA,Megaclear纯化试剂盒(Ambion,美国)纯化sgRNA。选取3~4周龄雌性C57BL/6小鼠进行超数排卵,每只注射10 IU血清促性腺激素(PMSG),46~48 h后再注射10 IU绒膜促性腺激素(HCG),24 h后解剖获取卵母细胞,同时解剖获取8周龄以上C57BL/6雄性小鼠精子,进行体外受精,形成受精卵。利用显微操作仪(Eppendorf,德国)将sgRNA/Cas9 mRNA混合样本注射到受精卵胞质中。注射后将受精卵置于37℃ 5% CO2培养箱培养数小时,取状态良好的受精卵移植到假孕ICR受体小鼠输卵管内,每只受体移植20~30枚受精卵。
1.2.2 基因型鉴定
剪取约3 mm小鼠尾尖组织,用DNA提取试剂盒(生工,中国)提取基因组DNA,进行PCR扩增,引物FAM-F:TGGCGGGAGACTAATGGGCGT;FAM-R:CTATGTCCACAAGAGCCAGCCT。电泳分析并进行测序鉴定。对Fancm-/-小鼠的体形大小、毛色、生长发育周期等进行观察分析[21]。
1.2.3 蛋白免疫印迹鉴定FANCM蛋白表达
取Fancm-/-小鼠与同窝野生型小鼠,脱颈椎猝死解剖获取其睾丸组织,在含有蛋白酶抑制剂裂解液中匀浆提取总蛋白,经6% SDS-PAGE凝胶电泳分离,70 V恒压湿转2.5 h。经Anti-FANCM(Abcam,英国)抗体4℃孵育过夜,TBST洗3次,羊抗兔二抗室温孵育2 h,TBST洗2次,经ECL显影液在化学发光仪中显影成像。
1.2.4 血常规检测
Fancm-/-小鼠与同窝野生型小鼠,戊巴比妥钠麻醉进行眼眶取血约100 μL,使用全自动血液分析仪(Celltace,日本)分析。
1.2.5 H&E染色、IHC免疫组化、TUNEL实验方法
取Fancm-/-小鼠与同窝野生型小鼠,脱颈椎猝死解剖获取其睾丸组织,用4%多聚甲醛溶液过夜固定,组织包埋切片,进行苏木素伊红(H&E)染色、PCNA免疫组化染色、TUNEL染色,显微镜镜检,图像采集分析。
1.3 统计学分析
GraphPad Prism 5.0进行统计学分析,实验数据表达为mean ± SEM,Microsoft Excel 软件进行卡方独立性检验(χ2.TEST),显著性差异表示为*P< 0.05,**P< 0.01,***P< 0.001。
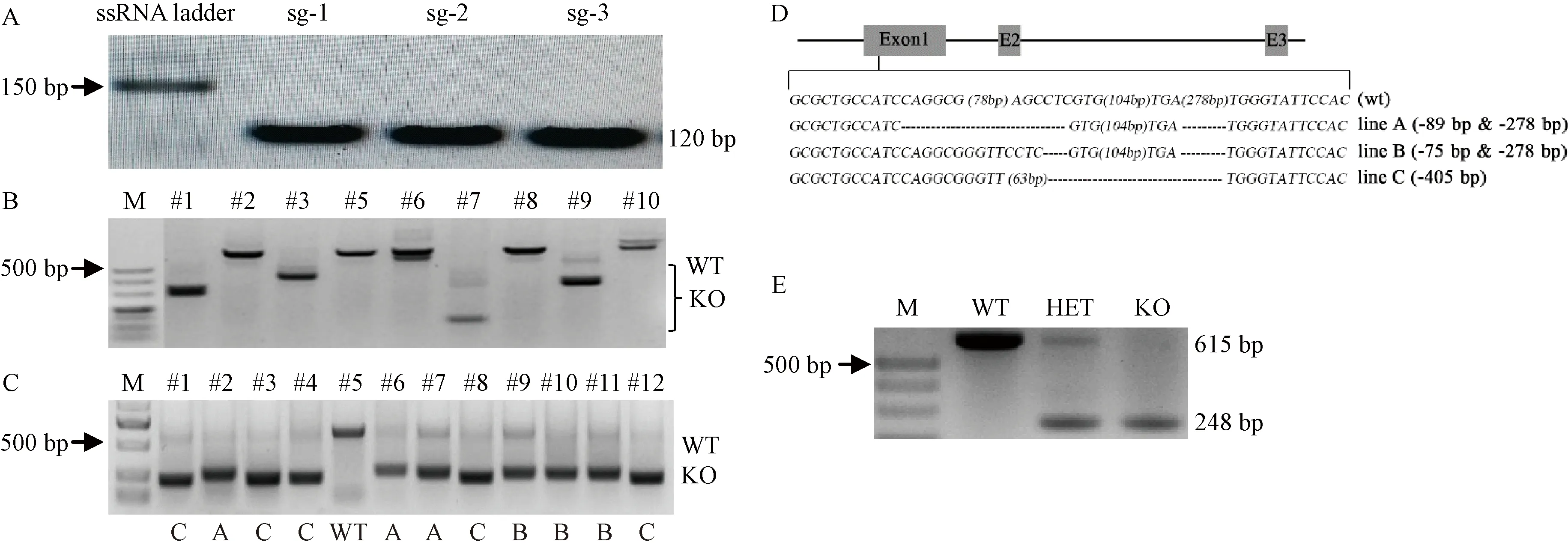
注:A:sgRNA 体外合成与电泳鉴定。B:PCR鉴定F0代嵌合子小鼠,M为Marker DL500。C:选择的F0代小鼠与野生型C57BL/6交配,PCR鉴定F1代杂合子Fancm+/-小鼠,M为Marker DL2000。D:图C中PCR产物测序后,分析F1代小鼠sgRNA靶点敲除序列。“(#bp)”为省略基因编码数,“-”为缺失编码,Exon1、E2、E3分别为外显子1、2、3。E:PCR基因鉴定同窝野生型、杂合Fancm+/-小鼠、纯合Fancm-/-小鼠。WT:野生型Wild type;HET:杂合Heterozygote;KO:敲除Knockout;M为Marker DL500。图1 Fancm基因敲除小鼠的构建与基因鉴定Note. A, In vitro synthesis and electrophoresis identification of sgRNA. B, Identification of F0 chimera mice by PCR. M, Marker DL500. C, Selected F0 chimera mice are mated with wild type C57BL/6 mice. The F1 heterozygous mice is identified by PCR. M, Marker DL2000. D, After sequencing the PCR products in Figure C, the sgRNA target knockout sequences of F1 mice are analyzed. “(#bp)” marks the region omitted. “-” marks the deleted sequence. E2, E3 are exon2 and exon3. E, Genotyping of Wild type, heterozygote Fancm+/- mice and homozygote Fancm+/- mice from the same littermates are identified by PCR. M, Marker DL500.Figure 1 Establishment and identification of the Fancm knockout mice
2 结果
2.1 基因敲除小鼠品系的建立及基因型鉴定
针对小鼠Fancm基因序列蛋白编码区第1个外显子中的ATG区域,使用http://crispr.mit.edu/网站工具设计3个sgRNA(sg-1:AGAACGCTCTTCC AGACGTG;sg-2:TGGCGGCGTACGAGGCTGAG;sg-3:ACTGTGGAATACCCATCACG)。根据设计的sgRNA序列,PCR合成转录模板,MEGAshortscript 转录试剂盒体外合成sgRNA,MEGAclear试剂盒纯化,以低分子量ssRNA ladder(NEB,美国)为参照,进行2%的琼脂糖凝胶电泳,结果显示120 bp处一条单一的sgRNA条带(图1A),Nanodrop检测A260/280约2.0,A260/230约2.1,浓度在2000 ng/μL左右,-80℃保存。使用前,混合Cas9 mRNA(吉荧生物,中国)100 ng/μL和每种sgRNA各40 ng/μL。
约55个显微注射后状态较好的受精卵,移植到2只假孕ICR小鼠中,共出生9只F0代小鼠。进行PCR鉴定与TA克隆测序分析(图1B),F0代小鼠中,#5为野生型序列,#8为纯合21 bp缺失,#1、#2、#3、#6、#9、#10为测序双峰,敲除效率可达80%以上。选择有大片段缺失的#1、#3、#9作为F0代首建鼠与野生型C57BL/6进行交配,对F1代小鼠进行PCR鉴定及测序(图1C),确定三种基因型突变(图1D),分别为line A (-89 bp & 278 bp)、line B (-75 bp & 278 bp)、line C (-405 bp),其中Line A与B中89 bp与75 bp的敲除均包含Fancm基因ATG起始密码子区域,Line C中的405 bp敲除,在Fancm基因CDS1中,无法造成移码突变。最终保留line A (-89 bp & 278 bp)进行繁育互交。对F2代小鼠进行PCR(图1E)鉴定,野生型为615 bp条带,纯合Fancm-/-小鼠为248 bp条带,杂合Fancm+/-小鼠为615/248 bp两条条带。
2.2 Western blot检测野生型与Fancm-/-小鼠睾丸组织中FANCM蛋白表达情况
范可尼贫血家族基因在小鼠生殖器官,特别是睾丸中有高水平表达[22-23]。提取8~10周龄Fancm-/-及同窝野生型小鼠睾丸组织总蛋白,使用anti-FANCM抗体(ab95014,Abcam)进行Western blot分析。FANCM蛋白大小为227×103左右,野生型小鼠睾丸组织中有显著性表达,在Fancm-/-小鼠睾丸组织中无表达,证明Fancm基因已经被完全敲除(图2)。GAPDH为内参蛋白。

图2 Western Blot检测野生型与Fancm-/-小鼠睾丸组织中FANCM蛋白表达Figure 2 Detection of FANCM protein expression in the wild type and Fancm-/- mouse testis by Western blot

注:A:同窝8周龄Wild type与Fancm-/-小鼠体重比较,n≥ 5。B:Fancm+/-互交繁育,子代Fancm-/-小鼠数目观察值与预期值比较,卡方检验(χ2.TEST)分析显著性。C:雌雄Fancm-/-小鼠比例观察值与预期值比较,卡方检验(χ2.TEST)分析显著性。图3 Fancm-/-小鼠表型分析Note. A, Comparison of body weight between 8-week-old wild type and Fancm-/- mice in the same litter. n≥ 5. B, Fancm+/- mice were mated with each other, and the observed number and expected number of offspring Fancm-/- mice are compared. χ2.TEST for statistical analysis. C: The observed versus the expected numbers of male and female Fancm-/- mice. χ2.TEST is used to analyze the statistical significance.Figure 3 Phenotypic analysis of the Fancm-/- mice
2.3 Fancm-/-小鼠繁育与观察
小鼠饲养于SPF屏障环境中,将8~10周的雄性与雌性Fancm+/-小鼠进行交配。观察发现Fancm+/-小鼠的繁育周期、产仔胎数、每胎产仔数与野生型并无明显区别(数据未列出)。6周左右的Fancm-/-小鼠与同窝的野生型小鼠比较,体重、外形并无明显区别(图3A),解剖后观察主要脏器脾、肝、肺、肾、脑等组织正常(数据未列出)。雌雄Fancm+/-小鼠交配后子代小鼠中Fancm-/-小鼠的比例为19.6%,低于预期的25%,但卡方检验(χ2.TEST)分析无显著性,说明Fancm基因缺失没有导致明显的胚胎致死性(图3B)。但是雌性Fancm-/-小鼠的数目显著低于雄性Fancm-/-小鼠,具体原因不明(图3C)。雄性与雌性Fancm-/-相互交配,分别与野生型小鼠交配都有不育表型(数据未列出)。
2.4 Fancm-/-小鼠的血常规分析
血常规分析发现8周左右Fancm-/-小鼠与同窝的野生型小鼠比较,Fancm-/-小鼠血红蛋白浓度(HGB)有显著性升高,白细胞数(WBC)有明显升高但是未达到显著性(P=0.0553)。红细胞数(RBC)、血小板计数(PLT)与野生型小鼠无明显区别(图4)。
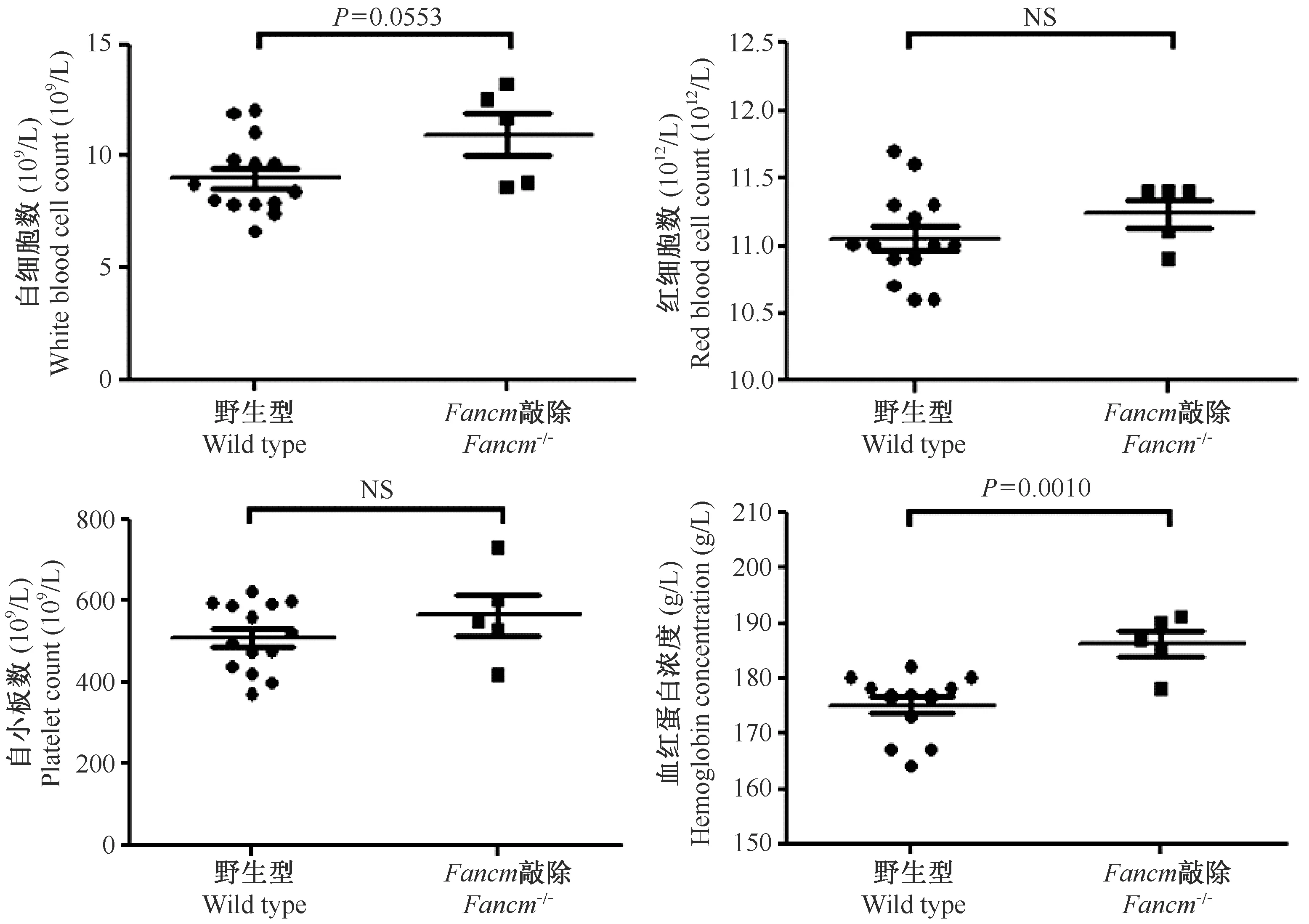
注:同窝8周龄Wild type与Fancm-/-小鼠血常规分析,n ≥ 5。“NS”, 无显著性差异。图4 Fancm-/-小鼠血常规分析Note. The blood routine of 8-week-old wild type and Fancm-/- mice in the same littermates is analyzed. n ≥ 5. “NS”, Not significant.Figure 4 Blood routine analysis of Fancm-/- mice
2.5 Fancm-/-小鼠睾丸发育的组织病理学分析
多个范可尼贫血通路基因敲除的小鼠都有生殖器官发育缺陷与生殖能力降低的表型[23-24]。雄性与雌性Fancm-/-小鼠相互交配,分别与野生型小鼠交配都有不育表型(数据未列出)。解剖8周左右的同窝野生型与Fancm-/-雄性小鼠发现Fancm-/-小鼠睾丸体积明显较小(图5A),睾丸与体重比与野生型雄性小鼠比较显著性降低(图5B)。将睾丸组织固定后切片进行H&E染色发现野生型小鼠的生精小管具有正常的组织结构和完全的生殖细胞分布(图5C),而Fancm-/-小鼠的生精小管发育退化,具有严重异质性(图5D)。根据文献[16-17]描述方法把小鼠睾丸H&E染色切片中显示的异质性生精小管的典型图像分为4类(图5E):①组织形态相对正常的生精小管(relatively normal tubules,RN),②只有精母细胞和精子细胞,但是没有成熟的精子生成的生精小管(round spermatid arrest, RSA),③只有睾丸支持细胞与少量的生殖细胞的生精小管(degenerated tubules with massive germ,cell loss, GCL),④生精小管只有空泡状的睾丸支持细胞完全没有生殖细胞(Sertoli cell-only tubules,SCO)。在显微镜下分别观察181个野生型小鼠生精小管和148个Fancm-/-小鼠生精小管,根据每个生精小管横切面的不同形态,将其归列为以上4类生精小管中的一类。统计分析野生型小鼠与Fancm-/-小鼠中,每一类生精小管占所有生精小管的百分比。结果显示(图5F)在野生型小鼠中RN型生精小管占42%,而41%为RSA型,17%为GCL型,没有SCO型生精小管。在Fancm-/-小鼠睾丸中RN和RSA型共计只有3%,54%为GCL型,43%的生精小管为SCO型。这些结果证明FANCM蛋白缺失严重影响小鼠睾丸的正常发育。
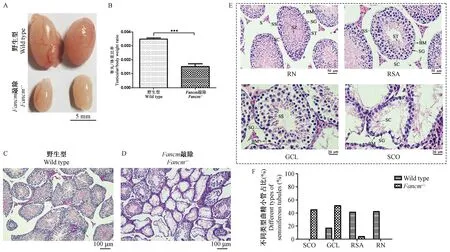
注:A:同窝8周龄野生型Wild type、纯合子Fancm-/-小鼠睾丸形态比较,比例尺=5 mm。B:同窝8周龄野生型Wild type、纯合子Fancm-/-小鼠睾丸与体重比例统计分析,(n=3,***P< 0.001)。C、D:同窝8周龄野生型Wild type(C)、纯合子Fancm-/-小鼠(D)睾丸切片H&E染色。×100;比例尺=100 μm。E:不同类型生精小管H&E染色图:① 组织形态相对正常的生精小管(RN),② 有的只有精母细胞和精子细胞,但是没有成熟的精子生成(RSA),③ 有的只有睾丸支持细胞与少量的生殖细胞(GCL),④ 有的生精小管只有空泡状的睾丸支持细胞完全没有生殖细胞(SCO);S:间质,BM:基底膜,SC:支持细胞,SG:精原细胞,SS次级精母细胞,ST:精子细胞,SZ:精子;×200,比例尺=50 μm;×400,比例尺=20 μm。F:按照图E中的类型分类,统计图C Wild type、图D Fancm-/-中不同类型的生精小管占比。图5 Fancm-/-小鼠睾丸的组织病理学分析Note. A. Comparison of testicular morphology between 8-week-old wild type and homozygous Fancm-/- mice in the same litter. Scale bar=5 mm. B. Statistical analysis of testis/body weight ratio of 8-week-old wild type and Fancm-/- mice in the same litter. n=3,***P< 0.001. C, D. Histology (HE staining) of testicular tissues of 8-week-old wild type (C) and Fancm-/- mice (D) in the same litter. E: Representative images of H&E stained testicular sections showing various seminiferous tubules in adult Fancm-/- mice. ① SCO: Sertoli cell-only tubules, ② GCL: degenerated tubules with massive germ cell loss, ③ RSA: tubules with round spermatids as their most advanced spermatogenic cells (round spermatid arrest, RSA), ④ RN: relatively normal tubules. S: stroma, BM: basement membrane, SC: supporting cells, SG: spermatogonia, SS: secondary spermatocytes, ST: sperm cells, SZ: sperm. F: Quantification of different types of seminiferous tubules in Wild type (C) and Fancm-/- (D) mice based on the seminiferous tubule description in (E).Figure 5 Histopathological analysis of the Fancm-/- mouse testes
由于FA通路蛋白的DNA损伤修复功能在调控细胞周期、细胞有丝分裂减数分裂进程中有重要作用[25]。我们进一步对Wild type与Fancm-/-小鼠睾丸组织切片进行细胞周期标记物PCNA免疫染色与细胞凋亡标记物TUNEL检测。PCNA免疫染色结果显示Wild type小鼠睾丸组织中,几乎100%的生精小管中都有大量的PCNA染色阳性细胞,并且均匀分布在生精小管内部边缘(图6A)。而Fancm-/-小鼠睾丸中只有少数结构较为完整的生精小管中有PCNA阳性细胞,但细胞数目很少,且呈现不规律分布(图6B)。对Wild type小鼠(图6A)与Fancm-/-小鼠(图6B)睾丸组织PCNA染色切片,在显微镜下分别观察多个视野,统计每个视野中有PCNA阳性细胞的生精小管数目,计算PCNA阳性、阴性生精小管百分比并进行统计比较。Wild type小鼠中100%的生精小管都有正常的PCNA阳性细胞,而Fancm-/-小鼠中,只有24.5%的生精小管有PCNA阳性细胞,而76.5%的生精小管均无PCNA阳性细胞(图6C)。TUNEL染色结果显示部分Fancm-/-小鼠睾丸生精小管中(图6E)有大量TUNEL阳性细胞。在显微镜下分别观察图6D、6E中多个视野,统计每个视野中每个生精小管中TUNEL阳性细胞的数目,并进行统计比较。Wild type小鼠中有5个以上的TUNEL阳性细胞的生精小管数目占比只有1.2%,而Fancm-/-中有10.8%。Wild type小鼠中有1~4个TUNEL阳性细胞的生精小管数目占比11.2%,Fancm-/-中只有6.5%。综上所述,Fancm-/-小鼠睾丸精子发育过程中,生精细胞周期阻滞与细胞凋亡,导致Fancm-/-小鼠睾丸发育缺陷。
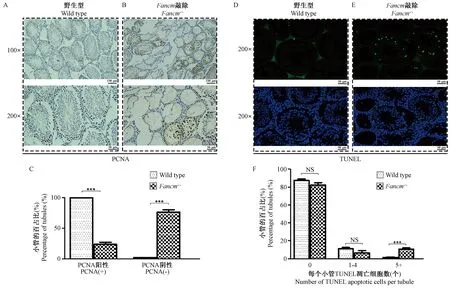
注:A、B:野生型与 Fancm-/- 小鼠睾丸切片PCNA染色。细胞核为蓝色,PCNA阳性细胞为棕黄色;上图:×100,比例尺=100 μm;下图:×200,比例尺=50 μm。C:野生型Wild type、纯合子Fancm-/-小鼠睾丸生精小管中有PCNA阳性细胞的生精小管比例统计(n=4)(***P< 0.001)。D、E:野生型与 Fancm-/- 小鼠睾丸切片TUNEL染色。细胞核为DAPI蓝色,TUNEL阳性细胞为FITC绿色;×200,比例尺=50 μm。F:野生型Wild type、纯合子Fancm-/-小鼠睾丸生精小管中TUNEL阳性细胞数目的分布统计(n=6)(*** P<0.001)。图6 野生型与 Fancm-/- 小鼠睾丸切片PCNA染色与细胞凋亡TUNEL分析Note. A, B: Testicular tissues of 8-week-old wild type (A) and Fancm-/- (B) mice. PCNA immunochemistry staining. The nuclei were blue-stained, and the PCNA-positive cells were brownish yellow. C: Percentage of seminiferous tubules with PCNA-positive cells in wild type (A) and Fancm-/- (B) mice.(n=4,***P< 0.001). D, E: Testicular tissues of 8-week-old wild type (D) and Fancm-/- (E) mice. TUNEL staining. The nuclei are blue, and the TUNEL-positive cells are FITC-green. Upper: TUNEL staining, Lower: TUNEL staining merged with DAPI staining. F: Percentage of seminiferous tubules with TUNEL-positive cells in wild type (D) and Fancm-/- (E) mice.(n=6,***P< 0.001).Figure 6 Comparison of the apoptosis in the testicular tissues of wild type and Fancm-/- mice(Immunohistochemical PCNC staining)
3 讨论
本研究使用CRISPR/Cas9技术[26]直接在Fancm基因ATG区域设计sgRNA,靶向敲除ATG序列,完全终止Fancm基因的转录翻译起始[27]。Fancm-/-小鼠中FANCM蛋白表达完全消失。Fancm-/-小鼠的出生率、体重、形态与同窝野生型小鼠比较无明显差异。雌雄Fancm-/-小鼠都有不育症表型,组织形态学研究表明Fancm-/-小鼠睾丸中大部分的生精小管发育严重退化。免疫组化与TUNEL实验发现,Fancm-/-小鼠生精小管中细胞周期标志PCNA染色阳性细胞显著减少而凋亡信号标记TUNEL阳性细胞显著增加,说明Fancm在小鼠睾丸发育、精子生成中具有重要作用。Fancm全基因敲除小鼠将是全面精确研究Fancm基因在机体发育中生理功能的重要工具。
本研究的Fancm-/-小鼠与文献报道中Fancm点突变小鼠相比睾丸退化程度更加严重,生精小管病变也更加显著[17],我们推测由于Fancm点突变小鼠中的FANCM蛋白编码在突变位点后面附近终止,并没有完全缺失,剩余截断的FANCM蛋白还具有部分功能,能够在一定程度上缓解生殖器官发育缺陷的表型。人源FANCM蛋白共有2048个氨基酸,蛋白的N端为ATP结合区,中间部分为MHF蛋白结合区,C端为FAAP24蛋白结合区。全基因测序分析显示,每个FANCM基因突变患者的突变位点都不同,剩余截断的FANCM蛋白保留了大小不同的MHF结合区与FAAP24结合区[16,28-29]。剩余截断FANCM蛋白片段根据大小的不同,具有不同的FANCM蛋白的部分功能,这可能是FANCM突变患者生殖器官病变程度临床症状差异明显的直接原因[16]。
FANCM蛋白不仅与其他FA通路蛋白协同参与DNA交联损伤修复,还具有FA通路以外的独立功能与作用[9]。FANCM蛋白复合物在识别并结合到DNA损伤位点后,不仅可以激活FA通路,还参与ATR通路信号传导、端粒序列复制、DNA稳定性维护等功能[30-31]。据报道FANCM突变的患者症状与其他FA通路基因突变患者症状有明显差异。FANCM突变患者贫血与骨髓衰竭的表型不明显,但是生殖缺陷与肿瘤高发的表现出非常突出[29]。Fancm-/-小鼠存在生殖器官发育缺陷的表型与多个经典的FA基因如Fanca、Fancd2基因敲除小鼠的表型非常相似[24],证明Fancm基因与其他FA通路基因功能相似。但是Fancm小鼠与其他FA小鼠在生殖缺陷的严重程度,骨髓衰竭、急性髓系白血病的发生、肿瘤发病率等方面的差异还有待后续的细致研究。使用Fancm小鼠模型研究Fancm基因缺失造成的生理病理表型,并与其他范可尼贫血小鼠表型比较,其研究结果将对FANCM突变患者的早期临床诊断、基因型表型鉴定以及后续的治疗等提供巨大的帮助。
