低氟铝长期与高氟铝短期暴露后大鼠骨生长的比较研究
2019-06-27黄连芳陈艳
黄连芳,陈艳
(广东医科大学广东天然药物研究与开发重点实验室,广东 湛江 524023)
氟(fluorine,F)是人体重要的微量元素之一,在正常的生理代谢过程中,适量的氟有利于钙和磷的利用,增加骨骼的硬度。当氟超过生理需要量时,将导致急性或慢性氟中毒。慢性氟中毒以骨骼损害为主要表现,以地区性发病为特点,简称氟骨症。目前我国仍然是氟中毒流行较严重的国家之一,其中贵州省流行最广,病情最重。由于其特殊的地域特点和饮食习惯,同时还伴随着铝(aluminum,Al)元素的过度吸收和蓄积,出现特殊的氟铝联合中毒,至今严重骨骼畸形及致残的病例仍然可见[1],另外,习惯饮用砖茶的内蒙古及东北地区的人群,由于砖茶中氟、铝的含量都高于正常,也存在着氟铝联合中毒的危险因素[2]。因此氟铝联合中毒的深入研究对于生存在高危因素环境下的地区人群仍然具有重要的现实意义。
氟骨症的骨相损害包括骨硬化、骨软化、骨质疏松、骨周软组织骨化以及关节的退行性改变。铝中毒时的骨相损害主要表现为骨软化,包括软骨内成骨障碍和骨矿化障碍[3]。氟铝联合摄入时,在胃肠道中容易形成氟化铝复合物,影响两者的吸收,最终的效应并非单纯的累积叠加。通过对不同比例的氟铝联合摄入实验的血液和骨中的元素分析结果表明,低中剂量的铝与氟同时摄入,两者有互相的拮抗吸收作用,高剂量的铝,由于其直接对肠道吸收部位的毒性作用,反而使铝氟的吸收不再增加。而氟是铝的促进剂,促其在组织中蓄积并增强其毒性。在高氟的环境中,即使食物或饮用水的铝含量很低,铝仍能在骨组织中显著蓄积,表现出两者的协同作用。氟铝在骨中聚集的结果就是导致以氟中毒或铝中毒为主的,或两者协同作用下的骨骼损害。氟铝联合中毒对关节和软骨也有影响,体外实验发现,氟对软骨细胞表现为低剂量促进,高剂量抑制其增生,促进细胞分化凋亡的作用,并且铝单独作用的毒性甚至要大于氟和氟铝联合对软骨细胞的影响[4]。目前关于氟铝联合中毒对骨骼损害的研究,多数集中探讨与氟铝剂量的关系,并且很多是基于体外实验结果,对于不同剂量氟铝暴露时间不同对骨重建状态及长骨生长发育的影响的比较研究还少见报道。因此,本研究为了阐明高剂量氟铝短期暴露与低剂量氟铝长期暴露时是否有相同的软骨生长和骨重建特点,通过骨组织病理学、形态计量学方法观察及测量大鼠长骨骺端生长板结构及次级小梁骨的骨代谢参数并进行比较,为地方性铝氟联合中毒的深入研究和防治提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
清洁级SD大鼠48只,雌雄各半,体重170~190 g,8周龄,均购于广东医学院实验动物中心【SCXK(粤)2008-0008】,实验地点:广东医学院实验动物中心【SYXK(粤)2008-0007】。实验室环境温度22~26℃,湿度(60 ± 10)%,正常明暗交替,实验中对动物的处置符合中华人民共和国科学技术部颁布的《关于善待实验动物的指导性意见》的相关要求。
1.1.2 主要试剂与仪器
不脱钙制片所需慢速锯(Buehler,美国),硬组织切片机(RM2265,Leica,德国);骨形态计量分析所需荧光显微镜(DMLB,Leica,德国)及显微照相机(Olympus DP72,日本),骨形态计量学测量系统(OsteoMetrics,Inc,美国)。
氟化钠(NaF CAS: 7681-49-4 批号:20130528天津市光复精细化工研究所),氯化铝(AlCl3CAS:7446-70-0批号:20121102天津市福晨化学试剂厂),染色剂甲苯胺蓝(CAS: 92-31-9 批号:71041284,Sigma Chemical Co.美国);包埋单体采用甲基丙烯酸甲酯(CAS: 1330-20-7 批号:20161017,北京化工厂)。
1.2 实验方法
1.2.1 分组及氟铝中毒模型构建
大鼠一周适应性饲养,无异常发现后,根据体重由小到大排序,编号,48只8周龄清洁级SD大鼠,雌雄各半,随机分为6组,每组8只:正常对照45 d和90 d组;低剂量氟加铝[5 mg/(kg·d) NaF + 0.1 mg/(kg·d) AlCl3,Low F + Al, LF + Al],分别45 d和90 d组;高剂量氟加铝[15 mg/(kg·d) NaF + 0.1 mg/(kg·d) AlCl3,High F + Al,HF + Al],分成45 d及90 d组。氟和铝的剂量是目前动物实验中使用到的最小剂量[5]。
对照组生理盐水按10 mL/kg用量灌胃,药物组将氟化钠及氯化铝配置成溶液后灌胃,每日1次,分别给药45 d和90 d。实验期间根据每周称重调整给药剂量。分笼饲养,自由饮水摄食,通风良好。实验结束时,全麻下心脏采血处死大鼠并立即取材。
1.2.2 骨形态学标本制备及形态计量学参数测量
分离双侧胫骨,取一侧除净肌肉和软组织等附属结构,矢状面锯掉胫骨粗隆部分,暴露骨髓腔,横断后取胫骨近端约1 cm的骨样本固定液中存放,之后经过逐级脱水,脱脂,甲基丙烯酸甲酯包埋,打磨光滑后再经硬组织切片机切成10 μm和5 μm的切片。厚片直接封片在荧光显微镜下进行骨代谢及小梁微结构的测量分析。薄片甲苯胺蓝法染色,光镜下观察骺板(生长板)软骨细胞层,初级骨小梁以及初级小梁往下延伸3 mm区域内次级小梁的相关计量学分析。其测量范围及参数含义参见相关文献[6]。
主要微结构参数有骨小梁面积百分数(bone volume/tissue volume,BV/TV),骨小梁厚度(trabecular thickness,Tb.Th),骨小梁数量(trabecular number,Tb.N),骨小梁分离度(trabecular separation,Tb.Sp),生长板厚度(growth plate width,G.P.Wi)。反映骨代谢的参数有骨形成和吸收参数,骨周长(bone surface,BS),骨小梁荧光周长(mineralized surface,MS),矿化沉积率(mineral apposition rate,MAR),骨形成率(bone formation rate,BFR),成骨细胞周长(osteoblast surface,Ob.S),及类骨质周长(osteoid surface,OS)等。
1.3 统计学分析
2 结果
2.1 不同氟铝剂量和暴露时间对大鼠体重的影响
短期内(45 d)不管氟铝剂量高低,大鼠体重都是增加的,与正常组比较差异无显著性。45 d至实验结束(90 d),体重(包括正常组的)进入缓慢增长期,低剂量组的体重变化与正常组一致,而高剂量组90 d时的体重下降,与正常组和低剂量组比较差异有显著性(P=0.032)。(见图1)
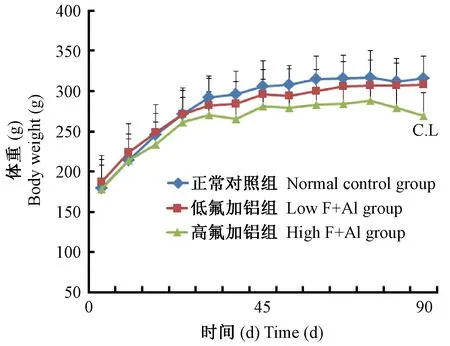
注:与正常组比较,CΡ < 0.05;,与低氟铝组比较,LΡ < 0.05。图1 不同氟铝剂量和暴露时间对大鼠体重的影响Note. Compared with the normal control,CP < 0.05. Compared with the low F+Al group,LP < 0.05.Figure 1 Effects of different doses and exposure time of aluminum and fluoride on the body weight of rats
2.2 不同氟铝剂量和暴露时间对大鼠胫骨生长板厚度及细胞形态的影响
正常组90 d与45 d比较,氟铝组G.P.Wi降低[(136.62 ± 6.54)vs(160.69 ± 8.38),P=0.004];低氟铝组与正常组比较差异无显著;高氟铝生长板增厚,与正常对照组比较差异有显著性[45 d组,(203.98 ± 15.66)vs(160.69 ± 8.38),P=000;90 d组,(183.80 ± 17.59)vs(136.62 ± 6.54),P=000)],高氟铝45 d和90 d组之间比较差异有显著性(P=0.037)。但45 d组软骨细胞层次清楚,排列整齐,形态无异常,而90 d组肥大细胞拥挤,潴留。(见图2)
2.3 不同氟铝剂量和暴露时间对大鼠胫骨近端骨小梁微结构及骨代谢的影响
从表1可见,高氟铝短期45 d组与对照组45 d比较,只有BV/TV增加。高氟铝90 d组BV/TV则比45 d组减少,与正常组和低氟铝组比较,则没有显著降低。其余指标Tb.Th, Tb.N和Tb.Sp的改变也没有明显差异。
由图3和图4 可见,与正常同一时间段组相比,低氟铝组、高氟铝45 d组的MS, MAR, BFR以及Ob.S, O.S明显增加。Oc.S只在低氟铝90 d组和高氟铝45 d组增加,高氟铝90 d组的Ob.S和Oc.S比高氟铝45 d组是明显降低的。
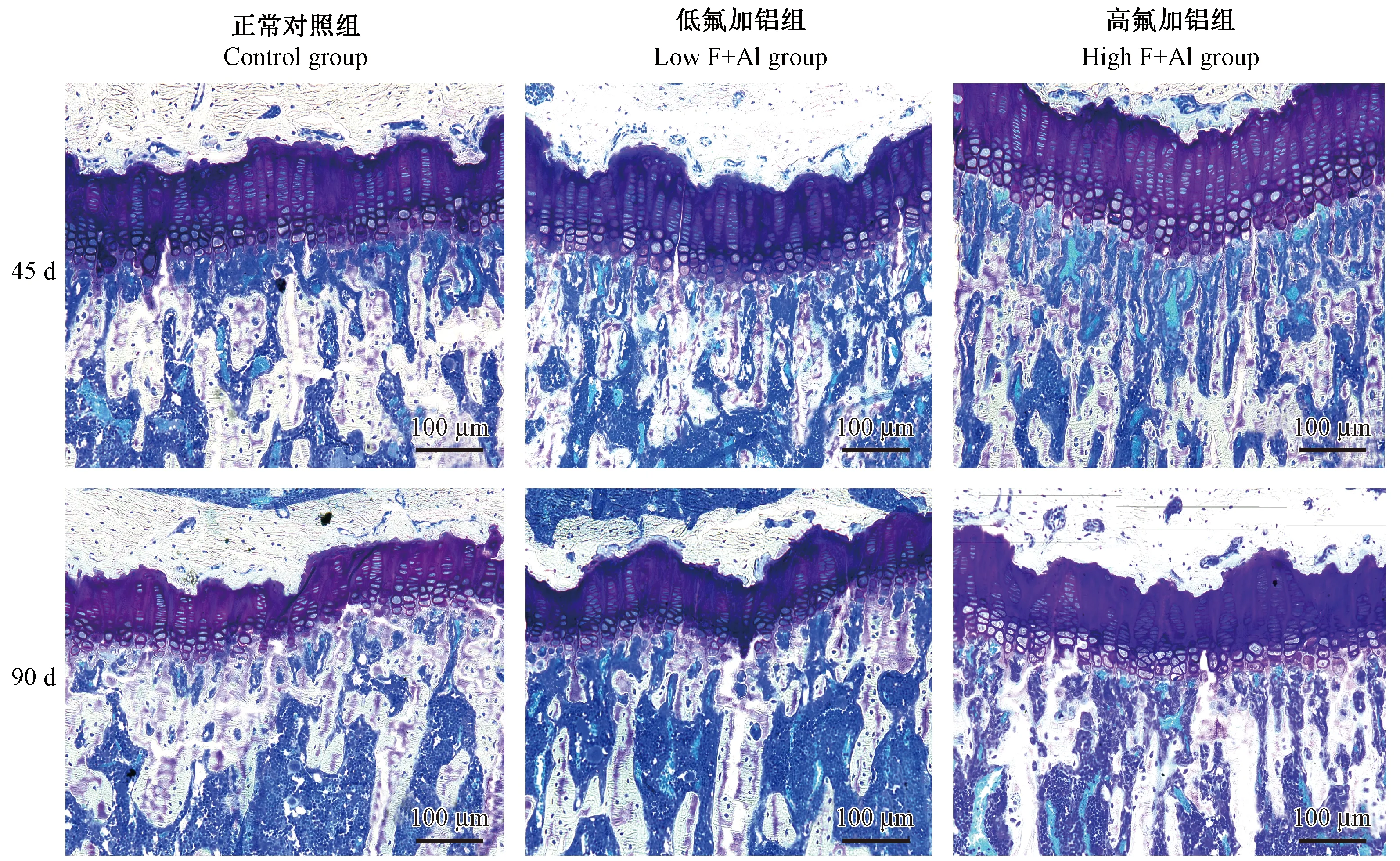
图2 不同氟铝剂量和暴露时间对大鼠胫骨生长板厚度的影响(甲苯胺蓝染色)Figure 2 Effects of different doses and exposure time of fluoride combined with aluminum on the thickness of rat tibia growth plate(Toluidine blue staining)
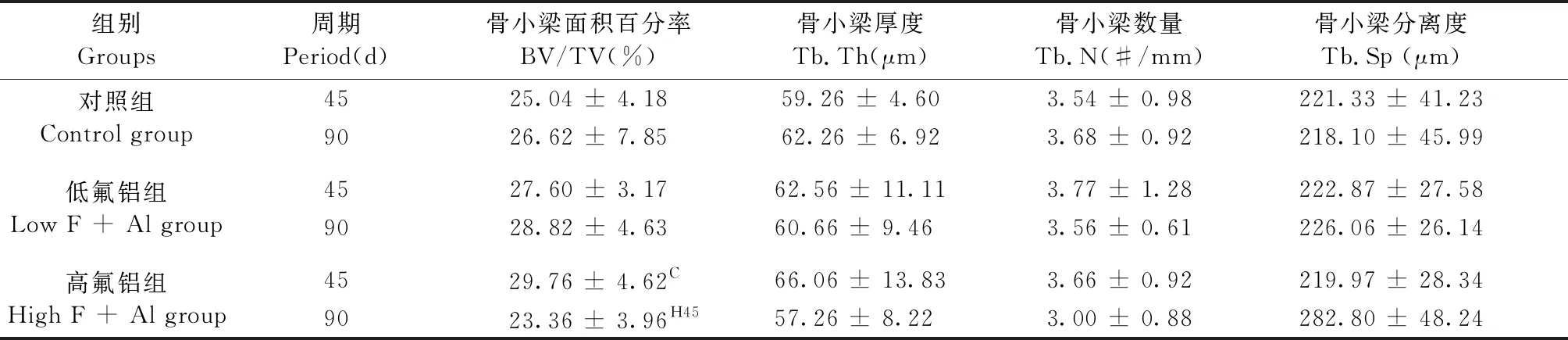
组别Groups周期Period(d)骨小梁面积百分率BV/TV(%)骨小梁厚度Tb.Th(μm)骨小梁数量Tb.N(#/mm)骨小梁分离度Tb.Sp (μm)对照组Control group4525.04 ± 4.1859.26 ± 4.603.54 ± 0.98221.33 ± 41.239026.62 ± 7.8562.26 ± 6.923.68 ± 0.92218.10 ± 45.99低氟铝组Low F + Al group4527.60 ± 3.1762.56 ± 11.113.77 ± 1.28222.87 ± 27.589028.82 ± 4.6360.66 ± 9.463.56 ± 0.61226.06 ± 26.14高氟铝组High F + Al group4529.76 ± 4.62C 66.06 ± 13.833.66 ± 0.92219.97 ± 28.349023.36 ± 3.96H4557.26 ± 8.223.00 ± 0.88282.80 ± 48.24
注:与正常对照组45天相比,CP< 0.05,与高氟铝45天组相比,H45P< 0.05。
Note. Compared with the normal control,CP<0.05. Compared with the high F+Al group at day 45,H45P< 0.05.
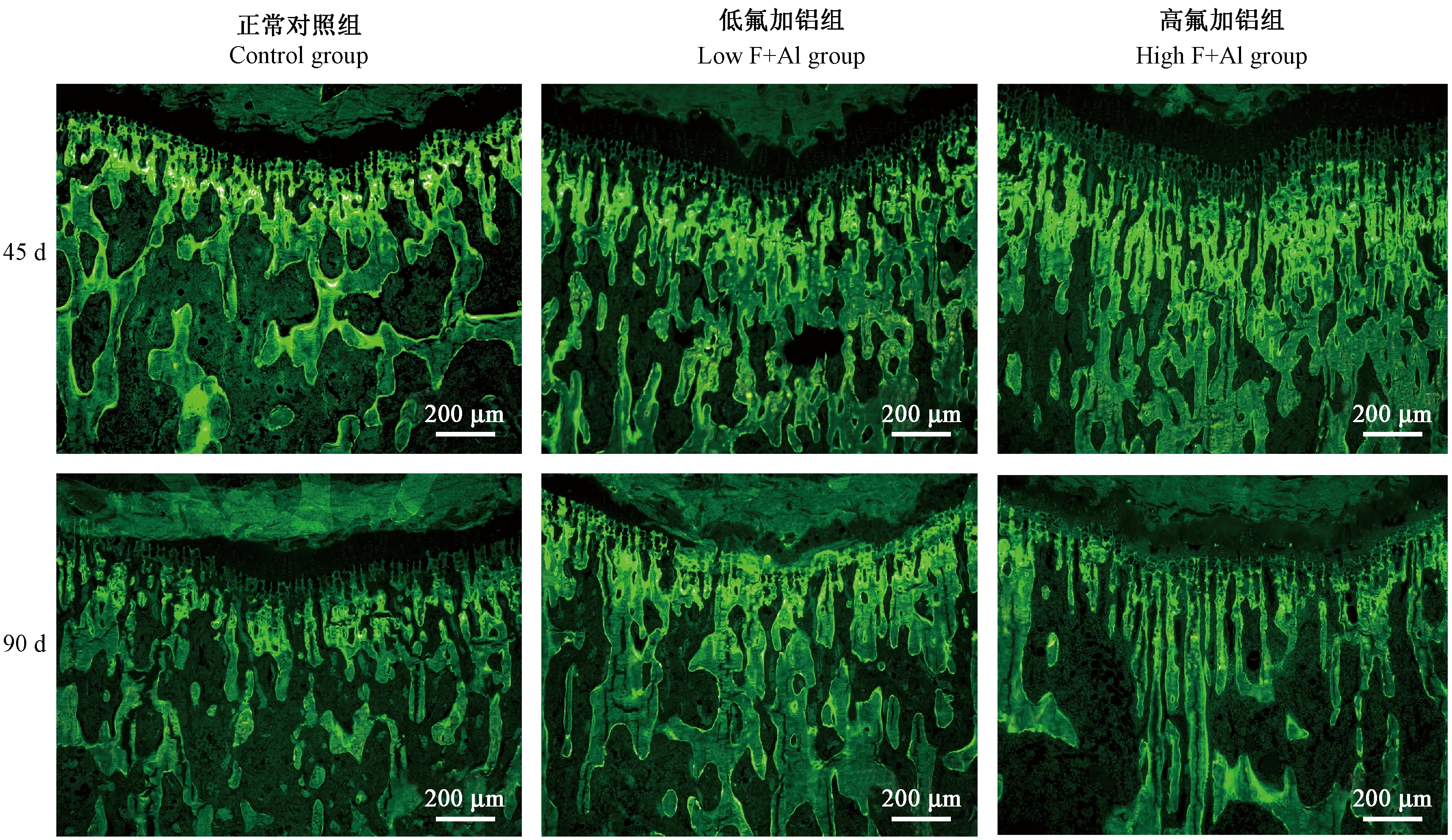
注:荧光图,黄绿色为钙黄绿素荧光,越多、越亮表示成骨越活跃。图3 不同氟铝时间对大鼠胫骨近端小梁骨微结构及骨代谢的影响Note. Fluorescence images, the yellow-green color is calcein fluorescence, and the more and brighter parts indicate a more active osteogenesis.Figure 3 Effects of fluoride and aluminum on bone microstructure and bone metabolism of the rat proximal tibia
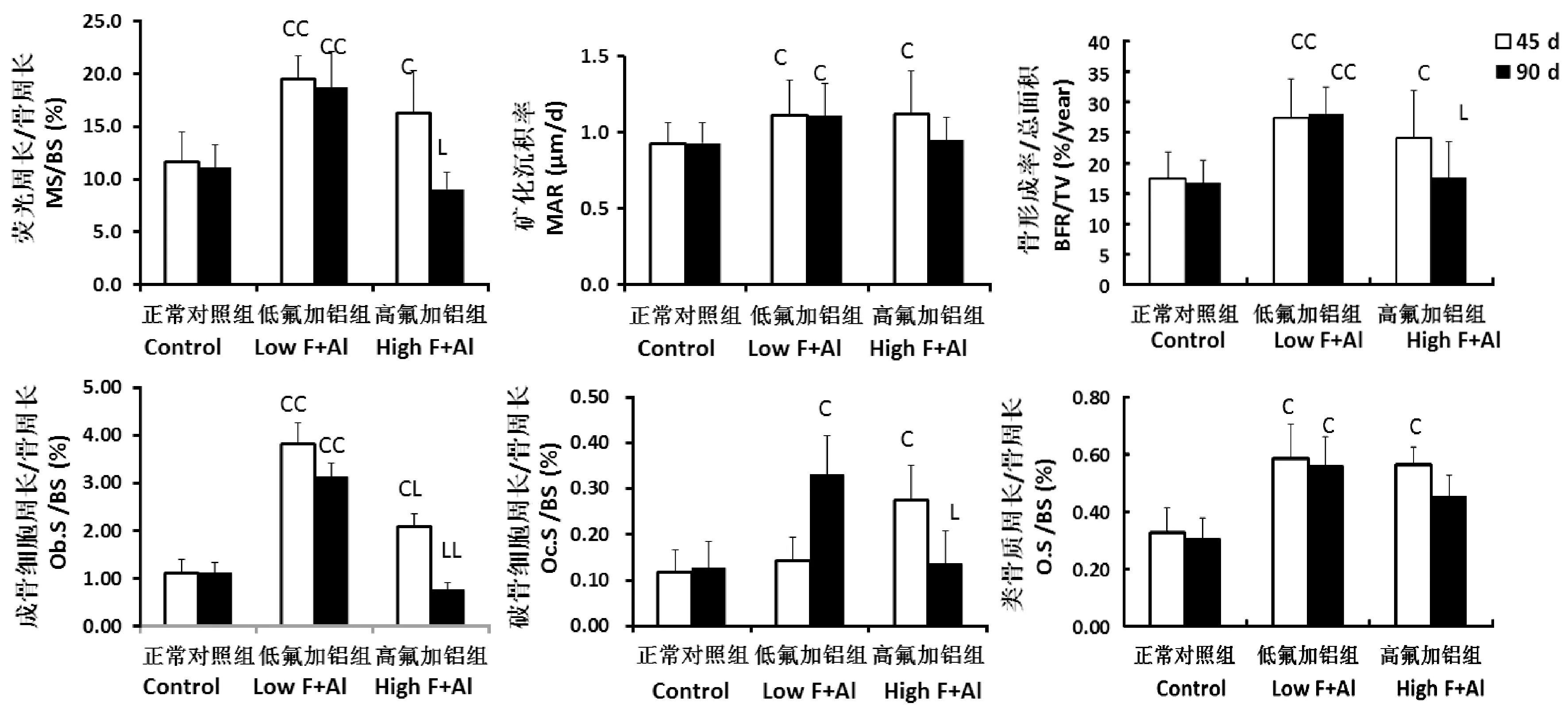
注:与同一时间段正常对照组相比,CP< 0.05,CCP< 0.01;与同一时间段低氟铝组相比,LP< 0.05,LLP< 0.01。图4 不同氟铝剂量和暴露时间对大鼠胫骨近端骨代谢参数的影响Note. Compared with the normal control at the same period group,CP < 0.05, CCP < 0.01. Compared with the low F+Al at the same period group,LP < 0.05, LLP < 0.01.Figure 4 Effects of different doses and exposure time of fluoride combined with aluminum on the bone metabolic parameters of the rat proximal tibia
3 讨论
本实验的结果显示,高剂量氟铝短期和低剂量氟铝较长时间摄入对长骨生长和骨代谢的影响是不同的。低剂量氟铝联合摄入较长时间对骨骼没有明显负性作用,反而增加次级小梁骨形成。高氟铝短期暴露刺激软骨生长,增加次级小梁骨形成和骨吸收,长期摄入则造成软骨成骨障碍,骨转换抑制,最终长骨生长抑制和骨量丢失。
生长板(即骺板)中软骨细胞的发育过程决定着长骨的生长。体外研究结果表明,氟对软骨细胞呈现低剂量促进、高剂量相对抑制其功能的双向作用[7]。动物体内实验(短的60 d,长至6个月)也证实了过量氟或氟铝造成大鼠骺板增厚,软骨矿化延迟甚至坏死[8-9]。本实验结果发现高氟铝短期暴露使生长板增厚,且软骨细胞排列整齐,层次清楚,形态正常,长期则出现软骨细胞形态异常。说明了高氟铝对软骨细胞短期促进,长期抑制的作用。氟和铝都是带电荷的离子,进入体内可引起细胞内外钙离子浓度的改变,影响钙的正常代谢,使软骨基质不能及时矿化,不能及时过渡为初级小梁骨。同时,氟铝对软骨细胞均有直接毒性作用。氟直接损害线粒体和内质网等细胞膜结构,铝可竞争性抑制蛋白聚糖与基质胶原结合,产生不成熟的软骨基质[10],同时在体内与Ca2+、Mg2+、Fe2+等阳离子产生竞争作用,干扰细胞的能量代谢,影响细胞正常功能。短期氟铝暴露的情况下,体内内环境存在一定的代偿作用,随着时间的延长,氟铝的毒性作用逐渐显现,从而造成软骨细胞滞留、凋亡细胞增多、矿化延迟,氟铝对生长板软骨细胞的影响最终表现为负性作用。体重的变化趋势与软骨细胞先促进后抑制的表现是一致的,也间接说明了长期氟铝暴露对长骨生长的抑制。
大量体内外实验已经明确成骨细胞功能活跃在氟暴露骨病变中是一个发生较早、并起主导作用的环节。成骨细胞被激活后,刺激了细胞内一系列的复杂且相互关联的信号通路网络,改变相关基因或蛋白的表达,从而对成骨细胞的增殖分化,凋亡,甚至细胞外基质的分泌,矿化等产生影响。目前为止,几乎所有与成骨细胞的增殖分化及功能调控相关的信号通道如Runx2、Wnt/β-catenin、BMP、PI3K/Akt、ERK/MAPK、Hedgehog、胰岛素受体通道等,均被证实与氟调控成骨细胞相关[11-12]。氧化应激和内质网应激,细胞内外钙矛盾机制也参与了氟激活成骨细胞的机制[13]。而铝对成骨细胞的功能是抑制的[14]。本实验中,低氟铝短期内只激活骨形成,也很好的印证了成骨细胞是氟铝暴露时最先启动的环节,同时也说明,在高氟低铝的联合摄入中,短期内仍是以氟的作用为主,或者高氟的刺激骨形成作用掩盖了低铝直接抑制骨形成的作用。
相对而言,氟铝对破骨细胞的作用仍存在许多争议的地方。有实验证明,低剂量的氟可以促进体外培养小鼠破骨细胞增殖,随剂量增加促进作用减弱,高剂量氟则有抑制作用[15]。体内实验则大多发现破骨功能活跃,骨吸收、骨转换均增加。但是与骨形成增加之间的关系如何,并没有清楚的说明[16]。而铝或氟铝联合对破骨细胞的影响基本未见报道。本实验结果发现,骨吸收增加是随着骨形成的增加而增加,又随着骨形成的降低而降低的。这说明这种骨吸收增加和骨转换加速主要是成骨细胞过度激活后偶联破骨细胞功能增强的结果。成骨细胞激活后,通过趋钙激素(主要是PTH),以及以OPG/RANK/ RANKL分子轴为主导的多种细胞因子与转录因子组成的网络系统激活破骨细胞和加速骨转换[17]。或由这些细胞因子、转录因子导致的微环境的改变,细胞与细胞之间的信号联接等对破骨细胞产生影响。
随着暴露时间的延长,高氟铝对软骨细胞和骨细胞的直接毒性作用将逐渐占据优势。由于氟离子的强氧化性,一方面产生自由基促进脂质过氧化,另一方面,直接损伤DNA结构,影响核酸代谢,对靶细胞产生毒性[18]。铝(Al3+)在细胞内也竞争与磷酸根、柠檬酸等的结合,与ATP或DNA形成络合物,干扰能量和核酸代谢及糖代谢,抑制磷酸化反应可导致多数酶和蛋白的活性改变,使细胞损伤[19]。另外,氟离子还可激活成骨细胞上的L型钙离子通道使钙内流增加,引起体内钙离子的浓度变化[20],继而激活上述与钙平衡密切相关的调控成骨细胞的信号通道。由于氟铝与钙、钾、镁等离子的竞争性抑制作用,导致其他非骨相损害的同时会加重骨相损害。最终造成成骨细胞和破骨细胞的功能抑制,骨转换降低,骨量丢失。
本实验结果提示,氟铝对骨骼的影响主要还是决定于剂量高低。低剂量氟铝较长时间暴露没有明显负性作用。高剂量短期虽刺激软骨细胞发育和增加骨转换,但随暴露时间延长最终转向抑制。
本实验不足之处在于,首先,没有血液、尿液、骨组织中的氟铝含量以及软骨代谢、骨代谢指标的测定结果,铝的剂量过于单一,没有单独高氟剂量的比较,这些都将影响实验结果的可靠性和完整性。其次,动物性别差异,饲料中所含钙磷比例,蛋白含量,氟铝含量等因素都会对实验结果的精确性和严谨性造成一定的影响。这些问题将指导下一步实验中对动物模型的选择和优化。
(注:本实验开始于2013年,实验周期2年,2015年实验完成。由于实验涉密问题,于2018年完成撰写投稿。)
