响应性聚集金纳米粒子体系用于细菌的体外热疗研究
2019-06-27付超常静林姜轩张从柔张玉民褚丽萍赵瑞利
付超,常静林,姜轩,张从柔,张玉民,褚丽萍,赵瑞利*
(1. 天津农学院 动物科学与动物医学学院,天津 300384; 2. 中国医学科学院北京协和医学院放射医学研究所 天津市放射医学与分子核医学重点实验室,天津 300192)
近些年,由于一些国家对于抗生素的滥用,大量病原体出现了极强的多药耐药性,细菌感染逐渐成为世界上死亡的重要原因,对于人类健康构成极大的威胁。其中金黄色葡萄球菌致病力强,耐药谱广,该菌的感染较为常见,尤其受到人们的关注[1-3]。
为了解决日益严重的金黄色葡萄球菌的感染问题,有许多的抑菌策略相继被提出来,这些策略不仅涉及到使用抗生素、抗菌肽、化疗药物等化疗法,而且也涉及到了非化疗法,比如近些年兴起的光动力治疗、光热治疗等[4-6]。与化疗相比较而言,光热疗法可以通过物理热效应破坏细菌的生物膜结构,从而杀死细菌而达到治疗细菌感染的目的[7]。激光照射出的近红外射线在700~1100 nm波长范围内,具有较强的组织穿透能力,并且局部照射对周围健康组织的伤害极小[8-9]。近年来随着抗菌治疗研究的逐渐深入和治疗经验的逐渐丰富,金纳米粒子(GNPs)由于其良好的光热特性,在用于光热抗菌治疗中受到了广泛的关注[10]。为了提高GNPs的光热特性,科学家们以GNPs 为基础制备了不同形状的金纳米材料,例如金纳米棒、金纳米棱柱等,但是在合成的过程中,不免引入了大量的有毒性的有机试剂,例如溴化十六烷基三甲铵(CTAB)[11-12],由此导致了金纳米材料较低的生物相容性并限制了其应用和进一步的发展。
本课题组经过研究,提供了一种新的、具有响应性的提高GNPs 光热性能的一种方法,制备的GNPs system能够在模拟细菌的弱酸性环境下发生响应性的聚集,形成的大尺寸的聚集体能够明显的提高其光热转换效率,进而能够在激光照射下使体外溶液和细菌混合溶液的温度快速地升高至70℃,获得并证明了高效的抗菌能力。为GNPs用于光热治疗提供了一个新的方法,鉴于GNPs 的良好的生物学性能,也给GNPs的其他的应用方向提供了新的思路和新的应用。
1 材料与方法
1.1 材料
1.1.1 主要样品与试剂
金纳米粒子(GNPs),巯基化聚乙二醇(mPEG2000-SH),多肽A(NH2-KKKKKC-COOH),多肽B(NH2-DDDDDC-COOH),2,3-二甲基马来酸酐(DA),柠檬酸钠,氢氧化钠,醋酸,普通琼脂粉,TSB培养基,生物自发光金黄色葡萄球菌(S.aureusXen 36,由中国医学科学院放射医学研究所核医学应用研究室保存备用)。
1.1.2 主要仪器
高速台式冷冻离心机、透射电子显微镜、动态光散射、立式压力蒸汽灭菌锅、热电偶温度计、近红外热成像仪、紫外可见分光光度计、恒温培养振荡器、酶标仪、荧光显微镜、生物光学成像系统。
1.2 方法
1.2.1 材料的制备
(1)GNPs system的制备
首先将适量氯金酸溶液与超纯水混匀,120℃油浴加热煮沸,加入适量柠檬酸钠溶液,溶液变为酒红色后继续煮沸30 min,后冷却至室温即可得到GNPs。将多肽A与DA(2,3-二甲基马来酸酐)以适当比例在pH 8.0的水溶液中混匀,室温搅拌过夜,透析冻干后得到K(DA)K(DA)K(DA)K(DA)K(DA)C,将该冻干品在pH 8.0条件下通过Au-S键修饰到GNPs上即得到GNPs-A。再将多肽B通过Au-S键修饰到GNPs上即得到GNPs-B。然后将GNPs-A和GNPs-B按照1∶1(v∶v)混合,充分混匀后即可得到GNPs system。
(2)GNPs-PEG2000的制备
按照上述制备GNPs system的类似方法制备GNPs-PEG2000,即将mPEG2000-SH修饰到GNPs表面,超速离心纯化后即得到GNPs-PEG2000。
1.2.2 材料的表征
(1)粒径
首先测定GNPs system和GNPs-PEG2000(180 μg/mL)在pH 7.4的粒径和电镜下的形态,随后为考察GNPs system的响应性聚集,将GNPs system和GNPs-PEG2000溶液环境调至为pH 6.5。作用5 min后测定GNPs system和GNPs-PEG2000的粒径和电镜下的形貌变化。
(2)紫外吸收
参照1.2.2(1)的对GNPs system和GNPs-PEG2000的处理方法,利用多功能酶标仪测定二者在pH 7.4和pH 6.5中的紫外吸收变化,测定波长范围为350~900 nm。
(3)温度曲线
利用光热成像仪器测定GNPs system和GNPs-PEG2000在pH 6.5条件下的升温曲线。利用808 nm近红外激光器(0.45 W/cm2)对GNPs system和GNPs-PEG2000(pH 6.5)进行光照,然后利用光热成像仪器连续测定溶液的温度,并绘制温度变化曲线。
1.2.3 生物实验
(1)细菌孵育
将冷藏保存的生物自发光金黄色葡萄球菌(S.aureus.Xen.36)在TSB琼脂平板上进行划线培养,37℃培养24 h后,挑取单菌落接种于TSB液体培养基中,37℃预培养24 h,后再将该菌扩大培养16 h。然后将细菌培养液离心洗涤2次后,用PBS将细菌重悬,并将菌液浓度调整为108cfu/mL待用。
(2)细菌材料共混液升温曲线
分别取GNPs system和GNPs-PEG2000(200 μg/mL,pH 6.5)与细菌悬液按1∶4(v∶v)共1 mL加入2 mL离心管中,静置待其初始温度与环境温度一致时,开始使用808 nm NIR激光器(0.45 W/cm2)照射5 min。同时在此过程中,使用近红外热成像仪实时拍照记录温度变化。
(3)抑菌实验
将制备得到的GNPs system和GNPs-PEG2000分别配成一系列梯度浓度(0、1、5、25、50、100、200 μg/mL),将GNPs system和GNPs-PEG2000与菌液按1∶4(v∶v)的比例分别混合于96孔板中,将细菌溶液的pH值调至6.5,37℃条件下孵育1 h。然后使用808 nm NIR激光器(0.45 W/cm2)照射5 min,后37℃孵育24 h。使用多功能酶标仪于600 nm处测量其OD值,同时使用生物光学成像系统对其进行成像。
(4)Calcein-AM/PI双染法测定细菌存活
分别取100 μg/mL的GNPs system和GNPs-PEG2000与与菌液按1∶4(v∶v)的比例分别混合于96孔板中,将细菌溶液的pH值调至6.5,37℃条件下孵育1 h。然后使用808 nm NIR激光器(0.45 W/cm2)照射5 min,后37℃孵育24 h。再将96孔板中的菌液全部转移至1.5 mL离心管中,然后使用1×Assay buffer离心洗涤2次,再用Calcein-AM/PI染料于37℃避光孵育30 min。然后从各样品中均取10 μL分别涂在载玻片上,并盖上盖玻片。待其固定后,在荧光显微镜下观察,并进行细菌计数。
1.3 统计学分析
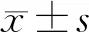
2 结果
2.1 材料的制备及表征
2.1.1 GNPs system的响应性聚集
首先如图1A和图1B所示,GNPs system和GNPs-PEG2000在pH 7.4 条件下的粒径均为约16 nm的单分散的球形结构。二者在体积和外形上没有明显差异,如图1C所示;然而当GNPs system和GNPs-PEG2000被置于弱酸性条件下时(pH 6.5),GNPs system 在DLS 的检测下显示其尺寸增大至900 nm,而且在TEM 下明显观察到大尺寸的、称度更高的金纳米粒子聚集体(GNPs aggregates)。而GNPs-PEG2000在pH 6.5条件下,其尺寸仍是16 nm 左右,且形貌没有发生明显的变化,如图1D所示。
注:A,GNPs system在不同pH条件下的粒径。B,GNPs-PEG2000在不同pH条件下的粒径。C和D,GNPs system的透射电镜图像。图1 GNPs system和GNPs-PEG2000在不同pH条件下的粒径Note. A. GNPs system. B. GNPs-PEG2000. C and D. the TEM images of the GNPs system.Figure 1 Particle diameter of the GNPs system and GNPs-PEG2000 at different pH conditions
2.1.2 紫外吸收变化
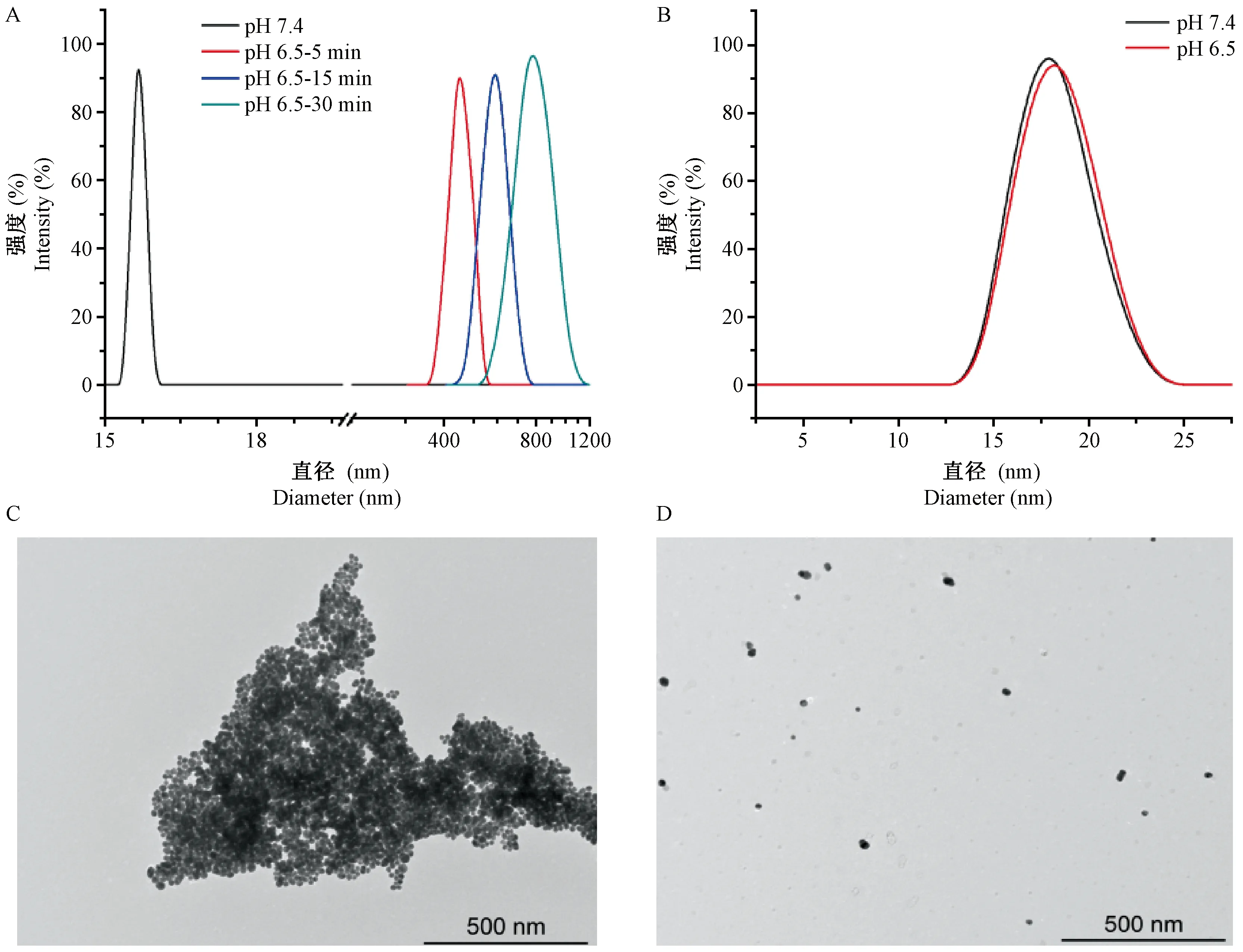
随着GNPs system在弱酸性条件下发生的响应性聚集,其紫外吸收光谱也发生了明显的变化,如图2B所示,原本处于520 nm的吸收峰发生明显的红移,重要的是,其在近红外区域(650~900 nm)的紫外信号发生了成倍的增长。如图2A所示,对照组GNPs-PEG2000的紫外吸收光谱在加酸前后并未发生明显的变化。
2.1.3 升温曲线
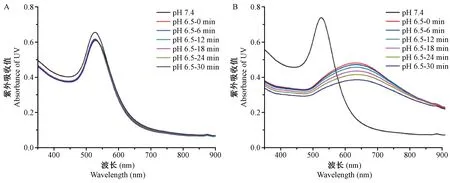
升温曲线结果如图3所示,在NIR照射的情况下,PBS组在10 min之内仅仅升高了10℃左右,而作为单分散的金纳米粒子GNPs-PEG2000,也仅仅升高了25℃左右。然而,在酸性条件下的GNPs system,在近红外激光的照射下,实现了快速地、明显的温度提升,其最高温度可达近70℃,温度升高了50℃左右。该温度能够充分满足对细菌的光热治疗。
2.2 GNPs system抗菌实验
2.2.1 细菌材料共混液升温曲线
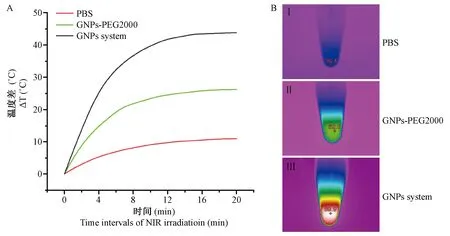
为了评价体外杀菌效果,我们首先验证了GNPs system在与S.aureus.Xen36菌液混合后的生物效果,结果如图4所示。经激光照射后,根据温度曲线显示,在NIR照射的情况下,与PBS和GNPs-PEG2000相比较,GNPs system与细菌的共混液在最初的3 min之内的升温效果明显,具有更为显著的升温性能,最高温度可达近50℃,温度升高约25℃。而作为对照,PBS组和GNPs-PEG2000并没有显示出GNPs system的良好升温性能,与GNPs system统计学分析比较差异显著。
注:A,GNPs-PEG2000在不同pH条件和不同时间点的紫外吸收。B,GNPs system在不同pH条件和不同时间点的紫外吸收。图2 GNPs-PEG2000和GNPs system在不同pH条件下的紫外吸收Note. A. GNPs-PEG2000 under different pH conditions and at different time points. B. GNPs system under different pH conditions and at different time points.Figure 2 UV absorption of the GNPs system and GNPs-PEG2000 at different pH conditions
注:A,经NIR照射时,PBS、GNPs-PEG2000和GNPs system的温度变化。B,经NIR照射时,热成像结果。图3 GNPs-PEG2000和GNPs system经NIR照射后的温度变化Note. A. The temperature changes of PBS, GNPs-PEG2000 and GNPs system when irradiated with NIR. B. The thermographic results of PBS, GNPs-PEG2000 and GNPs system when irradiated with NIR.Figure 3 Temperature changes of GNPs-PEG2000 and GNPs system after NIR irradiation
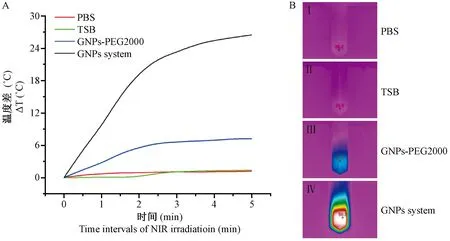
注:A,经NIR照射时,PBS、TSB、GNPs-PEG2000和GNPs system的温度变化。 B, PBS、TSB、GNPs-PEG2000和GNPs system分别与细菌共混液的热成像结果。图4 GNPs-PEG2000和GNPs system与细菌共混液经NIR照射后的温度变化Note. A. The temperature changes of PBS, TSB, GNPs-PEG2000 and GNPs system when irradiated with NIR. B. Thermal imaging results of PBS, TSB, GNPs-PEG2000 and GNPs system mixed with bacteria, respectively.Figure 4 Temperature changes of the GNPs-PEG2000 and GNPs system mixed with bacteria after NIR irradiation
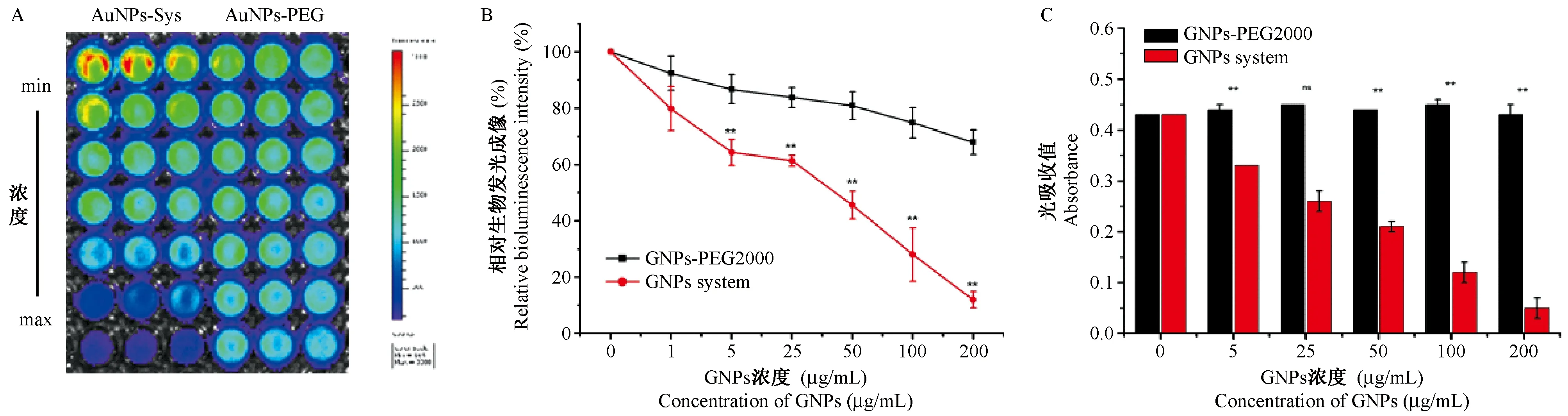
注:A,经NIR照射时,GNPs-PEG2000和GNPs system在生物光学成像系统下的抑菌光学成像结果。B,抑菌光学成像结果的计数结果,当浓度为5、25、50、100、200 μg/mL时,两组间比较所得t值分别为22.220**、11.104(P> 0.05)、40.919**、30.829**、24.665**(**P< 0.01)。C,GNPs-PEG2000和GNPs system的抑菌光吸收结果,当浓度为1、5、25、50、100、200 μg/mL时,GNPs system组与GNPs-PEG2000组进行比较,所得t值分别为2.199(P> 0.05)、5.590**、9.505**、8.734**、7.434**、18.528**(**P< 0.01)。图5 GNPs-PEG2000和GNPs system经NIR照射后的抑菌情况Note. A. The results of bacteriostatic imaging of GNPs-PEG2000 and GNPs systems under bio-optical imaging systems when irradiated with NIR. B. Counts of bacteriostatic optical imaging results. When the concentrations were 5, 25, 50, 100, 200 μg/mL, the t values obtained by comparison between the two groups were 22.220**, 11.104 (P> 0.05), 40.919**, 30.829**, 24.665** (**P< 0.01), respectively. C. The results of bacteriostatic light absorption of GNPs-PEG2000 and GNPs system. When the concentrations were 1, 5, 25, 50, 100, 200 μg/mL, the GNPs system group was compared with the GNPs-PEG2000 group, and the obtained tvalues were 2.199 (P> 0.05), 5.590**, 9.505**, 8.734**, 7.434**, and 18.528** (**P< 0.01), respectively.Figure 5 Antibacterial activity of the GNPs-PEG2000 and GNPs system after NIR irradiation
2.2.2 GNPs system抑菌效果观察
为了测定GNPs system的体外抗菌效果,对于其细菌生物发光强度以及600 nm处的OD值进行测量。在生物发光强度测量的方法中,由于活细菌具有良好的生长增殖能力,而死细菌不再生长增殖,因此细菌数量越少则该菌的生物发光强度越小,细菌数量越多则该菌的生物发光强度越大。同理,在细菌OD600值的测量中,OD600值的大小亦与细菌的数量多少呈一定的正相关关系。如图5A和5B所示,经NIR照射后的细菌存活情况,随着GNPs system浓度的增大,孔内的光强呈现逐渐减弱的趋势,并且与对照组GNPs-PEG2000比较差异明显。该结果表明GNPs-PEG2000和GNPs system对于S.aureusXen 36 细菌的生长抑制均呈现出一定的浓度依赖性,即材料浓度与细菌相对生物发光强度呈现一定的正相关,GNPs的浓度越大,细菌的相对生物发光强度越低,即细菌的存活率越低。当浓度为5~200 μg/mL时,GNPs system组的细菌相对生物发光强度均要极显著地低于GNPs-PEG2000组(均P≤ 0.01);当浓度为1 μg/mL时,GNPs-PEG2000和GNPs system两组之间的细菌相对生物发光强度差异无统计学意义。根据图5C可知,GNPs-PEG2000和GNPs system对于S.aureusXen 36细菌的生长抑制亦均呈现出一定的浓度依赖性,该结果与之前的细菌生物发光强度的结果相一致,即材料浓度与菌液的光吸收值呈现一定的正相关,GNPs的浓度越大,菌液的光吸收值越低,即就是细菌的存活率越低。当浓度为5 μg/mL和50~200 μg/mL时,GNPs system组的细菌的均要极显著地低于GNPs-PEG2000组(均P< 0.01);当浓度为25 μg/mL时,GNPs-PEG2000和GNPs system两组之间的细菌相对生物发光强度差异无统计学意义。该结果显示,在NIR照射后,GNPs system的杀菌效果呈现浓度依赖趋势,即随着材料浓度的增大,细菌存活率越低。当浓度为50 μg/mL时,就可杀死约50%的细菌;浓度为200 μg/mL时,基本上可以完全杀死细菌,与对照组GNPs-PEG2000相比较,具有显著的统计学差异,杀菌效果明显,生物发光成像实验也显示出了相似的光热抗菌效果。
2.2.3 Calcein-AM/PI双染法测定细菌存活
为了进一步评估材料的杀菌效果,进行细菌存活染色测定。在存活染色中,活菌体内由于含有酯酶,且细胞膜完整,所以活菌被染成绿色,死菌将被染成红色。在近红外激光照射下,GNPs system显示出了更高的抗菌活性。如图6A所示,在GNPs system组中,基本所有的细菌被染成红色,而在对照组PBS和GNPs-PEG2000中,杀菌效果并不明显。图6B所示,结果表明GNPs-PEG2000和GNPs system对于S.aureusXen 36细菌均具有一定的杀伤能力,但是GNPs system组的活菌数量要显著低于对照组、死菌数量显著高于对照组。因此,GNPs system具有更好的抑菌作用,该结果与之前的抑菌实验结果基本相一致。
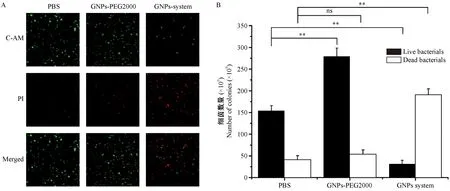
注:A,经NIR照射时,Calcein-AM/PI双染法测定细菌存活的荧光显微镜下的结果。B,对A的计数结果。当浓度为100 μg/mL时,PBS组与GNPs system组、GNPs-PEG2000组的活细菌数量进行比较,所得t值分别为-7.609**、11.759**(**P< 0.01),然后PBS组与GNPs system组、GNPs-PEG2000组的死细菌数量进行比较,所得t值分别为-1.309(P > 0.05)、-12.307**(**P< 0.01)。图6 GNPs-PEG2000和GNPs system经NIR照射后的细菌死活染色Note. A. Results of measuring bacterial survival by calcein-AM/PI double staining after NIR irradiation, observed by fluorescence microscopy. B. Counting of the bacteria in the Figure A. Comparison of the numbers of viable bacteria between the PBS, GNP system and GNPs-PEG2000 groups at concentration of 100 μg/mL, and the obtained t values were -7.609**, 11.759** (**P< 0.01). Then, the number of dead bacteria in the PBS group was compared with the GNPs system group and the GNPs-PEG2000 group, and the obtained t values were -1.309 (P > 0.05) and -12.307**(**P< 0.01), respectively.Figure 6 Staining of viable and dead bacteria in the GNPs-PEG2000 and GNPs systems after NIR irradiation
3 讨论
首先,我们利用了前期制备的GNPs system能够通过在细菌微酸性环境下发生响应性聚集,通过提高了近红外区域的紫外吸收信号,进而实现了提高热疗抗菌的效率。在不改变GNPs的结构的基础上,首先没有引入任何的有毒性的有机试剂等,使其仍旧保持着较高的生物相容性,这在我们前期的工作中有系统的研究;其次,GNPs system在细菌微酸性环境内的响应性的聚集,实现了对细菌环境的特异性,即在近红外激光照射下,仅仅在细菌环境中提高热疗的杀伤效率。而在周边正常位置或正常器官中,GNPs system并不会发生响应性聚集,仍旧以单分散的粒子形式存在。
其次,基于响应性形成的GNPs aggregates导致了近红外区域的紫外吸收信号的明显增强,由此实现了快速、稳定的升温,而且在10 min之内能提高至近70℃。这明显改善了单分散的GNPs作为热疗增敏剂的增敏效果。同时其升温效率较其他学者开发的金纳米棒或金纳米棱柱相比较,无明显差异[13]。重要的是我们制备的GNPs system,只有在到达具有酸性条件下的细菌或肿瘤环境后,响应性的形成较大尺寸的GNPs aggregates后,才具有较高效率的光热增敏效果。未到达机体的弱酸性环境时不会发生聚集,在近红外激光照射下温度几乎不升高。也就是说我们制备的GNPs system的光热增敏性能具有特异性,进一步的降低了激光对正常组织的热疗损伤。这在此后的动物实验中会展现出良好的优势。
最后,由于获得了较高的光热转换效率,我们制备的GNPs system获得了较理想的体外抗菌效果。不同检测抗菌效果的实验结果均表明,由于最初GNPs aggregates的产生,进而导致其具有很高的光热转换效率,最终导致了细菌在光热治疗中发生了严重的抑制和死亡。这与对照组PBS和GNPs-PEG2000比较展现出了显著的统计学差异。
总之,本研究成功制备的GNPs system,通过响应性聚集、近红外区域的紫外吸收信号明显增强、明显提高光热转换效率、程序化的实现了热疗对细菌的杀伤效果的提高。并且由于GNPs aggregates形成的响应性和敏感性,实现了对特定组织(细菌病灶部位或肿瘤组织)的特异性聚集,高效升温,最终实现了对细菌的特异性光热治疗[14]。本文所报道的可响应性聚集的GNPs system由于具有良好的光热转换性能和CT造影性能,可以将其用于多模态成像中探索肿瘤或细菌疾病的发展趋势或跟踪其治疗效果的研究,并希望能够在临床的诊疗领域做出一定的贡献。
