Annexin A2原核表达载体的构建及表达纯化
2019-06-27王德利汤海峰王宇石
王德利,杨 华,汤海峰,王宇石
(1.吉林大学生命科学学院,吉林 长春130012;2.吉林大学口腔医学院,吉林 长春130021)
在真核生物中,存在一类由钙离子介导的的膜磷脂结合蛋白——膜联蛋白Annexin家族,酵母和原核生物中未发现存在。Annexin最早是在劳什肉瘤病毒转化的鸡胚细胞中发现的。已发现的Annexin家族成员归为五类:A类为脊椎动物膜联蛋白;无脊椎动物膜联蛋白属于B类;真菌和部分单细胞真核生物被归为C类;D类为植物膜联蛋白;原核生物的膜联蛋白家族属于E类;另外还有40余种膜联蛋白仍待归类[1]。现已鉴定出人体内12种膜联蛋白家族成员(Annexin A1-A11,A13),广泛分布于胎盘滋养细胞、内皮细胞、巨噬细胞、肿瘤细胞内外[2]。膜联蛋白具有特异性的氨基端(表现在序列或长度各异)以及高度保守的羧基端。不同的膜联蛋白家族成员N端不同,而正是由于蛋白N端特异的结构域赋予了不同的膜联蛋白独特的功能[3]。Annexin核心位于羧基端,类似圆盘状,由约70个氨基酸残基组成。圆盘凸起面具有钙离子结合位点(所以在储钙离子的细胞器周围也能发现膜联蛋白分布),该结合位点由C端核心区域高度保守的膜联蛋白重复序列编码。已证实的Annexins的主要功能包括介导胞吞胞吐途径、对细胞骨架的调节作用、影响膜的通透性等[4]。氨基末端的特异氨基酸是结合信号转导蛋白激酶的磷酸化位点,此外,氨基末端还具有S100A10蛋白二聚体的结合位点(S100A10蛋白是一类EF手型Ca2+结合蛋白)[3,5]。
Annexin A2是膜联蛋白家族中的一员,又称胎盘抗凝集蛋白,p36,具有稳定细胞骨架和促进纤溶酶产生的作用,该蛋白还含有mRNA的结合位点[6]。作为钙依赖型结合蛋白的一员,Annexin A2不同于其余各类膜联蛋白家族成员之处在于能与包膜糖蛋白B结合[7],而这种结合是非钙离子依赖的。Annexin A2在细胞内外均有存在,但是Annexin A2不含有信号肽序列,所以推测Annexin A2出细胞膜是由另一种机制所介导的[8]。另外,研究表明,Annexin A2的表达失调与肿瘤的形成和发展关系密切,相关资料提示它可能在肿瘤的侵袭、转移机制的形成过程中起重要作用,且具有组织特异性,即对不同类型的肿瘤其表达水平不同[9]。比如在宫颈癌中表达上调,而在前列腺癌中表达下调[10]。Annexin A2在高转移恶性肿瘤中的异常表达,提示我们可以把Annexin A2 作为肿瘤基因治疗的靶分子,通过抑制其表达或中断其介导的信号转导通路,为抗肿瘤治疗提供新的思路[11,12]。因此,获得全长Annexin A2蛋白质,对Annexin A2的深入研究具有重要的推动意义。
1 材料与方法
1.1 材料
人肝癌细胞Hep G2、原核表达载体pEXS-GST、大肠杆菌菌株DH5α以及大肠杆菌菌株BL21由实验室提供。Fast-Pfu、反转录试剂盒、GST亲和树脂购于北京全式金生物技术有限公司。限制性内切酶、连接酶、RNA提取试剂盒DNA marker、PP蛋白酶购于Thermo Scientific。分子克隆、电泳、大肠杆菌培养所需生化试剂购于北京化工厂。
1.2 方法
1.2.1目的基因的获取
以人肝癌HepG2 cDNA为模板,利用Fast-Pfu和Annexin A2特异性引物(F:5’-TTGGATCCATGTCTACTGTTCACGAAATCCT-3’,R:5’-CCGCTCGAGTCATCTCCACCACACAGGTACA-3’) 进行扩增。PCR反应设置1个循环预变性(94℃,5 min)、30个循环进行扩增(94℃,20 s;62℃,20 s;72℃,80 s)以及一个循环完成扩增(72℃,10 min)。PCR产物经琼脂糖电泳和胶回收进行收集。
1.2.2重组载体构建
回收的PCR产物和原核表达载体pEXS-GST分别使用限制性内切酶BamHⅠ和XhoⅠ进行酶切反应(37℃,2h)。酶切反应产物经琼脂糖电泳和胶回收进行收集,按照PCR片段:质粒=3:1的比例进行连接(16℃,1h)。连接产物转化大肠杆菌菌株DH5α,37℃倒置培养过夜。单克隆经双酶切鉴定和测序,最终获得重组载体pEXS-GST-Annexin A2。重组载体转化大肠杆菌BL21,获得重组人源Annexin A2表达菌。
1.2.3重组Annexin A2-GST诱导表达
Annexin A2表达菌利用LB培养基进行培养,待OD600达到1.0加入1 mM IPTG,继续培养4 h,收集菌体。配置聚丙烯酰胺凝胶(上层5%,下层12%),利用SDS聚丙烯酰胺凝胶电泳检测Annexin A2的表达。
1.2.4重组人源Annexin A2蛋白质的纯化
活化冻存的Annexin A2-GST表达菌,于1 L LB培养基中37℃培养至OD600达到1.0。加1 mM IPTG,16℃培养过夜,收集菌体。利用溶菌酶裂解菌体,10 000×g 30 min离心去除沉淀,上清加入GST亲和层析柱。待裂解液与树脂充分结合,弃上清,洗杂,树脂加入PP蛋白酶4℃反应12 h。反应液经高效液相色谱浓缩,通过SDS-聚丙烯酰胺凝胶电泳检测蛋白质的含量。
2 结果
2.1 PCR产物鉴定
用RNA提取试剂盒提取人体肝癌细胞RNA,以全RNA为模板,Anchored Oligo(dT)18为引物,反转录出全cDNA。再以cDNA为模板,Pfu酶催化,PCR扩增出目的基因产物,进行琼脂糖凝胶电泳鉴定,目的基因大小约为1 000 bp,这与已报道的ANXA2的大小一致。结果如图1。
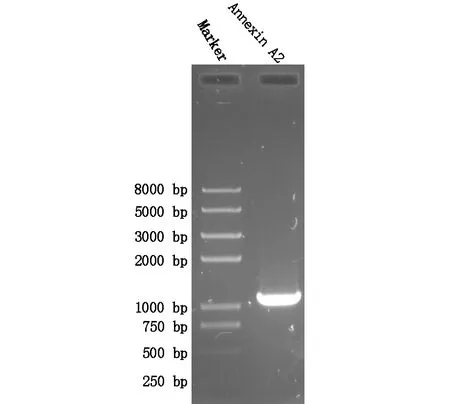
图1 Annexin A2 基因的PCR产物
2.2 目的基因和质粒双酶切结果
以大肠杆菌DH5α为质粒来源,按质粒提取试剂盒的要求和步骤提取质粒载体,对目的基因和质粒构建载体进行BamHⅠ和XhoⅠ双酶切,通过琼脂糖凝胶电泳对双酶切的结果进行检验,结果如图2。泳道0为Maker,泳道1中出现约1000bp大小的条带,进一步说明PCR产物中目的基因Annexin A2的存在;泳道2上样是双酶切的质粒,仅出现一条带,验证质粒双酶切。对目的基因和质粒进行双酶切也能实现目的基因和质粒构建载体的分离和回收。
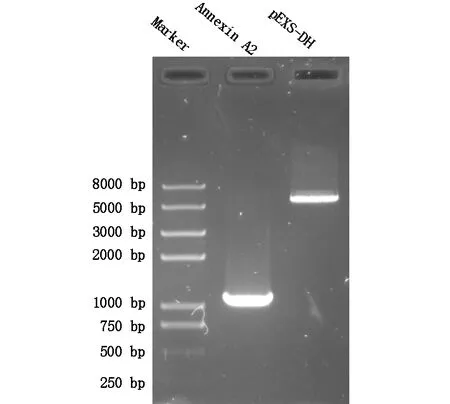
图2 目的基因和质粒载体双酶切电泳图
2.3 筛选转化子
将重组表达载体Annexin A2-DH转化入大肠杆菌DH5α中,用含氨苄青霉素的LB平板成功筛选出转化子。LB培养板含氨苄霉素,由于质粒pEXS-GST携带氨苄霉素抗性基因,所以能进行抗性筛选。导入质粒载体的菌落能在平板上生长,不排除质粒自连接。从平板上挑选4个大小合适的单克隆菌落,编号为1、2、3、4,分别移入5 ml LB液体培养基,过夜扩增培养后提取重组质粒进行双酶切鉴定。结果如图3,泳道 3有约1 000 bp的条带出现,说明编号3的菌落质粒成功连接并克隆重组子,即菌落3是带有重组子的菌落,而菌落1、2、4对应的泳道均未出现目的基因条带,其原因可能在于质粒的自连接,导致目的基因和质粒载体未成功连接。而由于质粒带有氨苄霉素抗性基因,故能够在涂有Amp的培养基上生长,这也是必须进行双酶切进一步鉴定重组是否成功的原因所在。切下含有ANXA2的凝胶条进行目的基因的回收,送到测序公司进行测序。测序结果验证与GenBank上的ANXA2序列结果一致。测序结果与GenBank序列比对见图4。
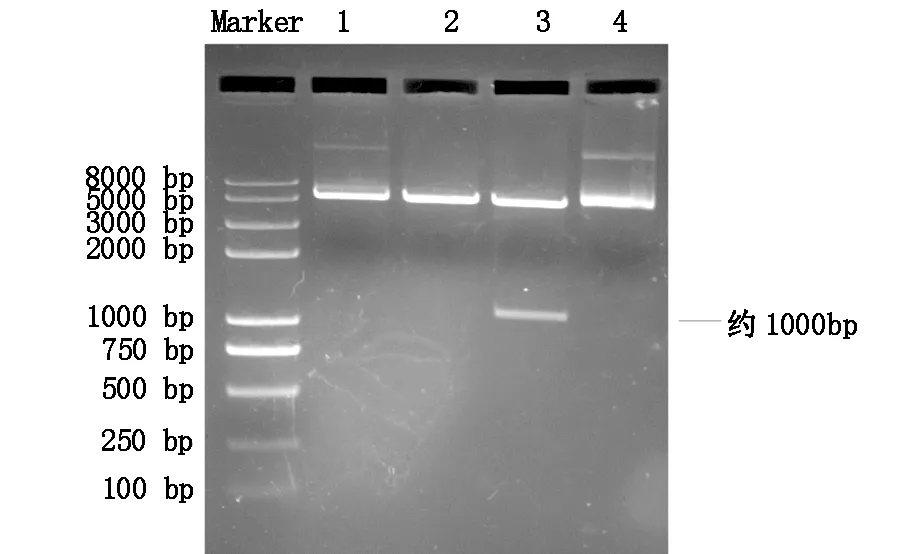
图3 重组质粒双酶切鉴定
2.4 重组蛋白表达鉴定
Annexin A2的表达实验筛选出重组子,即3号单菌落含克隆重组子。以测序验证正确的重组质粒(即3号单菌落对应的重组质粒)转化大肠杆菌BL21,经培养后加入诱导物IPTG,诱导重组蛋白的表达,培养5 h后,通过SDS-聚丙烯酰胺凝胶检验重组蛋白的表达。脱色漂洗后制干胶保存。结果显示55-70 kD之间的区域出现明显的条带,这与Annexin A2-GST蛋白的分子量(约为62 kD)相当,符合预期。图5中,与对照组(诱导前)的对比,实验组条带颜色较深,说明重组目的蛋白的含量多;而对照组该条带明显浅于实验组,说明目的蛋白含量少。结果符合预期。

图4 测序结果GenBank序列比对
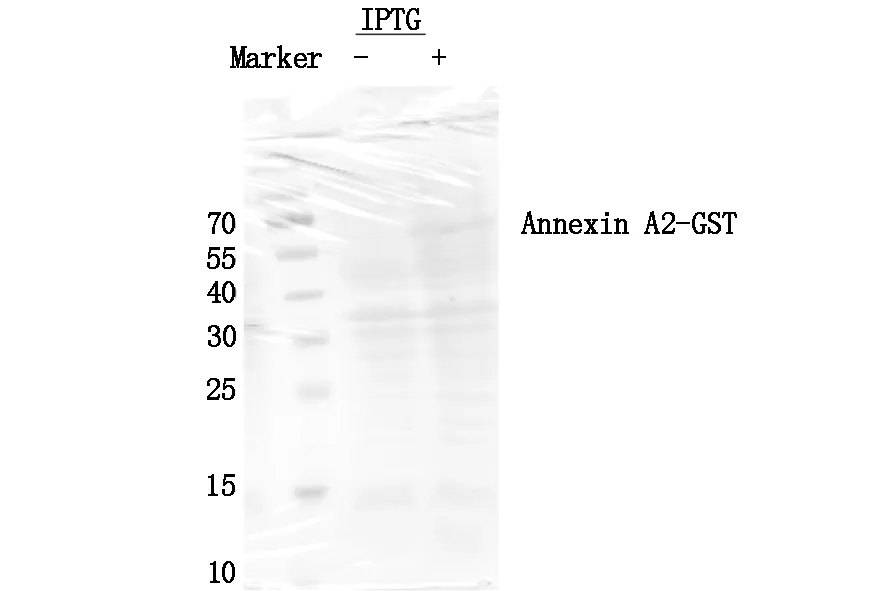
图5 Annexin A2-GST蛋白质诱导表达
2.5 重组人源Annexin A2的表达和纯化
蛋白质纯化的各组分经SDS-聚丙烯酰胺凝胶电泳分析显示,表达菌中包含重组Annexin A2-GST蛋白质(约62kD),经GST亲和树脂纯化后,洗脱液中基本不包含杂质蛋白质,而GST亲和树脂上也仅包含PP蛋白酶降解余下的GST片段(图6A)。通过高效液相色谱检测酶切反应液,反应液中组分相对单一,可直接分离获得高纯度的重组人源Annexin A2蛋白质(图6B),满足试验的预期,可利用此方法获得Annexin A2纯品蛋白质。
3 讨论
随着基因工程的发展,越来越多的原核和真核生物被应用到外源蛋白的表达上来,而大肠杆菌因为遗传背景清楚、易于操作、发酵便利等优势,普遍应用于多种外源蛋白的表达以及质粒的提取。为了适应不同应用的要求,研究者改造大肠杆菌菌株,得到了多种不同用途的菌株,如适用于质粒扩增的E.coli DH5α和用于表达的E.coli BL21菌株,本文借助大肠杆菌构建Annexin A2的原核表达体系,成功构建重组质粒并表达目的蛋白。本文根据Annexin A2的基因序列和BamHⅠ和XhoⅠ酶的酶切位点,设计并购买引物序列。从人肝癌细胞Hep G2中提取RNA,经逆转录得到cDNA,PCR得到目的基因片段,再与从E.coli DH5α中提取的质粒构建载体pEXS-GST连接成重组子,转化E.coli BL21并表达目的蛋白Annexin A2,从而得到了在原核生物中构建质粒载体并成功转化和表达Annexin A2蛋白的方法。为后续研究Annexin A2蛋白在脊椎动物体内的生理学功能提供了基础。但由于Annexin A2在人体内参与多种生理途径以及在不同肿瘤中的不均一表达,为其发展为癌症治疗的潜在靶点提出了挑战。
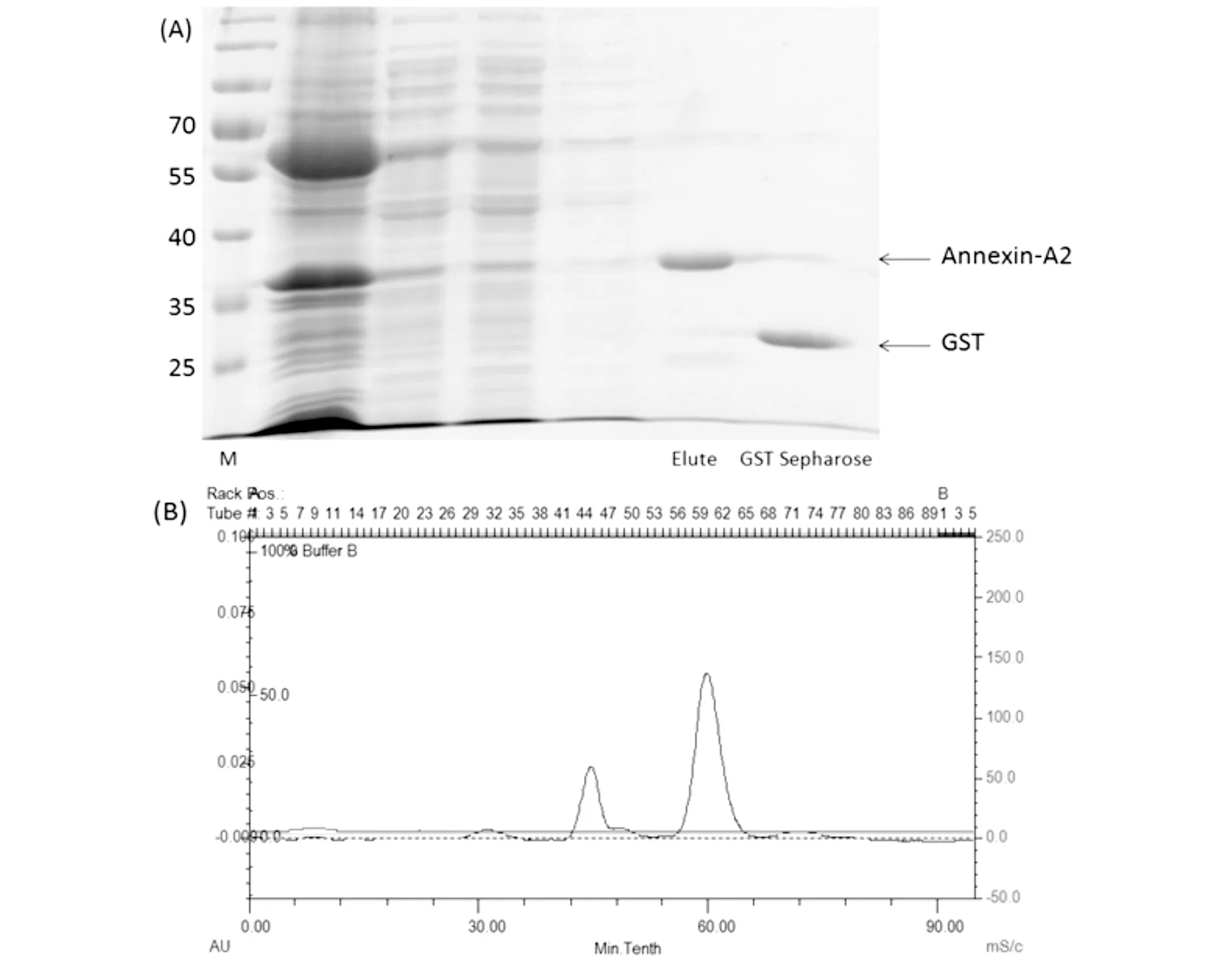
(A)和高效液相色谱(B)检测纯化的Annexin A2蛋白质。
