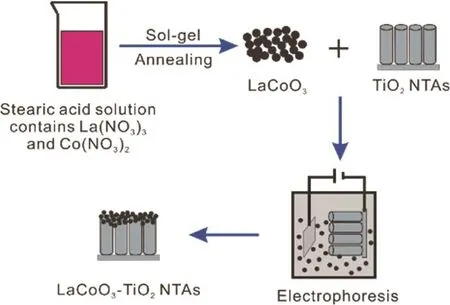
LaCoO3-TiO2纳米管阵列的构筑及可见光光催化性能
2019-06-27弓程向思弯张泽阳孙岚叶陈清林昌健
弓程,向思弯,张泽阳,孙岚,*,叶陈清,林昌健
1厦门大学化学化工学院化学系,固体表面物理化学国家重点实验室,福建 厦门 361005
1 引言
纳米科技自上世纪末问世以来,科研工作者们就对这一新兴领域开展了大量的研究1,2。作为热门研究对象之一,纳米二氧化钛(TiO2)已经在众多研究领域3-7表现出诱人的开发前景,作为具有污染小、环境友好、廉价易得、催化活性高等优点的半导体功能材料,已经在诸多如光分解水制氢8和量子点太阳能电池9等领域大放异彩。在多种形貌的纳米结构TiO2中,利用阳极氧化技术生长于Ti基底上的高度有序的TiO2纳米管阵列因其管长、管径易于调控以及阵列膜层与基底结合牢固等特点而备受青睐,然而宽的带隙导致其只能吸收利用约占太阳光4%-5%的紫外光10,极大地限制了对太阳能的高效利用,因此如何对TiO2纳米管阵列进行改性以增强其可见光响应成为研究者们的研究重点。
研究表明,在诸多常见的改性方法中,耦合窄带隙半导体是行之有效的手段之一。这些半导体主要集中于氧化铁/镍/铜等11-14金属氧化物、硫/硒/碲化镉15-18等含镉化合物以及铁酸铋19和铁酸镧20等无机钙钛矿型半导体等。钙钛矿型化合物可以用分子式ABO3表示,其中A可以为Ca、La、Bi、Sr等元素,B可以是Ti、Fe、Co、Ni等过渡元素21,通过替换A位和B位的金属元素均可改变ABO3的禁带宽度,从而影响其光催化性能。ABO3催化剂的禁带宽度一般比较小,对可见光有较好的吸收,因此将此类窄带隙半导体材料与TiO2纳米管阵列复合,有望提高TiO2纳米管阵列的光吸收能力,改善其可见光光催化性能。
钴酸镧(LaCoO3)是一种禁带宽度只有1.3 eV的窄带隙钙钛矿半导体材料22,作为拥有空穴多子的p型半导体材料,LaCoO3在可见光区有很好的光响应。已有的报道表明LaCoO3能有效光催化分解双酚A23并表现出优异的产氢性能24,将LaCoO3与TiO2纳米管阵列复合有望增强其可见光光催化活性。
合成LaCoO3纳米颗粒的方法主要有化学合成法23、固态高温煅烧25等,制备温度一般都在700 °C以上,而在此温度下TiO2纳米管阵列的微观结构会出现塌陷,严重影响其活性。本工作首先采用溶胶凝胶法制备高度结晶的LaCoO3纳米颗粒,然后采用电泳沉积的方法将LaCoO3纳米颗粒沉积到TiO2纳米管阵列上,并采用一系列研究手段考察和分析LaCoO3-TiO2纳米管阵列的可见光光催化性能。
2 实验部分
2.1 实验材料和试剂
Ti箔(纯度> 99.0%,厚度0.1 mm)由宝鸡海鑫钛镍有限责任公司提供。所用试剂HF (40%)、La(NO3)3·6H2O、Co(NO3)2·6H2O、柠檬酸、Na2SO4和甲基橙均为分析纯,且均为国药集团化学试剂有限公司生产。
2.2 LaCoO3纳米颗粒的制备
利用溶胶凝胶法合成LaCoO3纳米颗粒。首先以1 : 1的摩尔比配制Co(NO3)2和La(NO3)3的混合溶液,然后加入柠檬酸作为络合剂并搅拌至溶解,在90 °C下持续搅拌至干凝胶状态,最后在800 °C下退火3 h得到黑色LaCoO3纳米颗粒。
2.3 TiO2纳米管阵列的制备
将Ti箔(2 cm × 2 cm)先后用丙酮、乙醇、去离子水进行超声处理,干燥后作为工作电极,铂片为阴极,以0.5% (w,质量分数)HF水溶液为电解液在20 V电压下阳极氧化30 min。将样品用去离子水清洗并干燥后于450 °C退火2 h得到结晶的TiO2纳米管阵列。
2.4 LaCoO3-TiO2纳米管阵列的制备
将50 mg的LaCoO3纳米颗粒放入50 mL丙酮中超声处理得到悬浊分散液,然后加入1 mg碘单质作为修饰剂使LaCoO3纳米颗粒带正电。以TiO2纳米管阵列为阴极,Pt片为阳极,上述分散液为电解液,在20 V电压下进行电泳沉积,随后将样品清洗并干燥即得到LaCoO3-TiO2纳米管阵列。作为对比,以纯Ti箔作为工作电极在相同的实验条件下电沉积25 min得到Ti基LaCoO3样品。
2.5 样品的表征
应用日本Hitachi公司的S-4800扫描电镜对样品的表面形貌和膜厚进行表征。采用日本JEOL公司的JEM-2100透射电镜对样品晶体结构进行表征。采用日本Rigaku公司生产的Ultima IV型转靶X射线衍射(XRD)仪测试样品的晶体结构,Cu Kα靶,λ = 0.15406 nm,工作电流30 mA,工作电压40 kV,狭缝系统为1 DS-1 SS-0.15 mmRS。采用英国VG公司的Quantum 2000型光电子能谱仪测试样品的元素组成和价态,以C 1s (284.8 eV)为基准。采用美国Varian公司的Cary-5000型紫外-可见-近红外(UV-Vis-NIR)分光光度计对样品的光吸收特性进行表征。采用日本Hitachi公司生产的F-7000型荧光分光光度计表征样品的光致发光特性。
2.6 可见光光催化性能测试
光催化反应在石英双层夹套装置中进行。以甲基橙(MO)为模拟污染物,取30 mL浓度为5 mg⋅L-1的MO溶液放入反应器内层,外层持续通入30 °C的冷却水,将样品放入含MO溶液的上述装置中,持续搅拌60 min以达到吸脱附平衡,采用500 W的卤钨灯作为光源,光照强度为130 mW⋅cm-2,在样品与光源之间加一个滤光片,以滤去λ < 420 nm的紫外光,反应过程中持续搅拌并通入空气。光源开启后,每隔30 min从反应器中取出一定量的MO溶液,使用美国Unico公司生产的UV-2102型紫外-可见分光光度计测定MO的吸光度在光催化反应过程中随时间的变化,用以确定和比较催化剂的光催化活性。
3 结果与讨论
3.1 LaCoO3粉末的SEM、XRD与XPS表征
图1a为LaCoO3纳米颗粒的低倍SEM图。可以看出,经溶胶凝胶法合成的LaCoO3纳米颗粒尺寸均匀,粒径约为100 nm。能量分散X射线谱(EDX)(图1b)显示合成的纳米颗粒除含有La、Co、O元素外不存在其他杂质元素。从图1c的低倍TEM中能够更清楚地确定LaCoO3纳米颗粒的粒径约为100 nm,与SEM的结果一致。图1d是图1c中白色矩形区域的HRTEM图,晶面间距为0.384和0.272 nm的两类晶格条纹分别对应于LaCoO3的(012)和(110)晶面25,证明合成的纳米颗粒是LaCoO3。
图2为LaCoO3纳米颗粒的XRD谱图。可以看出,在2θ为23.22°、32.88°、40.65°、47.49°、53.23°、58.94°、68.93°和78.73°处出现了8个衍射峰,分别对应LaCoO3的(012)、(110)、(202)、(024)、(122)、(214)、(220)和(134)晶面(JCPDS No. 148-0123)25,这些衍射峰窄而尖,没有观察到其它衍射峰,说明制备的LaCoO3纳米颗粒较为纯净。
应用XPS能谱确定合成的纳米颗粒的元素组成与价态。图3a与图3b分别是La和Co元素的高分辨XPS图。结合能位于834.3和838.5 eV的特征峰对应于La 3d5/2,结合能位于851.6和855.6 eV的峰对应于La 3d3/226,表明La元素以+3价的形式存在;位于779.6和794.8 eV的特征峰与Co 2p一致27,表明Co元素与La元素一样为+3价,因此化合物的存在状态是LaCoO3。
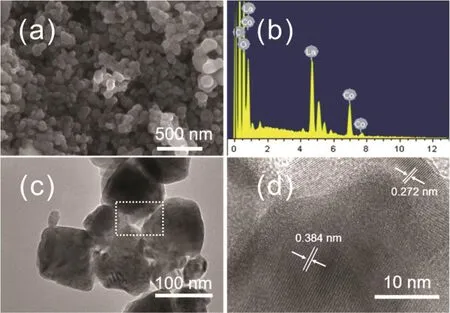
图1 LaCoO3纳米颗粒的SEM图(a)、EDX图(b)、TEM图(c)和HRTEM图(d)Fig. 1 SEM (a), EDX (b), TEM (c) and HRTEM (d)images of LaCoO3 nanoparticles.
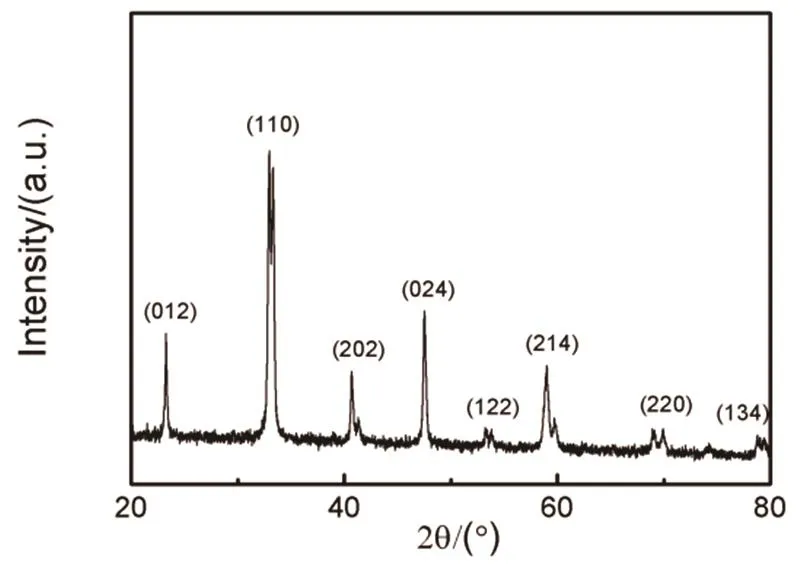
图2 LaCoO3纳米颗粒的XRD谱图Fig. 2 XRD patterns of LaCoO3 nanoparticles.

图3 LaCoO3纳米颗粒中La 3d和Co 2p高分辨XPS谱图Fig. 3 High-resolution XPS spectra of La 3d and Co 2p of LaCoO3 nanoparticles.
3.2 LaCoO3-TiO2纳米管阵列的表征
图4 是TiO2纳米管阵列和电泳沉积不同时间制得的LaCoO3-TiO2纳米管阵列的SEM图。经阳极氧化制得的TiO2纳米管阵列纳米管排列整齐、表面光滑、管径约90 nm (图4a)、管长约400 nm (图4b)。电泳沉积反应开始后,经I2修饰后的LaCoO3纳米颗粒在外加电场作用下向阴极的TiO2纳米管阵列定向移动并沉积于其表面。沉积时间为1 min时(图4c),由于LaCoO3颗粒的平均粒径大于纳米管的管径,因而负载于阵列表面,少量小尺寸颗粒嵌入纳米管口。随着电泳时间的延长,LaCoO3纳米颗粒的沉积量逐渐增加(图4d,e)。从图4d的插图可以看出,LaCoO3纳米颗粒聚集于管口而未进入管内。当电泳时间增加到25 min (图4f),纳米颗粒严重团聚,纳米管阵列表面大部分被LaCoO3纳米颗粒覆盖,没有观察到LaCoO3纳米颗粒脱落的现象,表明利用电泳法沉积的LaCoO3纳米颗粒与TiO2纳米管阵列之间有良好的结合力。

图4 TiO2纳米管阵列(a, b)和电泳沉积时间分别为1 min (c)、7 min (d)、15 min (e)和25 min (f)制得的LaCoO3-TiO2纳米管阵列的SEM图Fig. 4 SEM images of TiO2 nanotube arrays (a, b) and LaCoO3-TiO2 nanotube arrays prepared by electrophoresis for 1 min (c), 7 min (d), 15 min (e) and 25 min (f).
为了确定电泳沉积负载到TiO2纳米管阵列上的LaCoO3纳米颗粒晶体结构是否改变,对负载LaCoO3纳米颗粒前后的TiO2纳米管阵列进行了XRD测试,如图5所示。与TiO2纳米管阵列相比,沉积了LaCoO3纳米颗粒的TiO2纳米管阵列在2θ为23.22°、32.88°、47.49°及58.94°处出现了4个衍射峰,分别对应于LaCoO3的(012)、(110)、(024)和(214)晶面(JCPDS No. 148-0123)25,表明LaCoO3纳米颗粒成功地修饰于TiO2纳米管阵列上,而且电泳沉积对其晶体结构没有影响。从LaCoO3-TiO2纳米管阵列的XPS图(图6)可以看出,样品中La、Co元素结合能的位置与LaCoO3粉末一致,表明电泳沉积并未改变LaCoO3的价态。
3.3 LaCoO3-TiO2纳米管阵列的吸收光谱
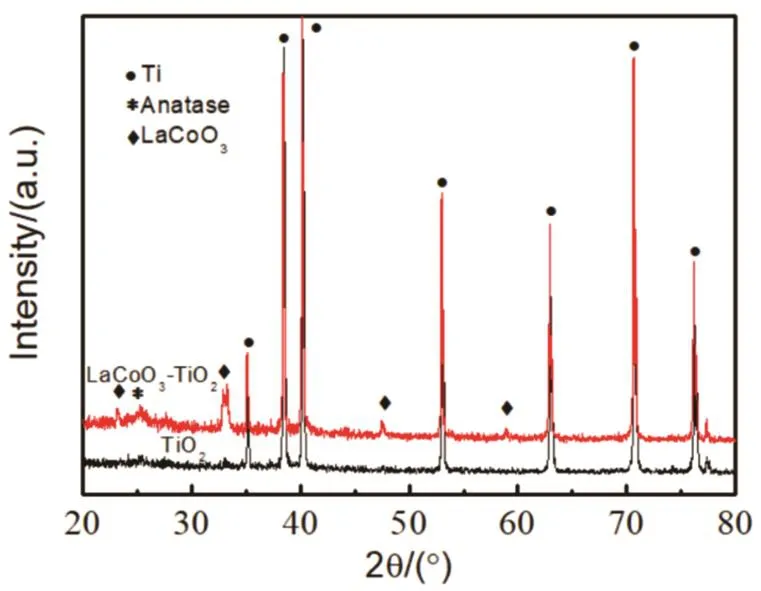
图5 TiO2纳米管阵列和LaCoO3-TiO2纳米管阵列XRD图Fig. 5 XRD patterns of TiO2 nanotube arrays and LaCoO3-TiO2 nanotube arrays.
LaCoO3纳米颗粒在TiO2纳米管阵列上的修饰旨在获得具有强可见光响应的LaCoO3-TiO2纳米管阵列复合材料,为此利用紫外-可见光漫反射光谱(DRS)对样品的光吸收进行了测试。图7为TiO2纳米管阵列、LaCoO3和不同沉积时间制得的LaCoO3-TiO2纳米管阵列的DRS谱图。TiO2纳米管阵列仅吸收波长小于387 nm的紫外光,源于其自身带隙28。电泳沉积1 min制得的LaCoO3-TiO2纳米管阵列的吸收带边向可见光区红移;当电泳沉积时间为7 min时,LaCoO3-TiO2纳米管阵列的吸收带边红移至480 nm,这归因于LaCoO3负载量的增加;电泳沉积15 min得到的LaCoO3-TiO2吸收与负载LaCoO3纳米颗粒的Ti箔的光吸收基本相同,这是因为纳米管表面大部分区域已经被LaCoO3纳米颗粒薄膜覆盖,同时表明复合样品的光吸收基本来自于LaCoO3自身;继续延长电泳沉积时间至25 min,复合样品的光吸收不再发生变化。可见,复合样品能够吸收较大范围的可见光。
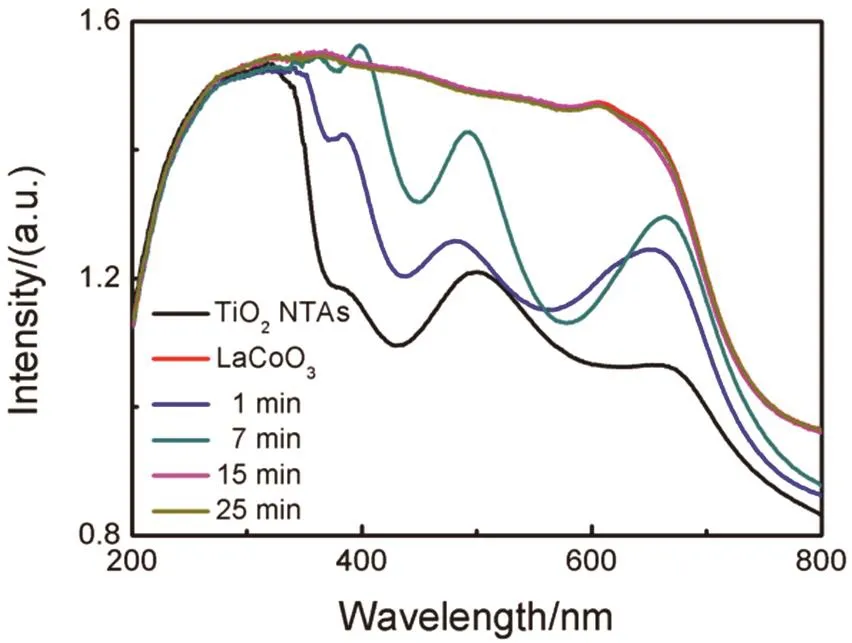
图7 TiO2纳米管阵列、LaCoO3和电泳沉积不同时间制得的LaCoO3-TiO2纳米管阵列的DRS谱图Fig. 7 DRS spectra of TiO2 nanotube arrays,LaCoO3 and LaCoO3-TiO2 nanotube arrays prepared by electrophoresis for different times.
3.4 LaCoO3-TiO2纳米管阵列的光催化性能

图6 LaCoO3-TiO2纳米管阵列的XPS图Fig. 6 XPS spectra of LaCoO3-TiO2 nanotube arrays.
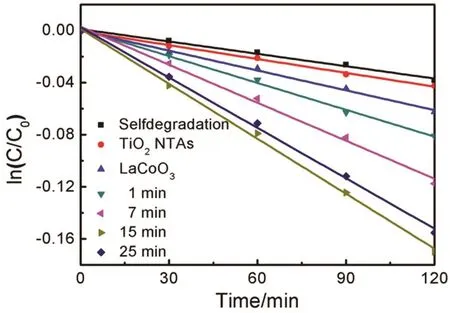
图8 不同光催化剂可见光光催化降解MO的动力学曲线Fig. 8 Kinetic curves of different photocatalysts in the photocatalytic degradation of MO under visible light irradiation.
以5 mg⋅L-1的甲基橙(MO)溶液为目标污染物进行光催化降解实验。不同光催化剂降解MO的动力学曲线如图8所示。可以看出,MO自身相对稳定,因而自降解能力很低,一级反应动力学常数为3.16 × 10-4min-1。TiO2受限于只吸收紫外光,因此TiO2纳米管阵列在可见光下基本没有光催化活性,其一级反应动力学常数为3.54 × 10-4,与自降解几乎相同。由于负载LaCoO3纳米颗粒的Ti箔能吸收大范围的可见光,因而对MO的降解速率较自降解和TiO2纳米管阵列明显提高。当LaCoO3纳米颗粒沉积于TiO2纳米管阵列后,得到的LaCoO3-TiO2纳米管阵列能被可见光激发,并产生活性基团,因而相较于TiO2纳米管阵列与LaCoO3对MO表现出明显增强的光催化降解能力。电泳沉积时间为1、7、15和25 min制得的LaCoO3-TiO2纳米管阵列光催化降解MO的速率显著提高,一级反应动力学常数分别为6.87 × 10-4、9.73 × 10-4、1.41 ×10-3和1.29 × 10-3min-1。电泳沉积15 min制得的LaCoO3-TiO2纳米管阵列光催化降解MO的速率逐渐最大,这是因LaCoO3-TiO2纳米管阵列的光吸收随着LaCoO3负载量的增加而增强所致。而沉积量过多(25 min样品)时,LaCoO3纳米颗粒在TiO2纳米管表面团聚并堆积成厚的膜层,一方面阻碍了染料分子进入TiO2纳米管内并被分解,另一方面形成了新的光生载流子复合中心,LaCoO3受激发产生的电子来不及转移到TiO2就与LaCoO3膜层的空穴发生复合,光催化活性反而下降,因而电泳沉积15 min制得的LaCoO3-TiO2纳米管阵列可见光光催化性能最佳,其光催化降解MO的速率大约是TiO2纳米管阵列的4倍。
3.5 光致发光测试与交流阻抗测试
借助光致发光谱(PL)可以很好地理解半导体在光照下电荷的复合行为。简单来说,半导体被光照射激发后,生成的电子与空穴会出现重新结合的现象,此时能量通过荧光的形式释放出来,荧光可以被仪器检测到。当荧光强度高时,说明复合现象比较严重,载流子的寿命比较短,而光催化性能越的样品光生载流子复合率越低,因而检测到的荧光越弱,PL的峰强越低29。图9a为TiO2纳米管阵列、LaCoO3和电泳沉积不同时间制得的LaCoO3-TiO2纳米管阵列样品的PL谱图。所有LaCoO3-TiO2纳米管阵列的PL峰均低于TiO2纳米管阵列和LaCoO3,表明复合LaCoO3后能有效地促进光生电子和空穴的分离。其中电泳沉积15 min制得的复合样品PL强度最低,光催化降解MO的速率最快。
利用电化学交流阻抗(EIS)进一步考察不同TiO2纳米管阵列光生载流子的分离以及TiO2纳米管电极/电解液界面电子转移特性。样品的电化学交流阻抗在0.1 mol·L-1Na2SO4溶液中进行测试,采用三电极体系。电化学交流阻抗Nyquist图的圆弧半圆半径代表着界面电荷的转移电阻与光生载流子的分离效率,圆弧半径越小,转移电阻越小,电荷迁移速率越快,光催化速率则越快。图9b为TiO2纳米管阵列、LaCoO3和电泳沉积不同时间制得的LaCoO3-TiO2纳米管阵列样品在可见光照射下的EIS谱图。相比于TiO2纳米管阵列与LaCoO3,修饰了LaCoO3纳米颗粒的TiO2纳米管阵列的圆弧半径显著变小,表明复合LaCoO3纳米颗粒后TiO2纳米管阵列的光生电荷转移电阻明显变小,可见光激发产生的光生电荷转移和分离的速度变快。而且电泳沉积15 min制得的LaCoO3-TiO2纳米管阵列的圆弧半径最小,因而光生电荷的转移速度最快,光催化活性最好。

图9 不同光催化剂的PL光谱(a)和可见光照射下的EIS谱图(b)Fig. 9 PL spectra (a) and EIS plots under visible light irradiation (b) of different photocatalysts.

图10 可见光照射下LaCoO3纳米颗粒和TiO2纳米管阵列之间光生电荷分离和传输示意图Fig. 10 Schematic illustration of the separation and transport of charge carriers between LaCoO3 nanoparticles and TiO2 nanotube arrays under visible light irradiation.
3.6 LaCoO3-TiO2纳米管阵列光催化机理
从光催化降解MO的结果可以看出,LaCoO3纳米颗粒的负载显著提高了TiO2纳米管阵列的可见光光催化活性,这是LaCoO3与TiO2作用形成p-n结的结果。图10给出了在可见光照射下LaCoO3和TiO2之间主要电荷转移过程示意图。LaCoO3和TiO2分别为p型半导体和n型半导体,当两者相互接触时会形成p-n结,促使费米能级产生移动,直至达到动态平衡,从而使LaCoO3的导带与价带均高于TiO2的导带和价带。在可见光的照射下,LaCoO3被激发而产生光生电子,光生电子在电子浓度梯度和p-n结形成的内建电场的作用下,LaCoO3导带的光生电子迅速转移到TiO2的导带,并在此积累,与此同时空穴被留在LaCoO3的价带上,光生电子的转移有效地促进了光生电荷的分离,并达到稳定的动态平衡。富集于TiO2导带的电子能与吸附O2反应,生成超氧自由基(·O2-),同时LaCoO3价带的空穴能与染料溶液中的氢氧根(OH-)作用,生成羟基自由基(·OH),这两种强氧化基团可以加速MO染料分子的分解,形成对环境无害的CO2与H2O分子等。因此,p-n结的形成是LaCoO3-TiO2纳米管阵列光催化活性明显增强的原因。
4 结论
采用溶胶-凝胶与高温退火相结合的方法合成了粒径均匀、结晶度高的LaCoO3纳米颗粒,然后应用电泳沉积的方法将LaCoO3纳米颗粒沉积于TiO2纳米管阵列上制得了LaCoO3-TiO2纳米管阵列。LaCoO3纳米颗粒与TiO2纳米管阵列之间结合力好。紫外可见吸收光谱显示,LaCoO3-TiO2纳米管阵列在250-700 nm的波长范围具有强的光吸收。光催化降解甲基橙(MO)的结果表明,电泳沉积15 min制得的LaCoO3-TiO2纳米管阵列可见光下光催化降解MO的速率是TiO2纳米管阵列的4倍。
