基于CdSe/ZnS量子点荧光生物传感器构建与应用*
2019-06-25唐志英孙泽坤冯泳林邵丽萍白忠臣
唐志英, 孙泽坤, 冯泳林, 邵丽萍, 白忠臣,
(1.贵州大学 医学院,贵州 贵阳 550025; 2.贵州大学 贵州省光电子技术与应用重点实验室,贵州 贵阳 550025)
0 引 言
荧光共振能量转移(Förster resonance energy transfer,FRET)是一种由于分子间长距离的偶极子发生偶极耦合,从而将一个受到激发的荧光分子(施体)的能量转移给另一个荧光分子(受体),使其荧光增强的物理过程[1~3]。由于其操作简便,实用性强,现在已经广泛地应用于司法鉴定、细胞标记、农草药等科学研究领域[4,5]。
过去使用FRET方法构建的能量体系,能量供受体的光学稳定性差,体系的荧光强度弱,生物相容性和对环境的敏感变化欠佳(如镧系元素、有机荧光染料),且由于其毒性较大,生物体内存在自体荧光和杂射光干扰,导致实验达不到预期效果,最终荧光传感器的发展与应用受到限制[6~9]。近年来,量子点(quantum dots,QDs)作为一种发光半导体,具有发射带窄,尺寸可协调,光化学稳定性强及单波长同时可激发多个粒子的特点被广泛应用,这是传统的材料在性能上无可比拟的。
随着现代研究技术的发展,越来越多的科学研究人员对生物传感器的灵敏度和可重复使用性展开了更加深入的研究,致力于发展实用性能强,应用范围广的生物传感器[10,11]。目前,Wang J等人构建了一个基于FRET平台的横向流动测试条,用于检测肿瘤细胞[12],实验设计的FRET生物传感器可以作为一种快速、有效的肿瘤细胞检测方法。
本文致力于构建一种基于荧光共振能量转移机理的量子点生物传感器,CdSe/ZnS量子点作为能量供体,荧光染料Cy3作为能量受体,通过构建FRET体系使得荧光染料荧光增强,从而弥补其在生物实验中的缺陷。实现了基于FRET机理构建的近红外区域能量转移体系的生物传感器的构建与应用,可以作为癌细胞形成初期的检测方法之一[13,14],为前列腺癌细胞形成初期的灵敏度诊断及特异性较差等问题提供了一种新的思路。
1 材料与方法
1.1 实验试剂与仪器
实验试剂:水溶性CdSe/ZnS(-NH2)量子点购于北京北达聚邦科技有限公司;荧光染料Cy3(C31H37KN2O8S2),购于南京拜恩特斯生物科技有限公司。实验所用溶剂不作特殊说明均用蒸馏水。RPMI—1640培养基购自CORNING(美国,纽约)公司,胎牛血清(fetal bovine serum,FBS)购于四季青公司,胰蛋白酶(Trypsin)购于HyClone(USA)公司;青链霉素购自Solarbio(中国,北京)公司,MTT试剂购自Solarbio(中国,北京)公司,二甲基亚砜(DMSO)购自Solarbio(中国,北京)公司。
实验仪器:高精度电子天平,磁力搅拌器加热台,超声清洗器,恒温水浴箱,移液枪,透射电子显微镜,光致荧光光谱仪(蔚海光学仪器上海有限公司),UV—6100S型紫外—可见光吸收光谱仪(上海精密仪器仪表有限公司),傅里叶光谱仪(德国布鲁克光谱仪器公司),荧光倒置显微镜(DMi8,Leica,德国),多功能酶标仪SYNERGY—H4(美国 Biotek),细胞恒温培养箱FormaTMⅡ3110系列水套CO2培养箱(Thermo Scientific公司产品),Allegra X—15R 台式冷冻离心机(美国BECAKMAN COULTER公司)。
1.2 实验方法
FRET体系的构建:将CdSe/ZnS量子点溶液和Cy3荧光染料按照摩尔比例为1∶0,1∶0.28,1∶0.4,1∶0.52,1∶0.76,1∶0.88,1∶1.2和1∶1.4混合加入反应样品瓶中,在常温、常压条件下搅拌5 min,对混合溶液进行荧光测定。
荧光光谱测定:在室温条件下,依次取0.1 ml量子点溶液与染料构建FRET体系溶液,反之依次取0.1 mL染料溶液与量子点溶液构建FRET体系溶液,以365 nm为激发波长,扫描精度为0.79 nm的Ocean Optics QED65000型荧光光谱仪进行测试,记录200~1 100 nm波长范围内的发射光谱变化。
傅里叶红外光谱测定:常温下将CdSe/ZnS量子点溶液,Cy3荧光染料和FRET体系溶液滴在云母片上,80 ℃下真空烘干24 h备用。分别将3种待测样品置于傅里叶红外显微镜光谱仪下进行测量,获得3种样品数据。
前列腺癌细胞荧光成像:将实验中需要使用的前列腺癌细胞分种在6孔培养板中。实验前需要将前列腺癌细胞培养24 h,细胞传代密度达到60 %~70 %即可。量取配制好的FRET体系溶液10 μL对前列腺癌细胞进行染色(pH=7.3),摇匀后在37 ℃,5 %CO2环境中培养5 min,移去培养液,用PBS清洗3遍,在荧光倒置显微镜下观察其细胞形态并进行荧光成像研究。
2 结果与讨论
2.1 CdSe/ZnS量子点与Cy3荧光染料FRET体系构建
经过紫外吸收及荧光光谱测试,CdSe/ZnS量子点的荧光发射光谱与Cy3染料的吸收光谱有较大的重叠面积,在图1标记出的阴影部分即为重叠部分,而CdSe/ZnS量子点的发射光谱的最大发射峰与染料的发射峰相距达到34 nm,可以有效避免供体与受体之间的荧光发射干扰。所以,CdSe/ZnS量子点与Cy3荧光染料符合构建FRET体系的基本条件,其中,供体CdSe/ZnS量子点与受体Cy3染料可成功地构建FRET体系。

图1 CdSe/ZnS量子点与Cy3荧光染料的吸收和发射光谱对比
通过查阅文献发现,供体CdSe/ZnS量子点表面游离的氨基(-NH2)可以与受体染料Cy3表面游离的羧基(-COOH)以化学键相结合的方式进行连接,可以使供受体之间的距离缩短。
图2中,CdSe/ZnS量子点在3 280 cm-1(-NH2)处存在明显的振动峰,Cy3染料在1 615 cm-1(-COOH)处存在振动峰。供体CdSe/ZnS量子点与受体Cy3染料的键合方式是通过CdSe/ZnS量子点表面的-NH2和Cy3染料表面的-COOH发生脱水缩合形成了肽键(-CO-NH-)。曲线1表示FRET荧光共振能量转移体系,该体系在1 570 cm-1(-CO-NH-)处的振动峰存在,证明了两种样品已经成功的键合,该峰在CdSe/ZnS量子点与Cy3染料单独的红外光谱中均不存在。并且在Cy3染料的傅里叶光谱中的1 615 cm-1处的振动峰在构建的FRET体系中明显减弱,证明该FRET体系已经成功发生键合。

图2 CdSe/ZnS量子点、Cy3荧光染料、FRET体系的FTIR光谱
2.2 CdSe/ZnS量子点与Cy3荧光染料浓度变化影响
为了探究CdSe/ZnS量子点与Cy3荧光染料所构建的FRET体系的最适宜荧光转移强度,本文对不同浓度的CdSe/ZnS量子点与Cy3所构建的FRET体系进行了荧光测试。在荧光强度的计算上,通过查阅文献使用Haugland和Styrer给出的公式E=1-ID-A/ID,其中ID-A,ID分别为有受体和无受体时供体的荧光强度。最后,经过测量供体荧光强度计算出量子点与染料构建的FRET体系的效率E。
可以从图3(a)看到,固定Cy3染料浓度,当量子点浓度逐渐增加时(0.1~0.5 μmol/L),Cy3染料的荧光强度发生了明显的变化,并且逐渐增强,实验证明量子点与荧光染料之间发生了明显的荧光共振能量转移。计算得到图3(b),从图中可以看出CdSe/ZnS量子点浓度与Cy3染料成正向线性关系,当CdSe/ZnS量子点浓度增加时,构建的FRET体系的荧光共振能量转移效率逐渐增强。发生这种现象的原因是当供体分子数量增加时,单个受体周围的平均分子数目增多,导致体系的荧光共振能量转移效率最终增大。
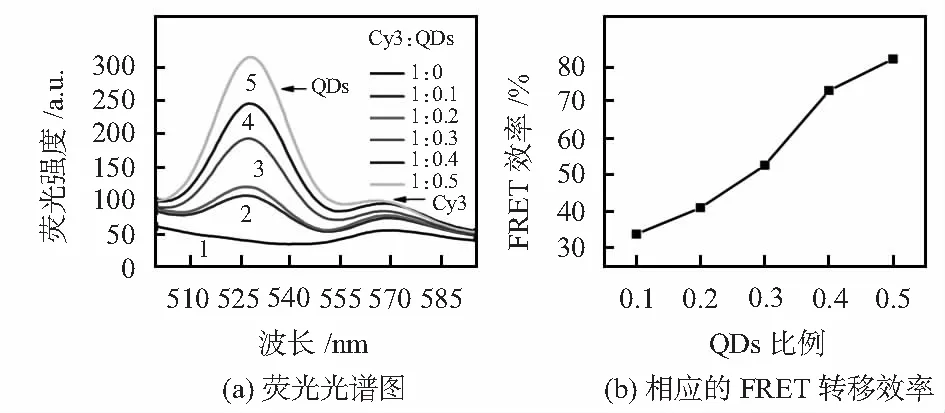
图3 改变CdSe/ZnS量子点浓度时的FRET体系
反向实验发现,当量子点浓度不变时,改变Cy3染料浓度,获得的FRET体系的荧光光谱图如图4(a)所示。从图中可以看出,当Cy3染料浓度增加时,量子点荧光强度逐渐减小,达到峰值即最大荧光转移效率后量子点荧光强度又开始增强。经过计算得到了图4(b)的Cy3染料改变后的荧光共振能量转移效率。由图4(b)可以看出,当受体浓度增加时,FRET体系的能量转移效率逐渐增大,在QDs∶Cy3的比例为1∶1.2时,荧光共振能量转移效率为最大值,产生这种现象的原因是由于随着Cy3染料浓度的增强,量子点周围所围绕的受体染料分子达到最大值,之后当量子点浓度再增加时,FRET体系的荧光共振能量转移效率减小。

图4 改变Cy3浓度时的FRET体系
2.3 pH值对FRET体系的影响
本文针对CdSe/ZnS量子点与Cy3荧光染料所构建的FRET体系的pH值改变进行了实验。如图5所示,将CdSe/ZnS量子点溶解于pH值为3,7,11,13的去离子水中,Cy3染料溶于pH值为2,7,11,13的去离子水中进行荧光光谱测试。由图5(a)可以看出,CdSe/ZnS量子点溶液随着溶液pH值的增大,量子点的荧光强度发生了明显的改变,对于表面含有-NH2的量子点溶液,强酸性条件下荧光强度最弱,这是由于溶液中含有大量的H+使得量子点表面氨基难以解离。反之当溶液偏碱性时,溶液中含有丰富的OH-,从而促进了量子点上-NH2的H+逃脱,但过高的pH值会使量子点的荧光降低。而对表面含有-COOH的Cy3染料而言,随着pH值的逐渐增加,染料的荧光强度明显减小,这是由于在强酸性条件下溶液中含有大量的H+使得染料表面羧基难以解离,而随着溶液中OH-离子浓度增加,染料表面的羧基解离,荧光强度减弱。

图5 CdSe/ZnS量子点与Cy3在不同pH值溶液中的荧光光谱
查阅文献发现,癌细胞在形成初期会存在pH值的细微改变,因此,本文在对构建荧光共振能量体系的供体和受体进行了pH值响应实验,发现通过调整FRET(CdSe/ZnS—Cy3)体系的pH值,可以对实验构建的体系产生微弱的荧光强度改变。从而,本文中提出一种对癌细胞形成初期系统微环境变化的检测方式,通过监控该FRET体系的pH值变化,最终实现对癌症的初期检测。
为了验证该荧光共振能量转移体系在pH值细微改变(pH=5.93~8.36)后荧光强度的变化,调整溶液pH值后进行荧光测试,得到图6所示结果。

图6 FRET体系在不同pH值溶液中的荧光光谱
从图6中可以看出随着溶液pH值的降低,FRET体系的荧光强度逐渐减弱,且荧光区分强度大,这表明该体系可以用来作为检测癌细胞形成初期pH值改变的荧光探针。
2.4 FRET体系对癌细胞检测应用
对于本实验构建的FRET体系,在生物应用方面首先使用MTT比色分析法验证该体系对细胞毒性。
从图7实验结果可以看出,24 h后随着FERT(CdSe/ZnS—Cy3)体系浓度增加,细胞活性降低,但还是有80 %以上的细胞存活,证明该体系具有良好的生物兼容性,可在生物细胞实验中应用。

图7 FRET体系细胞毒性测试
由于量子点具有特殊的荧光信号使得本文构建的FRET体系不仅可以对癌细胞形成初期的pH值进行检测,还可以对癌细胞进行荧光标记,如图8所示。通过设计荧光标记实验可以看出,其生长状态良好,细胞形态正常且为不规则多边形的前列腺癌细胞在经过FRET体系的染色后,没有出现细胞形态的变化,在不同荧光照射下,显示出了清晰的细胞轮廓,说明该生物传感器对细胞的毒性较低,可以作为荧光探针对癌细胞进行荧光标记,在实验中使用。

图8 FRET体系对前列腺癌细胞的荧光标记
3 结 论
研究表明:本文设计的CdSe/ZnS量子点和荧光染料Cy3的FRET系统具有较高的能量转移效率。当CdSe/ZnS量子点与Cy3染料的比例为1∶1.2时,荧光转移效率达到83.68 %。在溶液的pH=5.93~8.36范围内体系荧光变化敏感,还可用于检测前列腺癌细胞微环境变化,该荧光共振能量转移系统的建立对前列腺癌细胞识别和前列腺生物传感器的应用提供了一个新的思路。
