白花丹参内生真菌HBG16的抗凝血活性研究
2019-06-25张公安褚翠英王玉婷贾汝汝王维维张显忠张景芳李艳玲
张公安,周 晗,褚翠英,陈 夙,王玉婷,贾汝汝,孙 珂,张 芮,王维维,张显忠,张景芳,李艳玲
(泰山医学院生命科学学院,山东泰安 271016)
心血管疾病是引起人类疾病死亡的主要原因之一,血栓栓塞是心血管疾病最核心的病理过程[1]。目前临床上采用的抗血栓药物肝素,近年来发现不能抑制与纤维蛋白结合的凝血酶,这已成为血栓复发的关键因素[2-5]。随着人们对其发病机制研究与认识的不断深入以及药物设计和筛选技术的日臻成熟,研究安全有效、适于长期服用的抗凝血、抗血栓药物具有重要意义。
白花丹参(SalviamiltiorrhizaBge.f.alba)是紫花丹参的白花变异种,可有效改善血液流变学指标、降低血液粘稠度、降低血浆纤维蛋白原、抑制血小板聚集、阻止血栓形成、扩张微血管、改善微循环;白花丹参除了有紫花丹参的作用和用途外,对治疗血栓闭塞性脉管炎具有独特疗效[6-7]。但由于过度采挖,白花丹参野生资源濒临绝迹。因此,寻找一种可行的替代方法来生产这些药用活性物质成为当今的研究热点。
内生真菌(Endophytic fungi)是指在植物生活史中某一段时期生活在植物组织内,对植物没有引起明显病害症状的真菌[8],能够产生与宿主植物相同或相似的药用活性成分[9]。研究表明,丹参的根及根茎是最常用的活血化瘀中药之一[6],丹参根中的水溶性成分丹参素、丹酚酸A含有明显的抗凝血、抗血栓作用[10-13]。前期研究中,课题组从丹参植株内采用组织块分离法得到53株内生真菌[14],其中从白花丹参根部分离得到的内生真菌HBG16具有较好的抗凝血和抗氧化活性,且HBG16的发酵液经浓缩后,并无明显抗凝血活性,其抗凝血活性成分主要存在于菌丝体中[15-16]。因此,本文旨在考察HBG16菌丝体的不同溶剂粗提物对家兔的体外凝血时间(CT)、凝血酶时间(TT)、凝血酶原时间(PT)和活化部分凝血酶时间(APTT)等的影响,评价HBG16的抗血栓以及抗凝血作用,为研制安全无毒的新型抗凝血类药物提供新的资源和途径。
1 材料与方法
1.1 材料与仪器
健康的白花丹参植株(经泰山医学院药学院苏延友教授鉴定为唇形科植物白花丹参(SalviamiltiorrhizaBge.f.alba)) 2015年12月采自莱芜白花丹参种植基地;实验用家兔(1.5 kg,3月龄,共50只,雌雄各半) 泰山医学院实验动物中心;葡萄糖(AR)、柠檬酸钠 天津市巴斯夫化工有限公司;琼脂粉、肝素 北京索莱宝;无水乙醇(AR)、二甲苯、丙酮(AR) 天津市凯通化学试剂有限公司;甲醇(AR) 上海广诺化学科技有限公司;乙酸乙酯(AR) 国药集团化学试剂有限公司;0.9%生理盐水 辰欣药业股份有限公司;凝血酶原时间(PT)测定试剂盒、活化部分凝血酶时间(APTT)测定试剂盒、凝血酶时间(TT)测定试剂盒三种试剂盒 南京建成生物工程研究所。
SW-CJ-ZFⅠ类B型洁净工作台 苏州安泰空气技术有限公司;SPX-25085H-Ⅱ生化培养箱 上海新苗医疗器械制造有限公司;QYC-2102C全温培养摇床 上海新苗医疗器械制造有限公司;CX31RBSFA电子显微镜 OLYMPUS CORPORATION TOKYO JAPAN;JY-92-Ⅱ超声波细胞粉碎机 宁波新芝生物科技股份有限公司;TGL-16G台式离心机 上海安亭科学仪器厂制造。
1.2 实验方法
1.2.1 抗凝血活性丹参内生真菌HBG16的鉴定 首先按《真菌鉴定手册》[17]对已经分离得到的丹参内生真菌HBG16进行初步鉴定。采用改良SDS法提取基因组DNA,通过通用引物对ITS1/ITS4进行PCR扩增。引物:ITS1(5′-TCC GTA GGT GAA CCT GCG G-3′)和ITS4(5′-TCC TCC GCT TAT TGA TAT GC-3′)[11]。PCR体系为:10×PCR buffer 5 μL,25 mmol/L MgCl24 μL,2.5 mmol/L dNTP 4 μL,5 U/μL TaqDNA酶 0.5 μL,正反向引物(10 mmol/L各2 μL,DNA模板4 μL,ddH2O 28.5 mL,共50 μL。PCR反应程序:预变性94 ℃ 5 min,变性94 ℃ 1 min,复性55 ℃ 1 min,延伸72 ℃ 1.5 min,34个循环,后延伸72 ℃ 10 min。反应结束后取5 μL PCR产物,通过1.5%琼脂糖凝胶电泳检测。将PCR反应产物纯化后,送到上海铂尚生物科技有限公司测序后,将其序列与GenBank数据库中已登陆的序列进行Blast比对,搜索同源序列。采用MEGA 4.0软件Clustal X 1.81方法构建系统发育树。
1.2.2 HBG16液体发酵及其代谢产物粗提物的制备 挑取内生真菌HBG16接种在PDB培养液中,摇床(25 ℃,150 r/min)振荡培养7 d。6000 r/min离心10 min,收集菌丝体分别使用甲醇、乙醇、乙酸乙酯和丙酮进行超声波萃取3次,固液比为1∶20 g/mL,15 min/次。超声萃取完成后,萃取液进行合并、浓缩和蒸干后得到粗提的供试品。使用0.9%生理盐水∶甲醇7∶3 (V/V)作为溶剂,将粗提物配制成10 mg/mL的甲醇粗提物、乙醇粗提物、乙酸乙酯粗提物和丙酮粗提物。
1.2.3 凝血时间(CT)测定 按照表1的顺序添加试剂和样品。每组准备四支试管,分别编号甲、乙、丙、丁,甲试管加入混合液(0.9%生理盐水∶甲醇=7∶3,V/V)0.5 mL为空白对照;乙试管加入0.2%肝素钠0.5 mL为阳性对照;丙、丁为两个重复试验,各加入0.5 mL菌丝体粗提物。
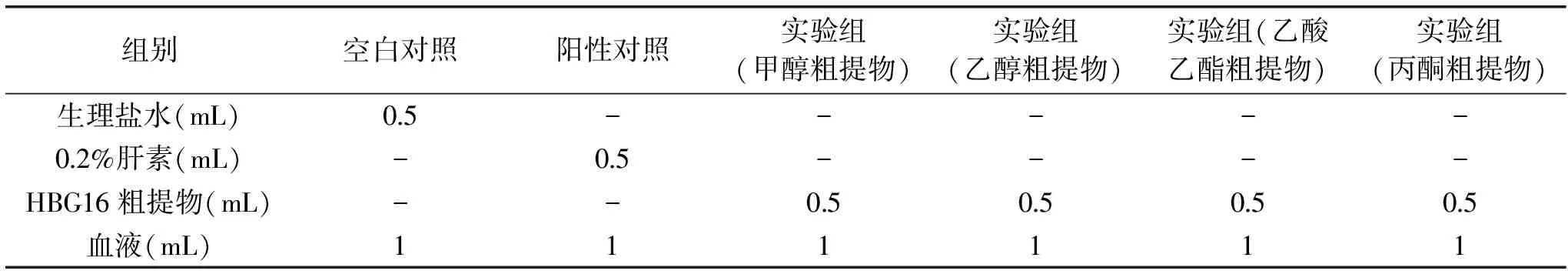
表1 CT测定实验设计Table 1 Experimental design of measuring clotting time
从家兔固定耳缘静脉或兔耳中央动脉采血4 mL,自血液进入注射器开始计时,三支试管各加1 mL血样,充分振摇后,将这些试管放入37 ℃的水浴锅中。每隔30 s倾斜试管一次,观察三支试管的血液凝固情况,直至将试管倒置血液不流动为止,取平均值。重复操作三次。分别测定甲醇粗提物、乙醇粗提物、乙酸乙酯粗提物、丙酮粗提物的凝血时间[18]。
1.2.4 血浆的制备 从家兔耳缘静脉取血9 mL,缓缓加入含有3.8%的柠檬酸钠抗凝剂1 mL至离心管中(9∶1,V/V),充分混匀,3000 r/min离心15 min,收集上清液。
1.2.5 凝血酶时间(TT)测定 取出3支试管,分别标记为空白对照组(0.9%生理盐水)、阳性对照组(0.2%肝素钠)、实验组(内生菌HBG16菌丝体不同溶剂提取液),按照表2的顺序添加试剂和样品,凝血酶使用之前,放入37 ℃恒温水浴锅孵育3 min,加好试剂后立即混匀,开启秒表,直到有纤维蛋白丝出现时,准确记录血浆凝固所需的时间,每个样品重复5次,计算平均值[18]。
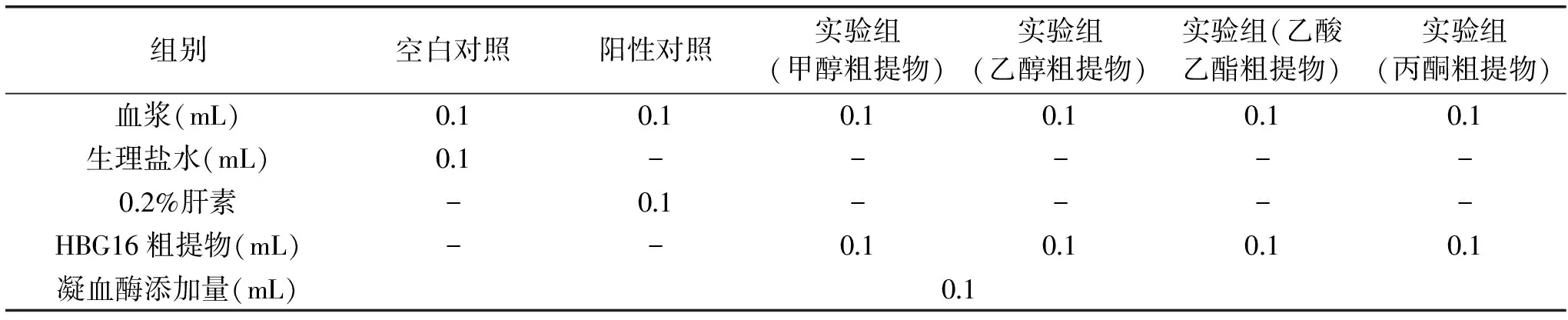
表2 TT测定实验设计Table 2 Experimental design of measuring thrombin time
1.2.6 凝血酶原时间(PT)测定 取出3支试管,分别标记为空白对照组(0.9%生理盐水)、阳性对照组(0.2%肝素钠)、实验组(内生菌HBG16提取液),按照表3的顺序添加试剂和样品。凝血酶原使用之前,放入37 ℃恒温水浴锅孵育3 min,加好试剂后立即混匀,开启秒表,直到有纤维蛋白丝出现时,准确记录血浆凝固所需的时间,每个样品重复5次,求平均值[18]。
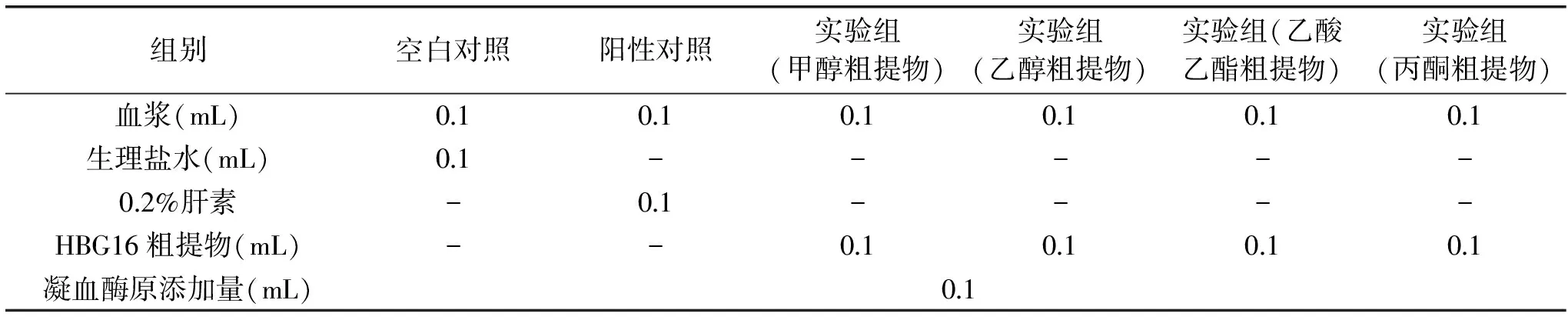
表3 PT测定实验设计Table 3 Experimental design of measuring prothrombin time
1.2.7 活性部分凝血酶时间(APTT)测定 取出3支试管,分别标记为空白对照组(0.9%生理盐水)、阳性对照组(0.2%肝素钠)、实验组(HBG16粗提物),按照表4的顺序添加试剂和样品。活化部分凝血酶使用之前,放入37 ℃恒温水浴锅孵育3 min,0.025 mol/L CaCl2要在37 ℃水浴中预热5 min,加好试剂后立即混匀,开启秒表,直到有纤维蛋白丝出现时,准确记录血浆凝固所需的时间,每个样品重复5次,求平均值[18]。

表4 APTT测定实验设计Table 4 Experimental design of measuring activated partial thromboplastin time
1.3 数据处理
用SPSS 13.0统计软件进行单因素实验分析。
2 结果及分析
2.1 HBG16菌株的鉴定
HBG16在PDA固体培养基上的菌落表面呈白色绒状,生长迅速(图1)。光学显微镜镜检,菌丝体无色,小型分生孢子为单胞或双胞大型分生孢子有少许弯曲,根据《真菌鉴定手册》,初步确定为镰刀菌属(Fusariumsp.)(图2)。
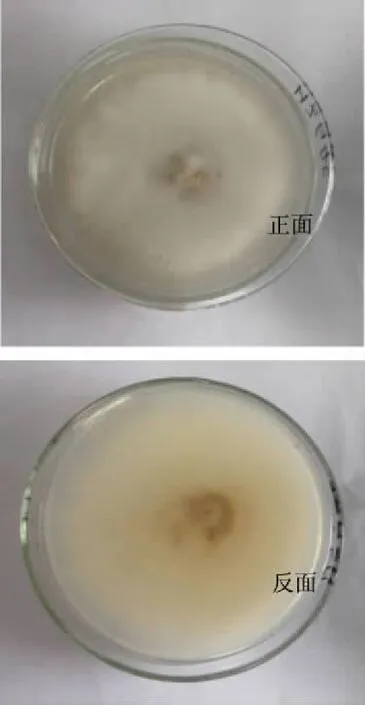
图1 白花丹参内生真菌HBG16的菌落特征
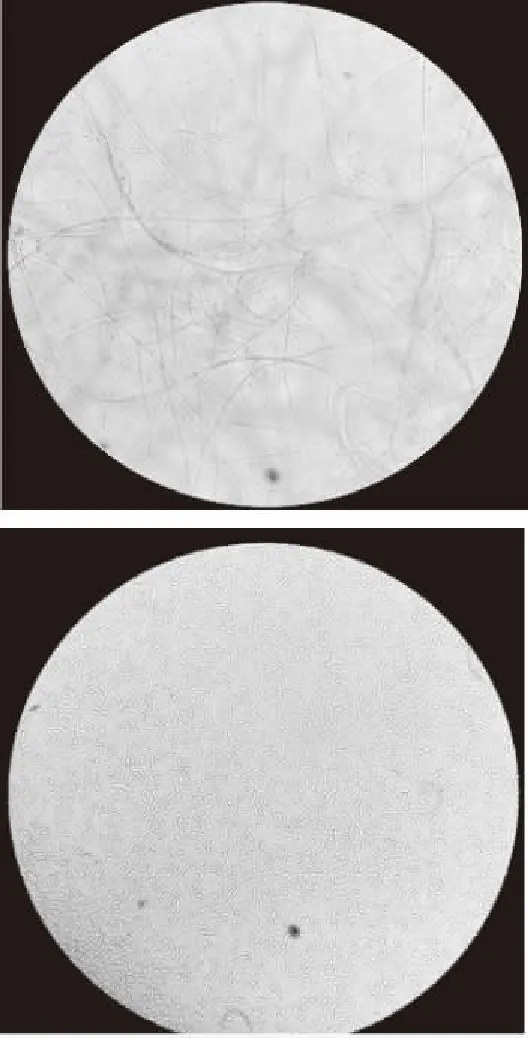
图2 光学显微镜下HBG16的形态特征(40×)
ITS序列在GenBank数据库中进行Blast比对后,选择同源性高于97%的菌株进行系统发育分析(图3),结果发现,HBG16与FusariumoxysporumKC869371.1、F.oxysporumKU364076.1和F.oxysporumKU170715.1聚在同一分支中,它们ITS序列的相似性达到99%。因此,将丹参内生真菌HBG16鉴定为尖孢镰刀菌(Fusariumoxysporum)。
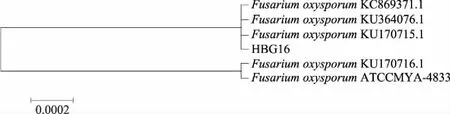
图3 丹参内生真菌HBG16的系统发育树
2.2 HBG16菌丝体不同溶剂粗提物对家兔CT的影响
HBG16菌丝体甲醇粗提物对家兔CT的影响结果见表5。从表中可以看出,家兔血液体外环境中,在没有添加任何抗凝剂的空白对照组中(357.50±20.00) s即凝固;阳性对照组血液不凝;菌株HBG16菌丝体甲醇、乙醇、丙酮粗提物组血液同样不凝,与阳性对照组效果相同;但是乙酸乙酯粗提物组对家兔CT无明显延长效果。
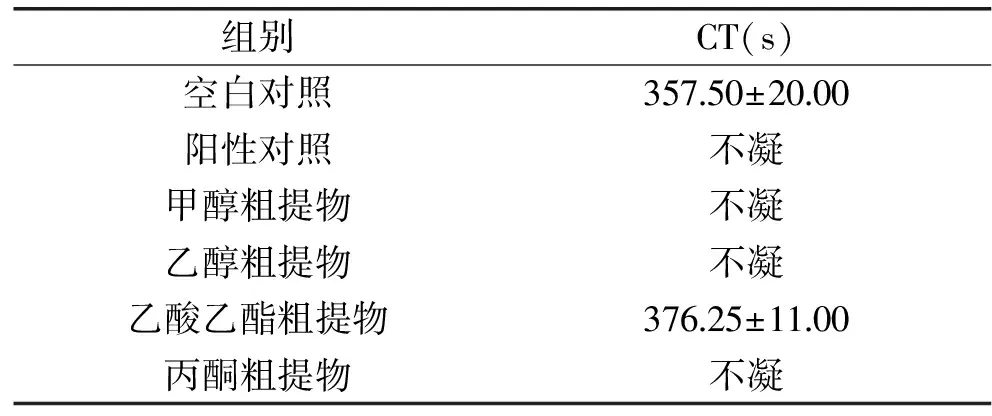
表5 HBG16菌丝体粗提物对家兔CT(s)的影响Table 5 Effects of HBG16 mycelium extract on clotting time
2.3 HBG16菌丝体不同溶剂粗提物对家兔TT的影响
HBG16菌丝体粗提物对家兔TT的影响结果见表6。从表中可以看出,空白对照在(24.67±0.67) s时出现纤维蛋白丝,肝素钠的阳性对照组对家兔TT具有极显著延长作用(p<0.01);HBG16发酵菌丝甲醇粗提物、无水乙醇粗提物对家兔TT均有显著延长作用(p<0.05),丙酮粗提物组的TT极显著延长。但乙酸乙酯粗提物对家兔TT无显著延长作用(p>0.05)。
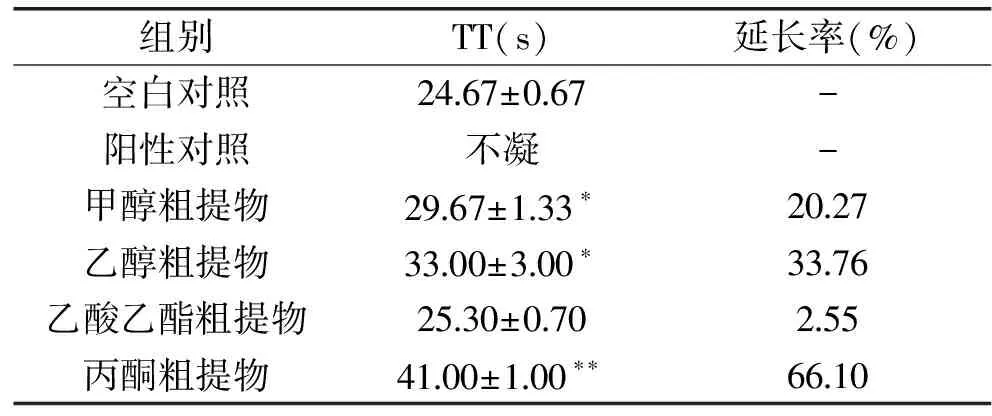
表6 HBG16菌丝体粗提物对家兔TT的影响Table 6 Effects of HBG16 mycelium extracts on thrombin time
2.4 HBG16菌丝体不同溶剂粗提物对家兔PT的影响
HBG16菌丝体不同溶剂粗提物对家兔PT的影响结果见表7。从表中可以看出,阴性对照在(19.00±2.00) s时出现纤维蛋白丝,肝素钠的阳性对照组对家兔PT具有极显著延长作用(p<0.05),加入HBG16发酵菌丝甲醇粗提物组对家兔PT具有显著延长作用(p<0.05),而无水乙醇粗提物、乙酸乙酯粗提物、丙酮粗提物样品组对家兔PT无明显延长作用(p>0.05)。
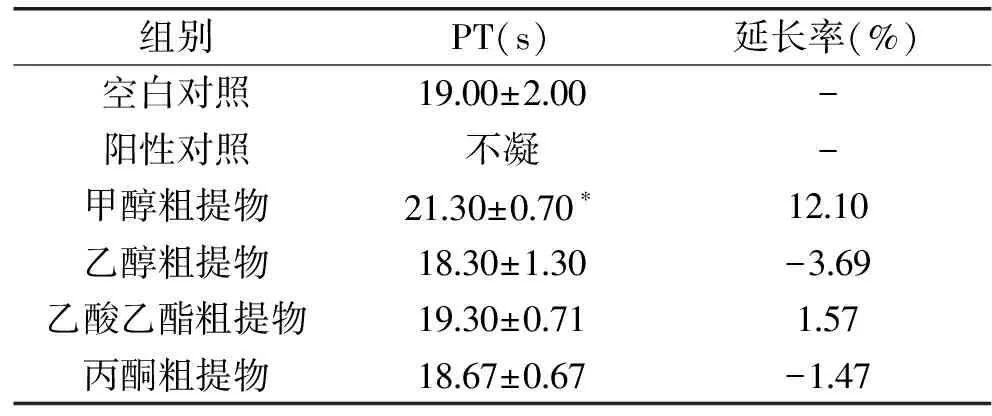
表7 HBG16号菌的发酵液粗提物对家兔对PT的影响Table 7 Effects of HBG16 mycelium extracts on prothrombin time
2.5 HBG16菌丝体不同溶剂粗提物对家兔APTT的影响
HBG16菌丝体不同溶剂粗提物对家兔APTT的影响结果见表8。从表中可以看出,阴性对照在(136.80±1.40) s时出现纤维蛋白丝,加入肝素钠的阳性对照组对家兔APTT具有极显著延长作用(p<0.01);HBG16发酵菌丝甲醇粗提物极显著延长家兔APTT(p<0.01),乙酸乙酯粗提物样品组显著延长家兔APTT(p<0.05)。而无水乙醇和丙酮粗提物对家兔APTT无明显延长作用(p>0.05)。

表8 HBG16菌丝体粗提物对家兔对APTT的影响Table 8 Effects of HBG16 mycelium extracts on activated partial thromboplastin time
3 结论与讨论
本研究从白花丹参根中分离到一株具有抗凝血活性的内生真菌HBG16,采用形态学和分子方法,鉴定为尖孢镰刀菌(Fusariumoxysporum)。HBG16菌丝体甲醇、乙醇和丙酮粗提物可以显著延长家兔的凝血时间(CT)、凝血酶时间(TT)以及活化部分凝血酶时间(APTT),但是对凝血酶原时间(PT)没有明显效果,说明其抗凝途径可能为内源性抗凝血途径。
内生真菌由于其次生代谢过程的复杂性和所处环境的特殊性,可产生与宿主成分药理相同或相似的一些结构新颖、活性显著的化学成分。丹参作为活血化瘀中药的代表,在治疗心脑血管疾病方法发挥着重要的作用。研究已证明,丹参的水溶性成分丹参素、丹酚酸A具有明显的抗凝血和抗血栓作用,在抑制血栓形成和保护心血管系统中发挥重要的药理作用[10-13]。因此可以推测丹参内生真菌菌丝体中可能会有某种单体或一类化合物参与凝血过程的某个步骤,这一步骤阻止时,血液不能凝固,从而抑制凝血过程,产生抗凝作用。
凝血过程是一系列的酶促作用的结果,该过程可以分为外源性凝血途径(extrinsic pathway,EP)、内源性凝血途径(intrinsic pathway,IP)和共同凝血途径(common pathway,CP)。内源性凝血途径是指凝血因子Ⅻ与表面的接触因子或者激活肽释放酶相互接触从而被激活,直到形成因子Ⅹa的过程;外源性途径是指组织因子与Ⅶa结合后直至形成因子Ⅹa的过程;共同途径则指的是从因子Ⅹa形成到形成纤维蛋白的过程,是内源途径和外源共同的作用过程[19-20]。根据血浆聚集状态的重要检测指标PT、TT和APTT,具体分析凝血过程是哪条凝血途径的酶促作用的结果;这三者是各自独立的基础性凝血途径筛选指标,分别反应了内源性凝血途径、外源性凝血途径和共同凝血途径的凝血状态。其中,PT是反映外源性凝血途径的指标,内源系统凝血酶的抑制与TT和APTT的延长有关[18,21]。下一步我们将对粗提物进行分离纯化进而确定其结构功能与活性成分,并对其具体的抗凝血机制进行深入研究。
