三叶青对呼吸道合胞病毒作用实验研究
2019-06-25王丹丹
王丹丹,高 荣,闫 滨
1山东中医药大学药学院;2山东宏济堂制药集团有限公司;3山东中医药大学中医学院,济南 250355
三叶青(Tetrastigmatishemsleyani)为葡萄科崖爬藤属植物三叶崖爬藤 (TetrastigmahemsleyanumDiels et Gilg),其块根名为蛇附子,别名有石猴子、石抱子、拦山虎等,药用部位为块根、果实或全草。据《中国植物志》记载,三叶崖爬藤全株供药用,具有活血散瘀、解毒、化痰的作用[1]。其性味微苦,归经平,无毒,具有清热解毒、活血散结、消炎止痛、祛风化痰、理气健脾等功效。三叶青产于浙江、江苏、江西等地,产地常用作民间用药,用来治疗感冒。我们经过文献和实验筛选,认为三叶青抗RSV病毒作用值得深入研究。
目前有关三叶青提取物的抗病毒作用研究,国内外对其的关注度不够,且研究深度不足,也未能从三叶青中提取分离出具有较为显著抗病毒活性的单体化合物。杨学楼等[2]发现三叶青提取物具有抗仙台病毒和流感病毒的作用,为三叶青应用于病毒所致疾病的防治提供了一定的依据;杨雄志等[3]研究了三叶青的乙酸乙酯、二氯甲烷、石油醚、正丁醇4个部分提取物的抗乙肝病毒活性,发现乙酸乙酯提取部位有显著的抑制HBV DNA拷贝的作用,提示三叶青提取物在体外有显著的抗HBV活性;杨大坚等[4]也发现三叶青脂溶性成分具有抗病毒作用。董宜旋等[5]发现三叶青提取物体外对 HIV-1 活性有一定的抑制作用,并进一步探讨其机制。
呼吸道合胞病毒(RSV)被认为是世界范围内婴幼儿病毒性支气管炎和肺炎疾病的主要病毒病原,是副粘液病毒科的RNA病毒[6],易由空气、飞沫或者直接接触病菌从而进入易感人群的呼吸道,在侵入机体后首先在鼻咽部粘膜上进行增殖,从而引起上呼吸道感染。而对于一些免疫力较为低下的婴幼儿及老年人,在RSV引起上呼吸道感染后,病毒可继续由鼻咽部向下到达各支气管甚至是肺,进而演变成严重的支气管炎、肺炎,严重时甚至会出现全身毒血症状[7]。鉴于RSV引起的疾病并没有针对性强的治疗药物,我们重点研究三叶青对RSV病毒的直接抑制作用。现将三叶青提取物体外抗呼吸道合胞病毒(RSV)实验结果报道如下。
1 材料与仪器
1.1 药物
1.1.1 药物提取
将干燥的三叶青块根捣至粗粉末,并用高速药物粉碎机粉碎为100目细粉末,将全部粉末分批用15倍量的60 wt%乙醇加热超声提取20 min,加热回流提取20 min,将提取液过滤并减压浓缩,滤渣用同样方法提取2次,将浓缩后的提取液用水混悬,得到混悬液,依次用石油醚、乙酸乙酯、正丁醇萃取(萃取溶剂与三叶青提取液混悬液的体积比在1.5:1),萃取中产生的乳化层用加热超声的方法破乳,至提取液几乎无色后停止萃取,将萃取液各部分分别减压浓缩干燥至恒重。实验所制备的三叶青60 wt%乙醇提取物,石油醚、乙酸乙酯、正丁醇萃取物、水部分,及乙酸乙酯萃取部位硅胶柱、水部分大孔树脂柱分离得到的各段样品。以上药物以DMSO溶解后,以细胞维持液配成试验所需浓度。
1.1.2 阳性对照药物
山东鲁抗辰欣药业股份有限公司生产的利巴韦林注射液(批号为1612246411),浓度为50 mg/mL。利巴韦林是广谱抗病毒药物,用作本实验的阳性对照药物。用PBS将其稀释到200 μg/mL的浓度,用0.22 μm的滤器过滤除菌,放置于-20 ℃冰箱备用。
1.2 细胞
MA104(恒河猴胚胎肾细胞)为RSV 敏感细胞,由山东省医学科学院基础医学研究所微生物室提供,本科室保存。
1.3 病毒
RSV(呼吸道合胞病毒,Long株,2000年10月引自中国预防医学科学院病毒所毒种室)
1.4 试剂及仪器
细胞培养液:1640细胞培养液,GIBCO 产品,含10%新生牛血清及100 U/mL青霉素和链霉素,过滤除菌,分装,置4 ℃备用;细胞维持液:1640细胞培养液,GIBCO 产品,含2%新生牛血清及100 U/mL青霉素和链霉素;PBS:Hyclone产品;细胞消化液:Hyclone产品。
仪器 酶标仪(Thermo公司),倒置显微镜(CKX-31Olympus公司),二氧化碳培养箱(隔水式,美国Forma公司),生物安全柜(苏净集团安泰公司),超低温冰柜(-80 ℃,中科美菱公司),冰箱(4 ℃、-20 ℃,海尔公司),高速台式离心机(TGL-16型,上海医疗器械六厂)。
2 方法
2.1 细胞的复苏与传代[8]2.2 接种96孔板单层细胞
当细胞在培养瓶内长成单层,处于对数生长期的MA104细胞可进行接种。倒出培养瓶中旧的培养液,加入3 mLPBS冲洗2次,加入0.25%胰酶适量进行消化,细胞回缩,细胞之间间隙增大不接连成片时,加入3 mL培养液,轻轻拍打培养瓶,并用移液管吹打成单细胞悬液,计数,用培养液稀释调整细胞密度为1×105/mL后,接种于96孔板内,每孔100 μL,37 ℃、5% CO2培养24 h,待长成单层细胞。
2.3 病毒扩增与保存[9]2.4 病毒毒力测定[10]
根据Reed-Muench公式,计算病毒的半数细胞感染量(TCID50)。由计算可得RSV的TCID50为10-4.78。实验时采用100个TCID50作为病毒液浓度[11]。
2.5 药物对细胞毒性测定
弃去已长成单层细胞的96孔板中的培养液,将受试药物用1640维持液按2倍比稀释依次加于96孔板中,每个稀释浓度平行3个孔,每孔100 μL。同时设正常细胞对照组,每孔加入1640维持液100 μL。置于37 ℃、5% CO2培养,每日观察细胞病变,连续3天观察药物毒性,记录细胞病变(CPE)百分率,CPE大于50%视为毒性。得到药物半数中毒浓度(toxic concentration 50%,TC50) 和最大无毒浓度(TC0)。
2.6 药物体外抗RSV试验[10]
将受试药物用细胞维持液从最大无毒浓度(TC0)开始做2倍比稀释共12个浓度,横向依次加入96孔板内的单层MA104细胞上,每孔50 μL,设细胞对照、病毒对照,利巴韦林为阳性对照(10 mg/mL),每个稀释度重复3孔。除细胞对照外,各孔加入100个TCID50的病毒液50 μL。37 ℃、5% CO2培养,每日显微镜下观察细胞病变,待病毒对照出现90%细胞病变,正常细胞对照生长为正常细胞形态。记录细胞病变(CPE)百分率,CPE小于50%视为有效。得到其药物半数有效浓度(concentration for 50% of maximal effect,EC50)。
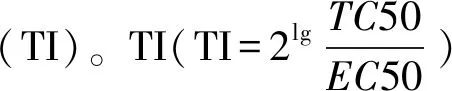
2.7 数理统计与显著性检验
本文表格中TC50、EC50由CPE观察得出。采用统计软件SPSS 17.0进行成对数据t检验,以α = 0.05为显著性水准,判断三叶青醇提物正丁醇萃取部分和乙酸乙酯萃取部分与阳性对照药利巴韦林间是否存在显著性差异。
3 结果
通过对三叶青乙醇提取物及其分别用正丁醇、乙酸乙酯和石油醚萃取得到的不同活性部位和正丁醇部位经大孔树脂分离的水洗脱部位和不同浓度乙醇洗脱部位(30%、50%、70%、95%)、以及制备液相分离纯化各阶段得到的样品和乙酸乙酯部位经硅胶柱层析、制备液相色谱分离纯化各阶段得到的样品进行抗病毒活性筛选。
3.1 抗病毒实验结果统计(正丁醇部位)
三叶青醇提物正丁醇萃取部分的抗RSV病毒实验结果(治疗指数TI)统计如下表1~3。

表1 正丁醇萃取部分粗提取液抗病毒实验结果Table 1 Antiviral results of crude extracts from n-butanol extraction
注:TC50和EC50以96孔板中稀释度表示。
Note:TC50andEC50were expressed in 96 hole plate dilution.
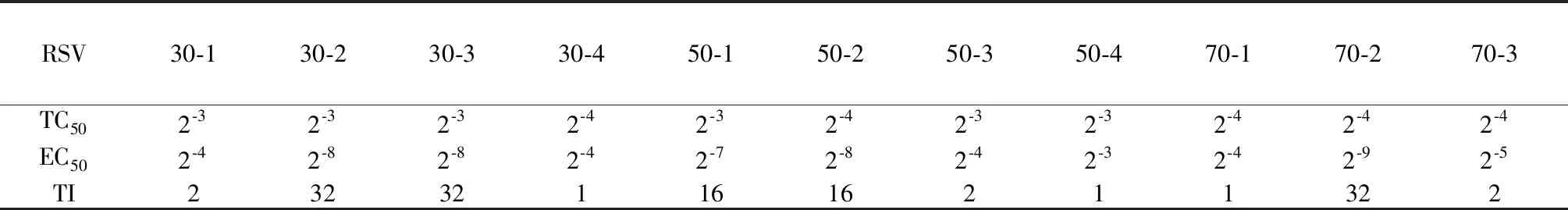
表2 正丁醇萃取部分各提取液洗脱部位抗病毒实验结果Table 2 The results of antivirus on the eluting site of the extracts of n-butanol extraction
注:TC50和EC50以96孔板中稀释度表示。
Note:TC50and EC50were expressed in 96 hole plate dilution.

表3 正丁醇萃取部分化合物抗病毒实验结果Table 3 Antivirus results of n-butanol extract compounds
续表3(Continued Tab.3)

样品SampleTC50EC50TI儿茶素(C3)Catechin2-32-68表儿茶素(C4)Epicatechin2-42-78山奈酚-7-O-鼠李糖-3-O-葡萄糖苷(C5)Kaempefent-3-O-glucopyranoside-7-O-rhamnopyranoside 槲皮素-3-O-β-D-葡萄糖苷(C6)Quercetin-3-O-β-D-glucoside2-52-52-62-724槲皮素-7-O-β-D-葡萄糖(C7)Quercetin-7-O-β-D-glucoside2-42-64山柰酚-3-0-芸香糖苷(C8)Kaempferol-3-O-rutinoside2-42-52山奈酚-7-O-β-D-葡萄糖(C9)Kaempferol-7-O-β-D-glucopyranoside2-52-88
注:TC50和EC50以96孔板中稀释度表示。
Note:TC50and EC50were expressed in 96 hole plate dilution.
由三叶青正丁醇萃取部位分离纯化各阶段的抗病毒实验结果可见,30%、50%、70%乙醇洗脱部位对呼吸道合胞病毒(RSV)的抑制作用较强,进一步将30%、50%、70%乙醇洗脱部位分为30-1、30-2、30-3、30-4、50-1、50-2、50-3、50-4、70-1、70-2、70-3共11个部分,其中,30-2和30-3的抗病毒活性较强,此外70 %洗脱部分分离得到的70-2部分活性也较强;从表2的11个部分中,进一步分离纯化并鉴定出的9个单体化合物(C1~C9)多数具有一定的抗病毒活性;随着分离纯化过程的进行,提取到的化合物抗病毒活性变弱,推测正丁醇部位可能是未提取分离得到的化合物在起作用,也可能是几种乃至几十种化合物协同作用的结果,或某些不稳定的化合物导致。
3.2 抗病毒实验结果统计(乙酸乙酯部位)
三叶青醇提物乙酸乙酯萃取部分的抗RSV病毒实验结果(治疗指数TI)见表4~ 6。
由乙酸乙酯部位抗病毒实验结果可知,三叶青乙酸乙酯萃取液甲醇∶氯仿=100∶0洗脱部分,甲醇∶氯仿=100∶15洗脱部分,甲醇∶氯仿=100∶30洗脱部分均有一定的抗RSV病毒活性,进一步分离得到的氯0-2、氯0-3部分对RSV病毒作用较强;乙酸乙酯部分分离纯化得到的化合物均有一定程度的抗病毒活性,总体上效果优于正丁醇部分,其中C11(山柰酚)、C12(5,7,4′-三羟基-3′-甲氧基黄酮)和C13(槲皮素)对病毒的抑制作用较强;随着分离纯化过

表4 乙酸乙酯萃取部分粗提取液抗病毒实验结果Table 4 Antiviral results of crude extracts from ethyl acetate extraction
注∶TC50和EC50以96孔板中稀释度表示。
Note:TC50andEC50were expressed in 96 hole plate dilution.

表5 乙酸乙酯萃取部分各提取液洗脱部位抗病毒实验结果Table 5 The results of antivirus on the eluting site of the extracts of ethyl acetate extraction
注:TC50和EC50以96孔板中稀释度表示。
Note:TC50andEC50were expressed in 96 hole plate dilution.

表6 乙酸乙酯萃取部分化合物抗病毒实验结果Table 6 Antivirus results of ethyl acetate extract compounds
注:TC50和EC50以96孔板中稀释度表示。
Note:TC50andEC50were expressed in 96 hole plate dilution.
程的进行,提取物的活性也逐渐变弱,推测乙酸乙酯部位的抗病毒活性可能是未知化合物或各种化合物协同作用的结果[12-18],也可能有部分化合物不稳定,在分离纯化及抗病毒实验过程中易氧化和被催化分解、或同其他化合物或试剂反应。和正丁醇部位的抗病毒实验结果类似,这些都有待于进一步的分离纯化及药理活性研究。
三叶青乙醇提取物正丁醇萃取部分和乙酸乙酯萃取部分对RSV的抗病毒效果均比阳性对照药利巴韦林,EC50为0.008 g/mL,TI为6.25显著(P<0.05)。三叶青提取物各部分对RSV均具有一定的抑制作用。其中,三叶青醇提物的正丁醇和乙酸乙酯萃取部分具有较为显著的抗病毒活性,乙酸乙酯萃取部分在提取后期对病毒的作用较强,其抑毒效果可能是几种化合物的协同作用或某些结构不明抑或是不稳定的化合物导致。
4 结论
现代药理作用研究指出,三叶青具有抵抗病毒感染、调节自身免疫的药理活性[19]。本实验通过对三叶青乙醇提取物及其分别用正丁醇、乙酸乙酯和石油醚萃取得到的不同活性部位和正丁醇部位经大孔树脂分离的水洗脱部位和不同浓度乙醇洗脱部位(30%、50%、70%、95%)、以及制备液相分离纯化各阶段得到的样品和乙酸乙酯部位经硅胶柱层析、制备液相色谱分离纯化各阶段得到的样品进行抗病毒活性筛选,从而得到三叶青的抗病毒活性部位,为三叶青在抗病毒领域的应用、抗病毒成分的深入研究及阐明三叶青抗RSV的作用机理,提供可靠的理论数据。
