彩叶花卉矾根“红贝露”的组织培养与快速繁殖技术研究
2019-06-25陆锦明上海市闵行区三农综合服务中心201109
陆锦明(上海市闵行区三农综合服务中心 201109)
矾根(Heuchera micrantha)又名珊瑚铃,为虎耳草科矾根属植物,原产于美洲中部,是一种多年生的彩叶花卉,其叶色丰富,有红、绿、橙、紫等多种颜色;花小,呈钟状,花期在4月—6月;性耐寒,最低可耐-34 ℃低温;幼苗长势较慢,成苗后生长旺盛。由于矾根叶片颜色丰富,且会随季节的不同而变化,被称为“上帝调色板”,是稀有的优良彩叶地被植物[1-4],且在冬季温暖地区叶子四季不凋,适合作花境、花坛、地被材料或庭院绿化材料。但由于很多矾根品种不结籽或种子细小而成苗困难,导致目前市场上优良矾根品种供不应求,且种苗价格较高,从而严重影响了优良矾根品种的推广应用[4]。
研究表明,利用生物技术进行矾根种苗的组织培养和快速繁殖研究,既可进行优良种苗的规模化繁育,又可克服矾根优良品种数量少、短期内无法快速推广的缺点。目前,关于矾根组织培养的研究虽已有一些报道,但组培成功的品种较少,且不同品种间的差异较大[5-9]。在此背景下,笔者拟以矾根红叶品种“红贝露”的嫩叶叶柄为外植体,开展矾根的组织培养与快速繁殖技术研究,以期为矾根优良种苗的规模化繁育提供技术支撑。
1 材料与方法
1.1 材料
供验矾根品种为“红贝露”,来自上海市农业科学院林木果树研究所花卉温室,取其幼苗叶片的叶柄作为外植体。
1.2 方法
1.2.1 外植体的消毒与培养
外植体的预处理:选取生长良好、无病虫害的矾根幼苗,于近基部剪取较嫩的叶片(带叶柄),在实验室内剪去叶片,用洗洁精清洗后用流水冲洗30~60 min,用70%酒精浸15 s后用蒸馏水清洗。
外植体的消毒:消毒剂选用0.1%HgCl2和8%NaClO3,消毒时间分别为5、10、15 min,共设6个处理,每处理接种48个外植体。
消毒后在超净工作台上用无菌蒸馏水冲洗 5~6次,最后用无菌纱布吸干外植体表面的水分,接种于初始培养基上,培养24 h后每天观察外植体污染情况,随时去除污染材料。
1.2.2 愈伤组织诱导与不定芽分化
利用1.2.1中最优的消毒方法消毒外植体,分别接种于不同诱导培养基(植物生长调节剂种类与浓度不同)上,见表2。每个处理接种48个外植体,每天观察外植体污染情况,随时去除污染材料。培养35 d后统计愈伤组织诱导率,并置于光照条件下继续培养30 d后,统计愈伤组织的不定芽分化率。
1.2.3 增殖培养
将不定芽分割为单芽,分别接种于不同增殖培养基上,见表3。每个处理接种6瓶,每瓶接种4个单芽。
1.2.4 试管苗的生根与移栽
生根培养:将丛生芽切割成单芽,分别接种于不同处理的生根培养基上,见表4。每个处理接种6瓶,每瓶接种6株。
试管苗移栽:将试管苗置于常温下,在瓶中炼苗3~5 d,再打开瓶盖继续炼苗1 d,然后用镊子轻轻取出试管苗,洗净其基部培养基后移栽于泥炭∶珍珠岩体积比为6∶1的基质中,移栽后浇足定根水,盖上塑料膜,以保温保湿。
1.2.5 培养基和培养条件
培养基:愈伤组织诱导和不定芽的分化、增殖培养所用的基本培养基均为MS培养基,附加蔗糖3%;生根培养所用的基本培养基为1/2 MS培养基,附加蔗糖2%。所有培养基均按试验需要添加植物生长调节剂,并附加琼脂粉0.6%,pH均为5.8,均经121 ℃、0.11 MPa的高温高压灭菌。
培养条件:愈伤组织诱导为黑暗培养;不定芽分化、增殖及生根培养均为光照培养,光照强度为30~35μmol/(m2·s),光照时间为12 h/d。培养室温度为(24±2)℃。
1.3 数据统计
外植体的污染率,于接种后24 h至培养10 d后每天统计并累计;外植体的褐死率,于接种35 d后统计;愈伤组织诱导率,于外植体培养35 d后统计;不定芽分化率,于愈伤组织光照培养30 d后统计;增殖系数,于增殖培养30 d后统计;试管苗根数、根长及生根率,均于生根培养30 d后统计;试管苗的移栽成活率,于移栽35 d后统计。
计算公式:污染率(%)=(污染的外植体数÷接种的外植体数)×100,褐死率(%)=(褐化死亡的外植体数÷接种的外植体数)×100,诱导率(%)=[诱导获得愈伤组织的外植体数÷接种的外植体数(去除污染数)]×100,不定芽分化率(%)=(分化不定芽的愈伤组织数÷光照培养的愈伤组织数)×100,增殖系数=增殖培养30 d后的有效芽数÷接种芽数,生根率(%)=(生根苗数÷接种苗数)×100,移栽成活率(%)=(移栽35 d后成活的试管苗数÷移栽试管苗数)×100。
数据采用SPSS 17.0软件进行方差分析(ANOVA)和多重比较分析(Duncan’s)。
2 结果与分析
2.1 消毒方式对外植体培养的影响
由表1可知,消毒剂种类和消毒时间对外植体培养的污染及生长情况影响较大。采用0.1%HgCl2消毒5 min时,外植体的污染率达22.9%,另有20.8%的外植体褐化死亡,成活率为56.3%;将0.1%HgCl2消毒时间延长至10 min时,外植体的污染被控制了,但外植体的褐死率大幅提高,成活率较低,仅为33.3%;当0.1%HgCl2消毒时间延长至15 min时,外植体全部死亡。采用8%NaClO3消毒5 min时,外植体的污染率达70.7%;将8%NaClO3消毒时间延长至10 min时,外植体的污染率大幅下降,仅为10.4%,成活率达81.3%,获得了较好的消毒效果;将8%NaClO3消毒时间延长至15 min时,外植体的污染率不变,但褐死率大幅提高,大大降低了外植体的成活率。综合分析认为,来源于温室培育的矾根幼苗叶柄外植体,经预处理后,采用8%NaClO3消毒10 min,是最佳的消毒处理方法。

表1 不同消毒方式对外植体成活的影响
2.2 愈伤组织的诱导与不定芽的分化
培养基中的植物生长调节剂种类和浓度配比对外植体的愈伤组织诱导及其不定芽的分化具有较大的影响。由表2可知,单加0.5 mg/L 6-BA的培养基不能诱导愈伤组织;单加0.5 mg/L NAA的培养基仅能诱导少量愈伤组织,但质量差不能分化出不定芽。培养基在含0.5 mg/L 6-BA的基础上添加0.2~2.0 mg/L NAA,愈伤组织诱导率及其不定芽分化率均呈现先升后降的趋势。其中,MS+BA 0.5 mg/L+NAA 0.2 mg/L培养基的愈伤组织诱导率和不定芽分化率分别为48.84%和28.57%;当NAA浓度提高至0.5 mg/L时,愈伤组织诱导率和不定芽分化率分别提高至82.50%和69.70%;继续提高NAA浓度至1.0 mg/L,愈伤组织诱导率和不定芽分化率开始下降,分别降为64.29%和55.56%。分析认为,愈伤组织诱导与不定芽分化的最佳培养基为MS+BA 0.5 mg/L+NAA 0.5 mg/L,在该培养基上,外植体暗培养15 d后开始形成愈伤组织,培养30 d后愈伤组织逐渐长大,并呈现半透明状;在光照条件下,继续培养2周后,部分愈伤组织开始转绿并逐渐分化形成不定芽,在光照条件下培养30 d,愈伤组织的不定芽分化达到高峰。
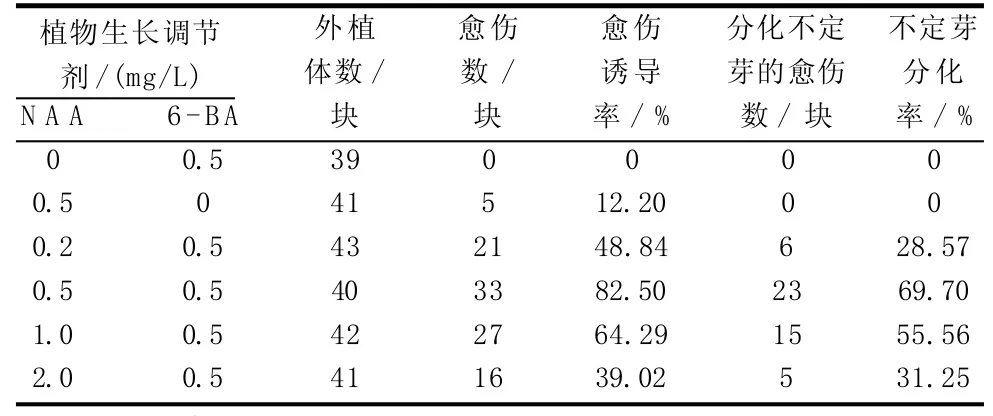
表2 不同植物生长调节剂对愈伤组织诱导及分化的影响
2.3 增殖培养
由表3可知,在含IAA 0.1 mg/L的MS培养基上,6-BA浓度在0.1~1.0 mg/L范围内,矾根芽的增殖系数呈先增后降的趋势,且各处理间差异达显著水平。在不添加植物生长调节剂的MS培养基上,矾根芽的增殖很慢,培养30 d后增殖系数仅为1.13;在MS+6-BA 0.1 mg/L+IAA 0.1 mg/L培养基上,培养30 后可显著提高其增殖系数,达2.88;继续提高6-BA浓度至0.2 mg/L,增殖系数达到最高值,为7.71,显著高于其他处理;继续提高6-BA浓度至0.5 mg/L,开始出现玻璃苗现象,有效芽数比MS+6-BA 0.2 mg/L+IAA 0.1 mg/L处理减少,芽的增殖系数开始降低,为6.41;继续提高6-BA浓度至1.0 mg/L,增殖芽细弱且产生大量玻璃苗,芽的增殖系数显著降低。综合分析认为,芽增殖的最适宜培养基是MS+6-BA 0.2 mg/L+IAA 0.1 mg/L,该培养基培养的芽丛生长健壮、增殖快。
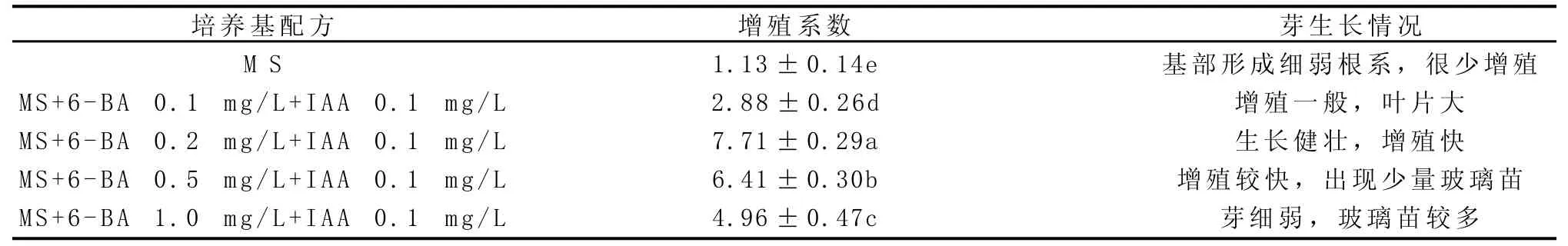
表3 不同培养基对芽增殖情况的影响
2.4 试管苗生根与移栽
由表4可知,生根培养基中,适当添加IBA可有效提高其生根率和生根数。在不添加IBA的1/2 MS培养基上,试管苗培养2周左右有部分小苗开始生根,但根系细弱、生长差。在含IBA的培养基上,矾根试管苗培养7 d后基部就开始长出白色根;培养30 d后大部分试管苗能形成完整的根系,且添加低浓度的IBA(0.2 mg/L),即可大幅度提高矾根“红贝露”试管苗的生根率(从69.44%提高到91.67%);当培养基中IBA浓度提高到0.5~2.0 mg/L时,试管苗的生根率均达100%。培养基中IBA浓度在0.2~2.0 mg/L范围内,矾根“红贝露”试管苗的平均单株生根数和根长均呈先升后降的趋势,其中,1/2 MS+IBA 1.0 mg/L培养基的平均单株生根数和根长均为最高,分别为23.33条和3.96 cm,当IBA浓度提高至2.0 mg/L时,生根数和根长均有所下降,平均单株生根数和根长分别为15.33条和2.88 cm,且试管苗基部产生少量愈伤组织,并有部分幼苗的叶片发黄。综合分析认为,矾根“红贝露”试管苗生根的适宜培养基是1/2 MS+IBA 1.0 mg/L,用该培养基培养的试管苗叶色较深,根系发达,植株生长良好。
将来源于1/2 MS+IBA 1.0 mg/L培养基的试管苗,经炼苗后移栽,恢复生长快,生长势良好,试管苗移栽成活率达95.33%。

表4 不同培养基对试管苗生根的影响
3 结论与讨论
根据已有文献报道,矾根组织培养一般以植株顶芽、茎尖、叶基组织等材料作为外植体进行初始培养[5-10],但这些方法对母株影响很大,有的甚至会对母株造成毁灭性伤害。本研究是以矾根叶柄作外植体,取材更容易,且对母株影响较小。
外植体消毒是建立无菌系的关键因子之一。HgCl2和NaClO3是组织培养中较常用的两种消毒剂,前者毒性大,消毒效果较好,但受使用浓度和消毒时间影响较大,如果消毒剂的使用浓度过低或时间过短很容易引起外植体污染,相反则容易杀死外植体而无法获得无菌系,且对环境影响较大。本研究中,以矾根“红贝露”幼嫩叶片的叶柄作为外植体,用HgCl2消毒易褐化死亡,效果不好;而经流水冲洗30 min、70%酒精消毒20 s后,再用8%NaClO3消毒10 min,可获得良好的消毒效果。该消毒处理方法对其它花卉进行组培时的外植体消毒具有一定的借鉴意义。
叶柄外植体在MS+BA 0.5 mg/L+NAA 0.5 mg/L培养基上经暗培养获得愈伤组织后,将其转移至光培养条件下,愈伤组织又在同一培养基上分化不定芽,省去了不定芽分化培养基的配制及分化培养的转接工作。
增殖系数是影响花卉组培繁育种苗效率的重要影响因子。一般情况下,适当增加细胞分裂素浓度即可提高培养物的增殖系数,但浓度过高,易产生玻璃苗,减少有效芽数,从而影响组培苗的繁殖效率。本研究结果显示,矾根“红贝露”芽增殖的最适宜培养基是MS+6-BA 0.2 mg/L+IAA 0.1 mg/L,当6-BA浓度高于0.5 mg/L时,容易出现玻璃苗,影响组培苗的繁殖效率。
试管苗的移栽成活率是植物组培技术能否真正应用于生产的关键,而试管苗的生根质量是影响其移栽成活率的主要影响因子。本研究结果显示,矾根“红贝露”试管苗生根的适宜培养基是1/2 MS+IBA 1.0 mg/L,采用该培养基培养的矾根试管苗叶色较深,根系发达,经炼苗后移栽,成活率达95.33%。
本研究建立了矾根的组织培养与快速繁殖技术体系,不仅为规模化繁育矾根优质种苗提供了技术支撑,还为矾根优良品种的推广应用奠定了基础。
