基于CRISPR/Cas9技术建立敲除Plac9基因的人胚肾细胞株
2019-06-25薛璐欧阳聪孙宁远秦绪慧
薛璐, 欧阳聪, 孙宁远, 秦绪慧
(中南民族大学 生命科学学院,生物医学研究所,武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉430074)
胎盘特异蛋白9(Plac9)是典型的在人胚4~6周低丰度表达,而之后3周内表达量有明显上升的新基因[1].它定位于人染色体10q22.3上,其cDNA含有典型的kozak序列,完整的开放阅读框,全长691 bp,编码91个氨基酸,分子量约为10 kb的含信号肽的蛋白[2].Plac9是新发现的基因,其功能尚不清楚,根据生物信息学分析预测Plac9蛋白与胚胎的骨骼发育、软骨生成以及胶原蛋白合成有关[1].CRISPR/Cas9基于细菌保护自身免受病毒感染的系统衍生而来,在细菌[3]、斑马鱼[4]、大鼠[5]及人类细胞[6]中均表现出较强的基因组编辑活性.CRISPR最早发现于原核生物大肠杆菌基因组的串联重复序列,随后Rodolphe Barrangou等证明这种串联重复序列广泛存在于细菌和古细菌中,说明它们参与了细菌和古细菌抵御外来噬菌体的入侵[7].CRISPR/Cas系统对DNA序列的特异性切割依赖于CAS和crRNA形成的蛋白核酸复合物对DNA序列上PAM区域的识别,利用这一特性可将其作为人工核酸内切酶(EEN),用以对基因组特定位点进行遗传修饰,实现基因组编辑[8].本文通过CRISPR/Cas9系统用流式细胞术分选技术构建Plac9敲除细胞系,进一步研究该基因的功能.
1 材料与方法
1.1 材料和试剂
人胚肾细胞株293T(武汉大学细胞库);PX458质粒、感受态细菌Stbl3、10XT4 Ligation Buffer、T4连接酶(武汉淼灵生物);T4 PNK, 10XTaq Buffer, dNTP, rTaq酶(TaKaRa);Fast Digest BpiI, Fast AP, 10X Fast Digest Buffer(Thermo Scientific);DTT(Biosharp);Endo-free Plasmid Mini Kite(Omega);AxyPrep DNA Gel Extraction Kit(AxyGen);DMEM高糖培养基、PBS(HyClone);血清(BioCell);双抗、胰酶、Lipofectamine 2000试剂(Invitrogen);BCA蛋白浓度测定试剂盒、PMSF、SDS-PAGE凝胶快速配制试剂盒、Tween-20、BeyoECL Plus、Loading buffe(碧云天);Protein Ladder(Thermo);CH3OH(分析醇);NaCl, Gly, KH2PO4, Na2HPO4·12H2O, CaCl2(国药集团化学试剂);Anti-plac9(Cell Signaling Technology);Anti-β-Actin, HRP-goat anti mouse IgG, HRP-goat anti rabbit IgG(康为世纪);引物合成、基因测序(武汉擎科生物).
1.2 sgRNA寡核苷酸链序列的设计
利用CRISPR在线设计工具网站http://crispr.mit.edu/,根据评分系统,分别在Plac9的外显子设计4个sgRNA(S1,S2,S3,S4).选择得分较高的序列,去掉PAM序列碱基,若第一个碱基不是G,则需要在前面补一个G,以sgRNA序列为模板,设计其互补链,再在其两端加上酶切位点即分别在编码链模板5′端添加CACCg,非编码链模板5′端添加AAAC,3′端添加C,设计的sgRNA序列见表1. 载体PX458和目的基因Plac9的结构图见图1.

表1 Plac9 sgRNA引物序列Tab.1 Prime sequences of Plac9 sgRNA

A) PX458质粒结构,有2个Bbs I酶切位点;B) sgRNA-S1的靶向识别位置及其周围的DNA序列图1 构建靶向Plac9的PX458质粒Fig.1 Construction of Plac9-targeting PX458 plasmids
1.3 PX458-sgRNA表达载体的构建和鉴定
用Fast DigestBpiI酶切质粒PX458,使其线性化,切胶回收后测其浓度.将sgRNA寡核苷酸链退火为双链,再与线性化的PX458连接,转化到stbl3感受态中,挑取阳性单克隆菌落,将菌液进行菌落PCR,再将有正确条带的菌落送测序验证是否构建成功.
1.4 细胞培养和细胞转染
293T细胞用DMEM高糖完全培养基培养在含5%的CO2,37 ℃恒温培养箱中.转染前24 h取对数期细胞以5×105个/孔的细胞密度接种到6孔板中培养24 h[9].提前2 h将6孔板中的培养基换成opti-MEM饥饿细胞,将2.5 μg质粒加入到125 μL的opti-MEM中,8 μL的lipo-2000加入到125 μL的opti-MEM中,静置5 min后,将它们轻轻混合,再静置30 min后加入到细胞中,3 h后换完全培养液,继续培养48 h.
1.5 流式细胞仪分选
将转染好的细胞用胰酶消化,用PBS洗2次后,过流式膜,将细胞放在流式管中,流式管预先放入3 mL含10%血清的PBS,准备好上机分选.选择single模式,根据阴性对照调节电压,设置阳性门后,开始将带有绿色荧光的细胞单个打至含20%胎牛血清的完全培养基的96孔板中[10].
1.6 单细胞培养
将筛选出来的细胞在96孔板中培养约15 d后转至24孔板中,待细胞密度长至80%再将细胞转入12孔板中,再转至6孔板中继续培养.
1.7 测序检测
收取6孔板中的细胞提基因组测序.筛选出编辑过的细胞系,将该细胞扩大培养,冻存1批,进行后续实验.
1.8 Western blot检测敲除效率
将测序结果正确的细胞提取蛋白质,用普通未做转染的293T细胞为对照,检测Plac9的蛋白表达量.先用SDS-PAGE凝胶配制试剂盒配分离胶和浓缩胶,插上梳子;再点样浓缩胶30 mA、80 V跑40 min,分离胶30 mA、100 V跑1 h.电泳完毕后,取出玻璃板,剥得分离胶,作好标记,将分离胶和膜按顺序放在转膜板上,轻轻赶出气泡,200 mA、100 V转膜1 h.再用5%的脱脂奶粉将转好的膜封闭1 h,用PBST洗1次后,加入1抗,4 ℃过夜.接着用PBST洗3次,每次10 min,室温下敷2抗1 h,PBST洗3次,每次10 min,最后ECL显影观察结果.
2 结果
2.1 重组质粒载体的检测结果
将单核苷酸序列退火连成双链后与线性化的PX458连接,转化到stbl3感受态中,挑取阳性单克隆菌液,做菌落PCR后,将有正确条带的菌液送测序.测序结果显示,sg-RNAS1, S2, S3, S4分别正确插入到PX458载体中.
2.2 lipo2000转染293T细胞结果
将构建好的载体用lipo2000转染到细胞中,48 h后用汞灯观察其转染效率,结果见图2.由图2可知,PX458和PX458-sgRNA-S1这两个质粒都成功转染到293T细胞中.
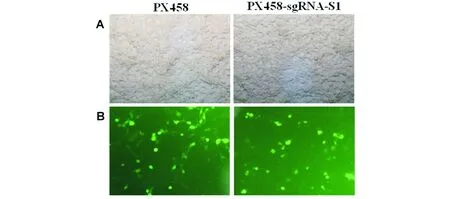
A) 明场下视野(10×); B) 荧光下视野(10×)图2 质粒转染293T细胞Fig.2 Plasmid transfected 293T cells
2.3 构建敲除Plac9基因的293T细胞株
将转染成功的细胞通过流式细胞仪筛选出单个带绿色荧光的细胞至96孔板中,培养后将细胞提基因组送测序检测是否有编辑过的细胞株,测序结果显示仅有PX458-H5对细胞进行了编辑,并用DNA MAN软件对测序结果进行比对,结果如图3.由图3可知:在方框处的碱基发生了编辑,并出现了明显的套峰,说明该基因已经被编辑了.

图3 PX458-sgRNA-S1的测序结果Fig.3 Sequencing results of PX458-sgRNA-S1
为进一步验证该细胞是否被编辑成功,实验运用错配酶进行验证,结果如图4.由图4可知:P为阳性对照,S为检测的样品(PX458-sgRNA-S1质粒成功转染到293T细胞后,提取该细胞的基因组),PX458为阴性对照.阳性对照和检测的样品均被错配酶切开,对照组未被切开.

图4 PX458-sgRNA-S1错配酶验证Fig.4 Mismatched enzyme verification of PX458-sgRNA-S1
2.4 Western blot结果
将筛选出来进行编辑过的细胞株提蛋白,以正常293T细胞为对照,观察Plac9的蛋白表达量,结果如图5.由图5可知,编辑过的293T细胞中Plac9蛋白的表达量明显少于未编辑的293T细胞.

图5 Western blot 检测PX458-S1的靶向敲除效果Fig.5 Targeted knock out effect of PX458-S1 by Western blot
3 讨论
基因编辑技术是研究基因功能的重要手段,早期的基因编辑技术大部分通过同源重组的方法对目的基因进行编辑,但编辑效率很低;而后出现了人工核酸酶技术,比如锌指核酸内切酶(ZFN)[11]和类转录激活因子效应物核酸酶(TALEN)[12],它们是通过DNA蛋白对靶点进行特异性识别,可设计结合任意基因组中DNA序列的模块化蛋白,对特定的DNA序列进行识别和编辑.CRISPR/Cas9系统是利用sgRNA识别特定的DNA序列,介导Cas9蛋白对靶点序列进行编辑,这种方法更加简洁、高效.
利用CRISPR/Cas9技术构建敲除细胞系一般需要用病毒作转染以提高转染效率,再用嘌磷霉素筛选细胞,用有限稀释法将筛好的细胞分为单个细胞培养;但使用病毒具有一定的安全隐患,本文先将sgRNA与PX458载体相连接构成表达载体,用lipo2000作转染,使转染好的细胞带有绿色荧光,再通过流式细胞仪将带绿色荧光的细胞分选为单克隆,培养好后提基因组测序,筛选出编辑过的细胞,再进行后续实验.这种方法避免了用病毒作转染,克服了转染效率不高的问题,不用有限稀释,省时、方便、高效.
Plac9基因是在人胚胎基因组中发现的在人胚4~6周低丰度表达,在7~9周高表达的一个新的基因[1],该基因功能尚未研究清楚,但它在7~9周对胚胎发育有着一定的作用.根据生物信息学预测可知,Plac9基因与胚胎的骨骼发育、软骨生成及胶原蛋白合成有关.本实验成功构建了Plac9基因敲除细胞系,可进一步深入地研究Plac9基因相关功能.
